人教(新课标)高中化学一轮复习:专题3离子反应
试卷更新日期:2022-01-05 类型:一轮复习
一、单选题
-
1. 下表中物质的分类组合完全正确的是( )
编组
A
B
C
D
强电解质
NaCl
Ba(NO3)2
H2SO4
H2S
弱电解质
HF
CH3COOH
BaSO4
NH3·H2O
非电解质
Cu
NH3
CO2
蔗糖
A、A B、B C、C D、D2. 下列指定反应的离子方程式书写正确的是( )A、醋酸与溶液混合: B、向溶液中通入: C、溶液中加足量溶液: D、铜丝插入热的浓硫酸中:3. 常温下的下列溶液中,各组离子能大量共存的是 ( )A、强酸性溶液中:K+、CH3COO-、Cl-、Na+ B、由水电离出的c(H+)=10-13 mol·L-1的溶液中:NH4+、K+、CO32-、SO C、0.1 mol·L-1 的Na2CO3溶液中:K+、Na+、Al3+、NO D、pH=3的溶液中:K+、Mg2+、Cl-、SO4. 下列各式中,属于正确的水解反应方程式是( )A、NH + 2H2O NH3·H2O+ H3O+ B、CO + 2H2O H2CO3 + 2OH- C、CH3COOH + OH- CH3COO- +H2O D、CH3COOH+ H2O CH3COO- +H3O+5. 已知在碱性溶液中可发生如下反应: 2R(OH)3+3ClO-+4OH-=2RO - +3Cl-+5H2O。则RO - 中 n的数值是( )A、1 B、2 C、3 D、46. 为检验溶液里的某种离子,进行下列实验,其中结论正确的是( )A、溶液中加 AgNO3 溶液有白色沉淀生成,再加入稀盐酸沉淀不溶解,溶液一定含 Cl- B、先滴加 KSCN 溶液不显红色,再滴加氯水后显红色证明某溶液中含有 Fe2- C、某溶液进行焰色反应为黄色,则该溶液一定含有 Na+ ,一定没有K+ D、溶液中加入稀 HCl,产生使澄清石灰水变浑浊的无色气体,则溶液中一定含 CO32-7. 下列反应的离子方程式书写正确的是( )A、金属铝溶于氢氧化钠溶液:Al+2OH =AlO+H2 B、用氢氧化钠溶液吸收少量二氧化碳:OH + CO2 =HCO3 C、向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液: Ca2+ + HCO+ OH= CaCO3 +H2O D、向硫酸铁酸性溶液中通入足量硫化氢: 2Fe3++S2-=2Fe2++S8. 向0.01mol L-1 Ba(OH)2 溶液中滴入几滴酚酞溶液,将电导率传感器插入溶液中,然后匀速加入 0.2mol/L 硫酸溶液,电导率与时间图像如图。下列说法错误的是( ) A、溶液由红色逐渐变为无色 B、a 到 b 段电导率降低的原因是Ba2+ 和O H 浓度降低 C、电导率最低点的离子方程式为Ba2++OH- +H++SO =BaSO4 +H2O D、b 到 c 段溶液中H+ 和 SO 浓度增大,导电能力增强9. 常温下pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( )
A、溶液由红色逐渐变为无色 B、a 到 b 段电导率降低的原因是Ba2+ 和O H 浓度降低 C、电导率最低点的离子方程式为Ba2++OH- +H++SO =BaSO4 +H2O D、b 到 c 段溶液中H+ 和 SO 浓度增大,导电能力增强9. 常温下pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( )
 A、该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl
A、该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl 四种离子
B、实验消耗Cu14.4g,则生成气体丁的体积为3.36L
C、可用焰色试验确定原溶液中是否含有Na+ , 若含有Na+灼烧时火焰呈黄色,是因为激发态的电子跃迁至基态,若未见黄色火焰则无Na+
D、一定没有Fe3+ , 但是无法确定是否含有I-
10. 分类法是化学学习的重要方法,下列说法正确的是( )
四种离子
B、实验消耗Cu14.4g,则生成气体丁的体积为3.36L
C、可用焰色试验确定原溶液中是否含有Na+ , 若含有Na+灼烧时火焰呈黄色,是因为激发态的电子跃迁至基态,若未见黄色火焰则无Na+
D、一定没有Fe3+ , 但是无法确定是否含有I-
10. 分类法是化学学习的重要方法,下列说法正确的是( )①冰水混合物属于纯净物,高分子化合物属于混合物
②CaCl2、NaOH、HCl、HT四种物质都是化合物
③0℃,101kPa,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L
④既能与酸反应又能与碱反应的氧化物属于两性氧化物
⑤AlCl3属于共价化合物,故AlCl3是非电解质;胆矾、苛性钠、冰醋酸、氧化钾均是电解质
⑥向新制氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度
⑦1molBrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子的物质的量为1mol
⑧碘的升华、NaOH潮解、胶体渗析、氯化钠溶液导电、煤的干馏均属于物理变化
A、①④⑦⑧ B、 ③④⑤⑥⑧ C、②⑤⑥⑦. D、①③⑥11. 某同学向一定体积的Ba(OH)2 溶液中滴加稀硫酸,测得混合溶液的导电能力随时间变化如右图所示。下列说法中,正确的是( ) A、实验过程中反应的离子方程式:Ba2++OH-+SO42-+H+=BaSO4↓+H2O B、AB段溶液的导电能力减弱,说明生成的BaSO4不是电解质 C、a时刻Ba(OH)2溶液与稀硫酸恰好完全中和 D、BC段溶液导电能力增大,是由于过量的Ba(OH)2电离出的离子导电12. 下列指定体系中氯离子浓度最大的是( )A、40mL0.2mol/L 的 KCl 溶液 B、20mL0.1mol/L 的 FeCl3 溶液 C、20mL0.5mol/L 的 KClO3 溶液 D、100mL0.2mol/L CaCl2 溶液与 100mL0.2mol/L 的 Na2CO3 溶液混合后的溶液
A、实验过程中反应的离子方程式:Ba2++OH-+SO42-+H+=BaSO4↓+H2O B、AB段溶液的导电能力减弱,说明生成的BaSO4不是电解质 C、a时刻Ba(OH)2溶液与稀硫酸恰好完全中和 D、BC段溶液导电能力增大,是由于过量的Ba(OH)2电离出的离子导电12. 下列指定体系中氯离子浓度最大的是( )A、40mL0.2mol/L 的 KCl 溶液 B、20mL0.1mol/L 的 FeCl3 溶液 C、20mL0.5mol/L 的 KClO3 溶液 D、100mL0.2mol/L CaCl2 溶液与 100mL0.2mol/L 的 Na2CO3 溶液混合后的溶液二、多选题
-
13. 常温下,向 某一元碱 溶液中逐滴加入 的 溶液,溶液中 中和率的变化如图所示。 为 的电离常数, 下列说法正确的是( )
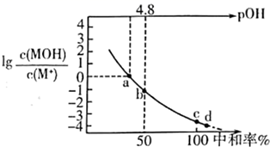 A、溶液中水的电离程度从a点到d点逐渐增大 B、a点时, C、b点时, D、c点时,14. 除去电石渣浆(CaO)清液中的S2- , 并制取石膏(CaSO4·2H2O)的流程如图所示:
A、溶液中水的电离程度从a点到d点逐渐增大 B、a点时, C、b点时, D、c点时,14. 除去电石渣浆(CaO)清液中的S2- , 并制取石膏(CaSO4·2H2O)的流程如图所示:
下列说法错误的是( )
A、过程I、II中起催化剂作用的物质是Mn(OH)2 B、17.2g石膏失水后质量变为14.5g,所得固体中CaSO4与结晶水物质的量之比为1:1 C、10L上清液(S2-浓度为320mg·L-1)中的S2-转化为 时,理论上共需要4.48LO2 D、过程II反应的离子方程式为4MnO +2S2-+9H2O= +4Mn(OH)2↓+10OH-15. 某溶液中只可能含有 中的几种离子,各离子浓度均为 。某同学进行了如图实验: 下列说法错误的是( )A、无法确定原溶液中是否含有 B、原溶液中肯定存在的离子为 C、沉淀A为 ,沉淀C为 D、滤液X中大量存在的阳离子有 和16. 利用如图所示装置进行实验,能达到相应实验目的的是( )
下列说法错误的是( )A、无法确定原溶液中是否含有 B、原溶液中肯定存在的离子为 C、沉淀A为 ,沉淀C为 D、滤液X中大量存在的阳离子有 和16. 利用如图所示装置进行实验,能达到相应实验目的的是( )选项
①
②
③
实验目的

A
浓
蔗糖
品红溶液
检验是否有 生成
B
稀
某盐溶液
澄清石灰水
检验盐溶液中是否含有 或
C
浓盐酸
溶液
比较非金属性:Cl与S
D
浓
浓盐酸
悬浊液
比较 与
A、A B、B C、C D、D三、填空题
-
17.(1)、现有以下物质:① 晶体 ② ③液态醋酸 ④铜 ⑤固体 ⑥纯蔗糖 ⑦酒精 ⑧熔融的 ⑨氨水 ⑩液氮.
请回答下列问题.(填相应序号)
上述物质能导电的是;属于非电解质的是;属于强电解质的是;写出⑧的电离方程式: .
(2)、一定条件下,冰醋酸加水稀释过程中溶液的导电能力如图所示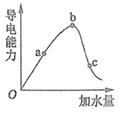
①a、b、c三点对应的溶液中,醋酸电离程度最大的是; 最小的是 .
②在稀释过程中随着醋酸浓度的降低,下列始终保持增大趋势的量是
A. B. C. 分子数 D.
(3)、已知 时, 的电离平衡常数 的电离平衡常数 ,试写出下列情况下发生的离子反应方程式:①向 溶液中通入少量 :
②向 溶液中滴入少量新制氯水:
18. 某化学兴趣小组设计了如图装置,该装置能制取 Cl2 , 并进行相关性质实验,且可利用装置A 储存多余的氯气。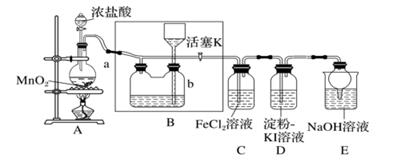 (1)、A 中发生反应的化学方程式为。(2)、储气瓶 b 可以收集氯气,则 B 内盛放的试剂是;装置 E 中球形干燥管的作用是。(3)、在装置 D 中能看到的实验现象是;此现象可推断氧化性:Cl2I2(填“>”或“<”)(4)、装置 C 中 Fe 2+ 被 Cl2氧化为 Fe 3+ ,反应的离子方程式为。
(1)、A 中发生反应的化学方程式为。(2)、储气瓶 b 可以收集氯气,则 B 内盛放的试剂是;装置 E 中球形干燥管的作用是。(3)、在装置 D 中能看到的实验现象是;此现象可推断氧化性:Cl2I2(填“>”或“<”)(4)、装置 C 中 Fe 2+ 被 Cl2氧化为 Fe 3+ ,反应的离子方程式为。四、综合题
-
19. A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为
 , B是同周期第一电离能最小的元素,基态C原子的最外层有三个未成对电子,基态E原子的价电子排布式为3d64s2。
, B是同周期第一电离能最小的元素,基态C原子的最外层有三个未成对电子,基态E原子的价电子排布式为3d64s2。
回答下列问题:
(1)、写出下列元素的名称:A , B , C , D。(2)、D所在周期第一电离能最大的元素是(用元素符号示,下同) ,电负性最大的元素是。(3)、E元素在周期表的第周期第族,已知元素周期表可按电子排布分为s区、p区、d区、ds区和f区,则E元素在区。(4)、用电子式表示B的硫化物的形成过程:。(5)、写出A的最高价氧化物与B的最高价氧化物对应的水化物反应的离子方程式:。20. 从高铝粉煤灰(主要成分为、、、、等)中回收金属、并制备电池正极材料的工艺流程如下图所示:
已知:①与同主族,其化学性质相似。
②随着温度升高,在水溶液中的溶解度减小:
温度/
0
20
40
60
80
100
溶解度/
1.54
1.33
1.17
1.01
0.85
0.72
③本工艺流程中,不同金属离子形成氢氧化物沉淀的范围如表格所示:
金属离子
形成氢氧化物沉淀的范围
3.3~10.6
2.9~9.4
回答下列问题:
(1)、“滤渣1”的成分除了之外还含有。(2)、已知“酸浸”后铁元素以铁配离子()的形式存在,写出在该过程中的离子方程式。(3)、“调”步骤中的范围应为 , “滤液2”中镓元素的存在形式为。(4)、工业上通过电解法利用“物质”制备 , 反应的化学方程式为。(5)、“”中的元素化合价为 , 在“电池级”转化为“”的反应中,氧化剂与还原剂物质的量之比为。21. 回答下列问题。(1)、如图,某温度(t℃)时水的图像如下,a点离子积KW= , 在该温度下,pH=7的溶液显性(填“酸”“碱”或“中”);在该温度下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2= ,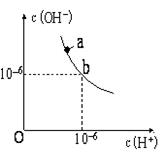 (2)、25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH会。(填“增大”、“减小”或“不变”)(3)、25℃时,等浓度的NH3·H2O溶液和NH4Cl溶液等体积混合,pH>7,则混合溶液中各种离子浓度大小关系为。(4)、+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72−还原成Cr3+ , 反应的离子方程式为。22. 空气与我们的生存息息相关。SO2是主要的大气污染物之一,CO2是主要的温室气体。(1)、SO2属于酸性氧化物,下列物质中可以与其发生反应的是 。A、Na2O B、NaCl C、CO2 D、H2O(2)、双碱法脱硫过程如下图所示。
(2)、25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH会。(填“增大”、“减小”或“不变”)(3)、25℃时,等浓度的NH3·H2O溶液和NH4Cl溶液等体积混合,pH>7,则混合溶液中各种离子浓度大小关系为。(4)、+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72−还原成Cr3+ , 反应的离子方程式为。22. 空气与我们的生存息息相关。SO2是主要的大气污染物之一,CO2是主要的温室气体。(1)、SO2属于酸性氧化物,下列物质中可以与其发生反应的是 。A、Na2O B、NaCl C、CO2 D、H2O(2)、双碱法脱硫过程如下图所示。
①Na2SO3的电离方程式是。
②下列反应中,能用同一离子方程式表示的是(填序号)。
A.Ca(OH)2溶液与稀CH3COOH B.NaOH和稀H2SO4
C.Ca(OH)2溶液与稀HNO3 D.NaOH和稀盐酸
③过程I的离子方程式是 。
④过程Ⅱ中反应的化学方程式是 。
⑤双碱法脱硫过程中,循环利用的物质是(填化学式)
(3)、我国科学家研发了一种室温下“可呼吸”的Na-CO2充电电池。电池的总反应为:3CO2+4Na=2Na2CO3+C。该电池消耗6.6gCO2时,消耗标准状况下CO2的体积是 L,其中含氧原子个(已知阿伏加德罗常数的数值为NA)
五、实验探究题
-
23. 实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
 (1)、A中盛有浓盐酸,B中盛有MnO2 , 写出反应的离子方程式:。(2)、E中为红色干布条,F中为红色湿布条,可观察到的现象是。对比E和F中现象的差异可得出的结论及解释是。(3)、试管C和D中试剂各为。(4)、装置G处发生反应的离子方程式为。(5)、用离子方程式表示试剂X的作用:。(6)、家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
(1)、A中盛有浓盐酸,B中盛有MnO2 , 写出反应的离子方程式:。(2)、E中为红色干布条,F中为红色湿布条,可观察到的现象是。对比E和F中现象的差异可得出的结论及解释是。(3)、试管C和D中试剂各为。(4)、装置G处发生反应的离子方程式为。(5)、用离子方程式表示试剂X的作用:。(6)、家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如下图。注意事项:
1.本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。
2.密封保存,请勿与洁厕灵同时使用。
3.保质期为一年
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:。
24. 长期缺碘和碘摄入过量都会对健康造成危害,目前加碘食盐中碘元素绝大部分以IO3-存在,少量以I-存在。现使用Na2S2O3对某碘盐样品中碘元素的含量进行测定。(1)、Ⅰ.I-的定性检测取少量碘盐样品于试管中,加水溶解,滴加硫酸酸化,再滴加数滴5%NaNO2和淀粉的混合溶液,若溶液变为色,则存在I- , 同时有无色气体产生(该气体遇空气变成红棕色)。试写出该反应的离子方程式为。
(2)、Ⅱ.硫代硫酸钠的制备工业制备硫代硫酸钠的反应原理为 ,某化学兴趣小组用上述原理实验室制备硫代硫酸钠如图:
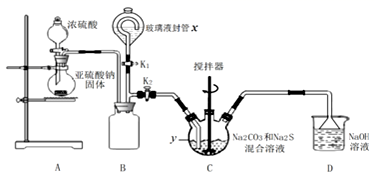
先关闭K3打开K2 , 打开分液漏斗,缓缓滴入浓硫酸,控制好反应速率。
y仪器名称 , 此时B装置的作用是。
(3)、反应开始后,C中先有淡黄色浑浊,后又变为澄清,此浑浊物为(填化学式)。装置D的作用是。(4)、实验结束后,关闭K2打开K1 , 玻璃液封管x中所盛液体最好为。(填序号)A NaOH溶液 B.浓硫酸 C 饱和NaHSO3溶液
(5)、Ⅲ.碘含量的测定已知:①称取10.00g样品,置于250mL锥形瓶中,加水100mL溶解,加2mL磷酸,摇匀。
②滴加饱和溴水至溶液呈现浅黄色,边滴加边摇,至黄色不褪去为止(约1mL)。
③加热煮沸,除去过量的溴,再继续煮沸5min,立即冷却,加入足量15%碘化钾溶液,摇匀。
④加入少量淀粉溶液作指示剂,再用0.0002mol/L的Na2S2O3标准溶液滴定至终点。
⑤重复两次,平均消耗Na2S2O3溶液9.00mL
相关反应为: , ,
请根据上述数据计算该碘盐含碘量为mg·kg-1。