人教(新课标)高中化学一轮复习:专题11水溶液中的离子平衡
试卷更新日期:2022-01-05 类型:一轮复习
一、单选题
-
1. 下列实验装置或操作不能达到相应实验目的的是( )
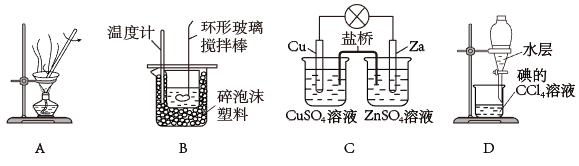 A、图A是蒸干硫酸铁溶液,得到无水硫酸铁 B、图B是中和热的测定 C、图C是验证化学能转化为电能 D、图D是CCl4萃取碘水中的碘的分离操作2. 已知:一元弱酸HA的电离平衡常数K =。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
A、图A是蒸干硫酸铁溶液,得到无水硫酸铁 B、图B是中和热的测定 C、图C是验证化学能转化为电能 D、图D是CCl4萃取碘水中的碘的分离操作2. 已知:一元弱酸HA的电离平衡常数K =。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:化学式
CH3COOH
HCN
H2CO3
K
1.75×10–5
4.9×10–10
K1 = 4.4×10–7
K2 = 5.6×10–11
下列说法正确的是( )
A、稀释CH3COOH溶液的过程中,n(CH3COO–)逐渐减小 B、NaHCO3溶液中:c(H2CO3) < c() < c(HCO3−) C、25℃时,相同物质的量浓度的NaCN溶液的碱性强于CH3COONa溶液 D、向CH3COOH溶液或HCN溶液中加入Na2CO3溶液,均产生CO23. 室温下,用相同浓度的溶液,分别滴定浓度均为的三种酸、和溶液,滴定曲线如图所示。下列判断错误的是 ( )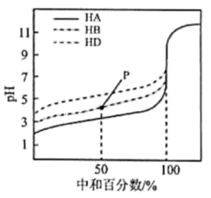 A、三种酸的电离常数关系: B、点时,溶液中: C、时,三种溶液中: D、当中和达时,溶液中:4. 下列叙述正确的是( )A、某溶液的pH=7,则该溶液为中性溶液 B、NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 C、室温下,向水中加入酸或碱,都可抑制水的电离,水的离子积减小 D、室温下,0.01mol/L的NaOH 溶液中由水电离的c(H+)=1.0×10-2mol/L5. 常温下的下列溶液中,各组离子能大量共存的是 ( )A、强酸性溶液中:K+、CH3COO-、Cl-、Na+ B、由水电离出的c(H+)=10-13 mol·L-1的溶液中:NH4+、K+、CO32-、SO C、0.1 mol·L-1 的Na2CO3溶液中:K+、Na+、Al3+、NO D、pH=3的溶液中:K+、Mg2+、Cl-、SO6. 下列叙述正确的是( )A、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) B、25℃时,将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+c(HA‑)+2c(A2-) D、常温下,将等体积pH=2的HCl与pH=12的氨水混合:c(Cl-)=c(NH4+) >c(OH-)=c(H+)7. 下表中物质的分类组合完全正确的是( )
A、三种酸的电离常数关系: B、点时,溶液中: C、时,三种溶液中: D、当中和达时,溶液中:4. 下列叙述正确的是( )A、某溶液的pH=7,则该溶液为中性溶液 B、NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 C、室温下,向水中加入酸或碱,都可抑制水的电离,水的离子积减小 D、室温下,0.01mol/L的NaOH 溶液中由水电离的c(H+)=1.0×10-2mol/L5. 常温下的下列溶液中,各组离子能大量共存的是 ( )A、强酸性溶液中:K+、CH3COO-、Cl-、Na+ B、由水电离出的c(H+)=10-13 mol·L-1的溶液中:NH4+、K+、CO32-、SO C、0.1 mol·L-1 的Na2CO3溶液中:K+、Na+、Al3+、NO D、pH=3的溶液中:K+、Mg2+、Cl-、SO6. 下列叙述正确的是( )A、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) B、25℃时,将5 mL 0.02mol/L的H2SO4与5 mL 0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 C、0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2c(H2A)+c(HA‑)+2c(A2-) D、常温下,将等体积pH=2的HCl与pH=12的氨水混合:c(Cl-)=c(NH4+) >c(OH-)=c(H+)7. 下表中物质的分类组合完全正确的是( )编组
A
B
C
D
强电解质
NaCl
Ba(NO3)2
H2SO4
H2S
弱电解质
HF
CH3COOH
BaSO4
NH3·H2O
非电解质
Cu
NH3
CO2
蔗糖
A、A B、B C、C D、D8. 下列对室温下pH相同、体积相同的醋酸和盐酸两种溶液有关说法正确的是( )A、加水稀释醋酸后,溶液中所有离子浓度均减小 B、温度升高20 ℃后,两溶液pH均不变 C、中和碱的能力:醋酸>盐酸 D、加足量的锌充分反应后,两溶液中产生的氢气体积可用如图表示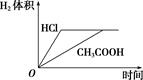 9. NA为阿伏加德罗常数的值,下列说法正确的是( )A、室温下,1 L 0.1mol/LNH4Cl溶液中,NH4+离子数目为0.1NA B、2 L 0.5 mol·L-1醋酸溶液中含有的H+离子数为 NA C、常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA D、某密闭容器盛有0.1 molN2和0.3 mol H2 , 在一定条件下充分反应,转移电子的数目小于0.6 NA10. 一定条件下, 溶液中存在如下平衡: ,下列说法正确的是( )A、升高温度, 增大 B、通入 ,平衡正向移动,溶液 增大 C、加入 固体,平衡正向移动, 减小 D、稀释溶液,平衡正向移动, 增大11. 化学与人类生产、生活密切相关。下列描述中不涉及盐类水解原理的是( )A、明矾净水 B、氯化铵溶液除铁锈 C、用食盐腌制肉制品 D、用草木灰去除油污12. 水的电离过程为 ,在不同温度下其离子积常数不同, , 。则下列关于纯水的叙述正确的是( )A、 随着温度升高而减小 B、在 时, C、 时水的电离程度大于 时水的电离程度 D、水的电离是吸热的13. 下列溶液不呈碱性的是( )A、NH3·H2O B、Na2SiO3 C、MgCl2 D、Ca(OH)214. 下列各式中,属于正确的水解反应方程式是( )A、NH + 2H2O NH3·H2O+ H3O+ B、CO + 2H2O H2CO3 + 2OH- C、CH3COOH + OH- CH3COO- +H2O D、CH3COOH+ H2O CH3COO- +H3O+
9. NA为阿伏加德罗常数的值,下列说法正确的是( )A、室温下,1 L 0.1mol/LNH4Cl溶液中,NH4+离子数目为0.1NA B、2 L 0.5 mol·L-1醋酸溶液中含有的H+离子数为 NA C、常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA D、某密闭容器盛有0.1 molN2和0.3 mol H2 , 在一定条件下充分反应,转移电子的数目小于0.6 NA10. 一定条件下, 溶液中存在如下平衡: ,下列说法正确的是( )A、升高温度, 增大 B、通入 ,平衡正向移动,溶液 增大 C、加入 固体,平衡正向移动, 减小 D、稀释溶液,平衡正向移动, 增大11. 化学与人类生产、生活密切相关。下列描述中不涉及盐类水解原理的是( )A、明矾净水 B、氯化铵溶液除铁锈 C、用食盐腌制肉制品 D、用草木灰去除油污12. 水的电离过程为 ,在不同温度下其离子积常数不同, , 。则下列关于纯水的叙述正确的是( )A、 随着温度升高而减小 B、在 时, C、 时水的电离程度大于 时水的电离程度 D、水的电离是吸热的13. 下列溶液不呈碱性的是( )A、NH3·H2O B、Na2SiO3 C、MgCl2 D、Ca(OH)214. 下列各式中,属于正确的水解反应方程式是( )A、NH + 2H2O NH3·H2O+ H3O+ B、CO + 2H2O H2CO3 + 2OH- C、CH3COOH + OH- CH3COO- +H2O D、CH3COOH+ H2O CH3COO- +H3O+二、多选题
-
15. 常温下,用 盐酸滴定 某弱碱 溶液,所得溶液 、 和 的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述错误的是( )
 A、曲线①代表 ,曲线②代表 B、b点溶液中存在 C、 的电离平衡常数为 D、a、b、c三点的溶液,水的电离程度16. 黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁和铝的硅酸盐,以及 、 等。采用以下工艺流程可由黏土钒矿制备 。
A、曲线①代表 ,曲线②代表 B、b点溶液中存在 C、 的电离平衡常数为 D、a、b、c三点的溶液,水的电离程度16. 黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁和铝的硅酸盐,以及 、 等。采用以下工艺流程可由黏土钒矿制备 。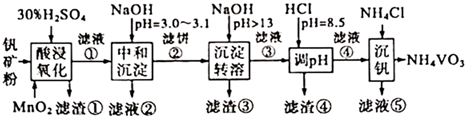
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
开始沉淀pH
1.9
7.0
8.9
3.0
8.1
完全沉淀pH
3.2
9.0
10.9
4.7
10.1
下列说法错误的是( )
A、“酸浸氧化”中,只有 、 两种离子被氧化 B、随滤液②可除去的金属离子只有 、 和 C、“沉淀转溶”得到滤渣③的主要成分是 D、“调 ”的目的是为了除去铝元素17. 已知:常温下, 。某温度下,饱和溶液中 与 、 的关系如图所示。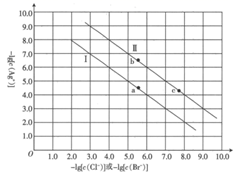
下列说法正确的是( )
A、曲线Ⅱ代表 的沉淀溶解平衡曲线 B、常温下, 的 C、常温下,当 时,饱和溶液中 D、加入 固体可使溶液由 点沿直线变为 点18. 常温下,0.010mol·L-1的二元酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH变化如图所示:下列说法正确的是( ) A、NaHA溶液显酸性 B、H2A的第一步电离平衡常数Ka1=10-10 C、Na2A溶液中离子浓度大小关系为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>>c(H+) D、向H2A溶液中滴加相同浓度的NaOH溶液,滴加过程中离子浓度始终满足:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)19. 室温下,向20.00mL0.1mol·L-1HX溶液中逐滴加0.1mol·L-1NaOH溶液。已知 ,溶液pH随 变化关系如图所示。下列说法错误的是( )
A、NaHA溶液显酸性 B、H2A的第一步电离平衡常数Ka1=10-10 C、Na2A溶液中离子浓度大小关系为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>>c(H+) D、向H2A溶液中滴加相同浓度的NaOH溶液,滴加过程中离子浓度始终满足:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)19. 室温下,向20.00mL0.1mol·L-1HX溶液中逐滴加0.1mol·L-1NaOH溶液。已知 ,溶液pH随 变化关系如图所示。下列说法错误的是( )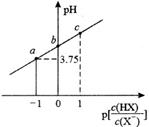 A、当 =1时,溶液pH=5.75 B、当 =0时,加入NaOH溶液的体积大于10.00mL C、当加入10.00mLNaOH溶液时:c(H+)+c(HX)=c(Na+)+c(OH-) D、如图所示各点对应溶液中水电离出来的H+浓度:a>b>c
A、当 =1时,溶液pH=5.75 B、当 =0时,加入NaOH溶液的体积大于10.00mL C、当加入10.00mLNaOH溶液时:c(H+)+c(HX)=c(Na+)+c(OH-) D、如图所示各点对应溶液中水电离出来的H+浓度:a>b>c三、填空题
-
20.(1)、现有以下物质:① 晶体 ② ③液态醋酸 ④铜 ⑤固体 ⑥纯蔗糖 ⑦酒精 ⑧熔融的 ⑨氨水 ⑩液氮.
请回答下列问题.(填相应序号)
上述物质能导电的是;属于非电解质的是;属于强电解质的是;写出⑧的电离方程式: .
(2)、一定条件下,冰醋酸加水稀释过程中溶液的导电能力如图所示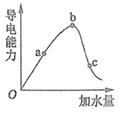
①a、b、c三点对应的溶液中,醋酸电离程度最大的是; 最小的是 .
②在稀释过程中随着醋酸浓度的降低,下列始终保持增大趋势的量是
A. B. C. 分子数 D.
(3)、已知 时, 的电离平衡常数 的电离平衡常数 ,试写出下列情况下发生的离子反应方程式:①向 溶液中通入少量 :
②向 溶液中滴入少量新制氯水:
21. (I)CuCl2溶液显性,理由是(用离子方程式表示)(II)BaSO4浊液中存在平衡,其表达式为:
(III)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=﹣1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566.0kJ/mol,
③H2O(g)═H2O(l)△H3=﹣44.0kJ/mol
上述三个反应中,△S<0的是 . 甲醇燃烧生成一氧化碳和液态水的热化学方程式是
(IV)已知碳酸H2CO3:Ka1=4.3×10-7 , Ka2=5.6×10-11
草酸H2C2O4:Ka1=5.9×10-2 , Ka2=6.4×10-5 , 0.1 mol/L Na2CO3溶液的pH0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”),等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是。(选填编号)
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
四、综合题
-
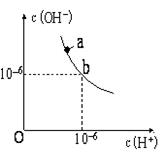
22. 回答下列问题。(1)、如图,某温度(t℃)时水的图像如下,a点离子积KW= , 在该温度下,pH=7的溶液显性(填“酸”“碱”或“中”);在该温度下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2= ,
 (2)、25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH会。(填“增大”、“减小”或“不变”)(3)、25℃时,等浓度的NH3·H2O溶液和NH4Cl溶液等体积混合,pH>7,则混合溶液中各种离子浓度大小关系为。(4)、+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72−还原成Cr3+ , 反应的离子方程式为。23. 实验室以活性炭为催化剂,用 CoCl2•6H2O 制取三氯化六氨合钴(Ⅲ)总反应2CoCl2+10NH3+2NH4Cl+H2O2 2[Co(NH3)6]Cl3+2H2O.制备流程如图:回答下列问题:
(2)、25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH会。(填“增大”、“减小”或“不变”)(3)、25℃时,等浓度的NH3·H2O溶液和NH4Cl溶液等体积混合,pH>7,则混合溶液中各种离子浓度大小关系为。(4)、+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72−还原成Cr3+ , 反应的离子方程式为。23. 实验室以活性炭为催化剂,用 CoCl2•6H2O 制取三氯化六氨合钴(Ⅲ)总反应2CoCl2+10NH3+2NH4Cl+H2O2 2[Co(NH3)6]Cl3+2H2O.制备流程如图:回答下列问题: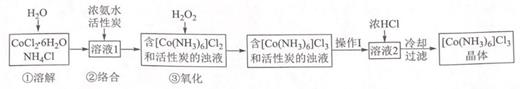 (1)、步骤①“溶解”需加热并使用研细的 CoCl2•6H2O,目的是(2)、步骤②“络合”需降温至 10℃进行,原因是(3)、步骤③“氧化”在 60℃进行。“操作Ⅰ”是已知:[Co(NH3)6]Cl3 在冷水中溶解度较小,在热水中溶解度较大。(4)、[Co(NH3)6]Cl3溶液中不存在的微粒间的作用力是A、离子键 B、共价键 C、金属键 D、配位键 E、分子间作用力 F、氢键(5)、用图装置测定产品中 NH3 的含量(已省略加热和夹持装置):
(1)、步骤①“溶解”需加热并使用研细的 CoCl2•6H2O,目的是(2)、步骤②“络合”需降温至 10℃进行,原因是(3)、步骤③“氧化”在 60℃进行。“操作Ⅰ”是已知:[Co(NH3)6]Cl3 在冷水中溶解度较小,在热水中溶解度较大。(4)、[Co(NH3)6]Cl3溶液中不存在的微粒间的作用力是A、离子键 B、共价键 C、金属键 D、配位键 E、分子间作用力 F、氢键(5)、用图装置测定产品中 NH3 的含量(已省略加热和夹持装置):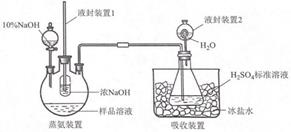
①蒸氨:取 m g 样品进行测定。添加药品后,加热三颈烧瓶,蒸出的 NH3 通入含有V1mLc1 mol•L﹣1H2SO4 标准溶液的锥形瓶中。
液封装置1的作用是
②滴定:将液封装置2中的水倒入锥形瓶后,滴定过剩的H2SO4 , 消耗V2mLC2mol•L﹣1的 NaOH 的标准液产品中 NH3 的质量分数为若未将液封装置 2 中的水倒入锥形瓶,测得 NH3 的质量分数可能(填“偏高”或“偏低”)。
24. CO2是导致温室效应的主要物质。CO2加氢合成甲醇不仅解决了CO2的排放问题,还提供了化工基础原料。回答下列问题:(1)、已知CO2加氢合成甲醇涉及的反应有:反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-49.2kJ/mol
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=+41.2kJ/mol
则反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) △H3=kJ/mol
(2)、在恒容密闭容器中发生反应CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。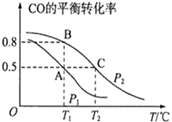
①A、B、C三点的平衡常数KA , KB , KC的大小关系是。
②下列叙述能说明上述反应能达到化学平衡状态的是(填代号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不变
d.H2(g)与CH3OH(g) 的物质的量之比保持不变
③在容积为2L的密闭容器内充入0.3molCO与0.6molH2在催化剂作用下发生反应生成甲醇。A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”“小于”或“等于");若P2压强恒定为p,则T2℃平衡常数Kp=(Kp用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,整理出含p的最简表达式)。
(3)、我国规定生活用水中铅排放的最大允许浓度为0.01mg/L。在某含铅废水中加入Na2S,当S2-浓度达到6.8×10-8mol/L时,水体中Pb2+浓度为mol/L[已知:Ksp(PbS)=3.4×10-28],此时是否符合排放标准?(填“是”或“否”)。五、实验探究题
-
25. CuCl2是常见的化学试剂,某学习小组利用废铜屑“湿法”制备CuCl2·2H2O。
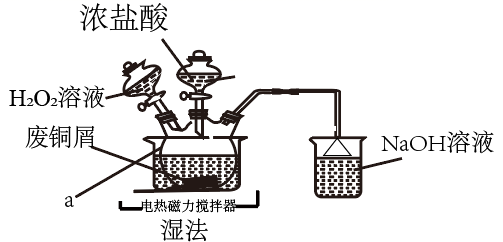
氯化铜在不同温度下结晶形成的结晶水合物
温度
以下
以上
结晶水合物
回答下列问题:
(1)、仪器的名称为 , 溶液的作用是。(2)、“湿法”制备的离子方程式为 , 实验中,的实际用量要大于理论用量,原因是。(3)、为得到纯净的晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入气体,加热蒸发浓缩, , 过滤,洗涤,低温干燥。其中,持续通入的作用是。(4)、用“间接碘量法”测定废铜屑的利用率。取所得试样溶于水配成 , 取出 , 向其中加入过量固体,充分反应,生成白色沉淀,滴入几滴淀粉溶液作指示剂,用标准溶液滴定,到达滴定终点时,消耗标准溶液。(涉及到的反应为: , )①滴定终点的判断:当滴入最后一滴标准液,溶液恰好(填颜色变化),且半分钟不再发生变化。
②废铜屑中铜的百分含量为。
(5)、查阅资料: , 等量黄色与蓝色混合呈绿色。设计实验证明溶液中存在上述平衡;取少量蓝色稀溶液于试管中,。26. 食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL。用标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如图所示,回答下列问题: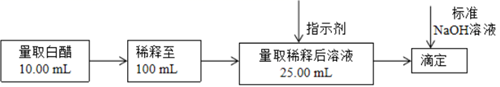 (1)、某同学用酸碱中和滴定法测定市售食用白醋醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中 ,则此时溶液中的pH=。(已知室温下醋酸的 )(2)、根据该同学的计算结果,应该选作指示剂(填“酚酞”、“甲基橙”或“石蕊”)(3)、该滴定达到终点时的现象是。(4)、某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为mL。
(1)、某同学用酸碱中和滴定法测定市售食用白醋醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中 ,则此时溶液中的pH=。(已知室温下醋酸的 )(2)、根据该同学的计算结果,应该选作指示剂(填“酚酞”、“甲基橙”或“石蕊”)(3)、该滴定达到终点时的现象是。(4)、某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为mL。 (5)、用标准的0.06000mol/LNaOH溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:
(5)、用标准的0.06000mol/LNaOH溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:滴定次数
待测溶液的体积/mL
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00mL
0.02
25.01
2
25.00mL
0.70
25.71
3
25.00mL
0.50
24.2
则该白醋(填“符合”或“不符合”)国家标准。
(6)、下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是___________(填编号)。A、碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液 B、滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥 C、滴定过程中振摇时有液滴溅出 D、读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数 E、碱式滴定管在滴定前有气泡,滴定后气泡消失