人教(新课标)高中化学一轮复习:专题10化学反应速率与化学平衡
试卷更新日期:2022-01-05 类型:一轮复习
一、单选题
-
1. 常温下,向某容积为1L的恒容密闭容器中通入和 , 发生应:。反应后,测得容器中剩余0.06mol,则下列反应速率的表达正确的是( )A、 B、 C、 D、2. 下列叙述与图对应的是( )



 A、对于达到平衡状态的反应:N2(g)+3H2(g)⇌2NH3(g),图①表示在t0时刻充入了一定量的NH3 , 平衡逆向移动 B、由图②可知,P2>P1、T1>T2满足反应:2A(g)+B(g)⇌2C(g) ΔH<0 C、图③表示的反应方程式为:2A=B+3C D、对于反应2X(g)+3Y(g)⇌3Z(g) ΔH<0,图④y轴可以表示Y的百分含量3. 下列对化学反应预测正确的是( )
A、对于达到平衡状态的反应:N2(g)+3H2(g)⇌2NH3(g),图①表示在t0时刻充入了一定量的NH3 , 平衡逆向移动 B、由图②可知,P2>P1、T1>T2满足反应:2A(g)+B(g)⇌2C(g) ΔH<0 C、图③表示的反应方程式为:2A=B+3C D、对于反应2X(g)+3Y(g)⇌3Z(g) ΔH<0,图④y轴可以表示Y的百分含量3. 下列对化学反应预测正确的是( )选项
化学反应方程式
已知条件
预测
A
M(s)=X(g)+Y(s)
ΔH>0
它是非自发反应
B
W(s)+xG(g)=2Q(g)
ΔH<0,自发反应
x可能等于1、2、3
C
4X(g+5Y(g)=4W(g)+6G(g)
能自发反应
ΔH一定小于0
D
4M(s)+N(g)+2W(l)=4Q(s)
常温下,自发进行
ΔH>0
A、A B、B C、C D、D4. 已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),该反应是一个可逆反应,正反应是放热反应。若反应物的起始物质的量相同,下列关于该反应的示意图不正确的是( )A、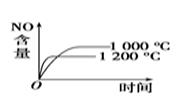 B、
B、 C、
C、 D、
D、 5. 图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ所示。下列有关说法正确的是( )
5. 图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ所示。下列有关说法正确的是( ) A、该反应的焓变ΔH=+234 kJ·mol-1 B、若X表示温度,则Y表示的可能是CO2的物质的量浓度 C、若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 D、若X表示反应时间,则Y表示的可能是混合气体的密度6. 某温度下某气体反应达到化学平衡,平衡常数 ,恒容时,若温度适当降低,F的浓度增加。下列说法中正确的是( )A、增大c(A)、c(B),K增大 B、降低温度,正反应速率增大 C、该反应的焓变为负值 D、该反应的化学方程式为2E(g)+F(g) A(g)+2B(g)7. 常压下羰基化法精炼镍的原理为Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
A、该反应的焓变ΔH=+234 kJ·mol-1 B、若X表示温度,则Y表示的可能是CO2的物质的量浓度 C、若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 D、若X表示反应时间,则Y表示的可能是混合气体的密度6. 某温度下某气体反应达到化学平衡,平衡常数 ,恒容时,若温度适当降低,F的浓度增加。下列说法中正确的是( )A、增大c(A)、c(B),K增大 B、降低温度,正反应速率增大 C、该反应的焓变为负值 D、该反应的化学方程式为2E(g)+F(g) A(g)+2B(g)7. 常压下羰基化法精炼镍的原理为Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
A、增加c(CO),平衡向正向移动,反应的平衡常数增大 B、第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选50 ℃ C、第二阶段,Ni(CO)4分解率较低 D、该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)8. 某温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法错误的是( )物质
X
Y
Z
W
初始浓度/mol·L-1
0.5
0.6
0
0
平衡浓度/mol·L-1
0.1
0.1
0.4
0.6
A、反应达到平衡时,X的转化率为80% B、该反应的平衡常数表达式为 C、增大压强其平衡常数不变,但使平衡向生成Z的方向移动 D、改变温度可以改变该反应的平衡常数9. 一定条件下,对于可逆反应 , 若X、Y、Z的起始浓度分别为、、(均不为零),达到平衡时,X、Y、Z的浓度分别为、、 , 则下列判断正确的是( )A、 B、X的浓度为时,Z的浓度为 C、X、Y的转化率不相等 D、的取值范围为10. 在一恒温、恒容的密闭容器中发生反应A(s)+2B(g) C(g)+D(g),当下列物理量不再变化时,下列事实能表明该反应达到平衡的是( )A、混合气体的压强 B、C,D的消耗速率之比为1:1 C、容器内气体密度不变 D、单位时间内生成2molB 的同时消耗1 molC二、多选题
-
11. 向1L密闭容器中充入足量的焦炭和1molSO2(g)发生反应: 。测得SO2的生成速率与S2(g)的生成速率随温度变化如图所示。下列说法正确的是( )
 A、正反应的活化能小于逆反应的活化能 B、达到平衡后再加热,平衡向正反应方向移动 C、A,B,C,D四点对应状态下,达到平衡状态的是B、D D、达到平衡后缩小容器容积,重新达到平衡后,SO2的平衡转化率增大12. 一定条件下,等物质的量的 和 在一恒容密闭容器中发生反应: 。如图所示,曲线a表示该反应在 时X的物质的量浓度随时间的变化,曲线b表示该反应在某一反应条件改变时X的物质的量浓度随时间的变化。下列说法错误的是( )
A、正反应的活化能小于逆反应的活化能 B、达到平衡后再加热,平衡向正反应方向移动 C、A,B,C,D四点对应状态下,达到平衡状态的是B、D D、达到平衡后缩小容器容积,重新达到平衡后,SO2的平衡转化率增大12. 一定条件下,等物质的量的 和 在一恒容密闭容器中发生反应: 。如图所示,曲线a表示该反应在 时X的物质的量浓度随时间的变化,曲线b表示该反应在某一反应条件改变时X的物质的量浓度随时间的变化。下列说法错误的是( ) A、 时,x的平衡转化率为 B、 时,随着反应的进行,混合气体的平均相对分子质量逐渐增大 C、若曲线a和b发生反应时除温度外,其他条件均相同,则反应达到平衡后,该反应的平衡常数 D、若曲线b对应的是改变反应温度,则可判断该反应中反应物的键能总和小于生成物的键能总和13. 已知反应 。当反应器中按 投料后,在不同温度下,反应达到平衡时,得到混合物中 的物质的量分数随压强的变化曲线 、 、 如图所示。下列说法正确的是( )
A、 时,x的平衡转化率为 B、 时,随着反应的进行,混合气体的平均相对分子质量逐渐增大 C、若曲线a和b发生反应时除温度外,其他条件均相同,则反应达到平衡后,该反应的平衡常数 D、若曲线b对应的是改变反应温度,则可判断该反应中反应物的键能总和小于生成物的键能总和13. 已知反应 。当反应器中按 投料后,在不同温度下,反应达到平衡时,得到混合物中 的物质的量分数随压强的变化曲线 、 、 如图所示。下列说法正确的是( )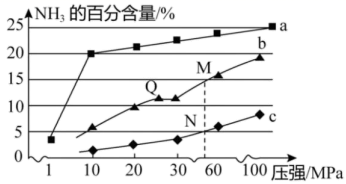 A、若反应器中充入 和 ,则反应达平衡时将释放9.22 kJ热量 B、从M到Q,平衡向左移动 C、图中M,N,Q点平衡常数K的大小关系为 D、M,N,Q达到平衡所需时间关系为14. 苯与Br2的催化反应历程如图所示。下列说法正确的是( )
A、若反应器中充入 和 ,则反应达平衡时将释放9.22 kJ热量 B、从M到Q,平衡向左移动 C、图中M,N,Q点平衡常数K的大小关系为 D、M,N,Q达到平衡所需时间关系为14. 苯与Br2的催化反应历程如图所示。下列说法正确的是( ) A、
A、 是总反应的催化剂
B、
是总反应的催化剂
B、 转化为
转化为 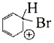 是总反应的决速步骤
C、苯与Br2的催化反应是放热反应
D、反应生成的有机产物中,取代产物所占比例更大
15. 在一恒容密闭容器中发生反应: 。起始时, , , 。在一定条件下,当反应达到平衡时,下列各物质的浓度关系可能正确的是( )A、 B、 C、 D、
是总反应的决速步骤
C、苯与Br2的催化反应是放热反应
D、反应生成的有机产物中,取代产物所占比例更大
15. 在一恒容密闭容器中发生反应: 。起始时, , , 。在一定条件下,当反应达到平衡时,下列各物质的浓度关系可能正确的是( )A、 B、 C、 D、三、填空题
-
16. 硫酰氯 和亚硫酰氯 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂.
已知:Ⅰ.
II.
(1)、若在绝热、恒容的密闭容器中充入一定量的 和 ,发生反应: ,下列示意图能说明 时刻反应达到平衡状态的是(填序号).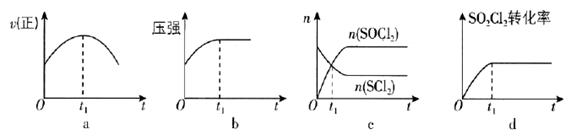 (2)、为研究不同条件对反应Ⅰ的影响.恒温条件下,向 恒容密闭容器中加入 ,经 反应Ⅰ达到平衡.测得 内 ,则平衡时 的转化率 . 保持其他条件不变,反应Ⅰ在恒压条件下进行,达到平衡时 的转化率为 ,则 (填“>”“<”“=”)17. 在 2020 年中央经济工作会议上,我国明确提出“碳达峰”与“碳中和”目标,因此利用煤炭或CO 2 合成其它高价值化学品的工业生产显得更加重要。(1)、工业上以煤和水为原料通过一系列转化可获得清洁能源氢气。
(2)、为研究不同条件对反应Ⅰ的影响.恒温条件下,向 恒容密闭容器中加入 ,经 反应Ⅰ达到平衡.测得 内 ,则平衡时 的转化率 . 保持其他条件不变,反应Ⅰ在恒压条件下进行,达到平衡时 的转化率为 ,则 (填“>”“<”“=”)17. 在 2020 年中央经济工作会议上,我国明确提出“碳达峰”与“碳中和”目标,因此利用煤炭或CO 2 合成其它高价值化学品的工业生产显得更加重要。(1)、工业上以煤和水为原料通过一系列转化可获得清洁能源氢气。已知:① C(s) + O2(g) = CO 2 (g) △H 1 = -393.5kJ·mol −1
② ΔH2=-571kJ mol−1
③H2O(l) = H2O(g) △H1 = +44kJ·mol−1
则碳与水蒸气反应 C(s) +2H2O(g) CO2(g)+2H2(g)的 ΔH = 。
(2)、工业上也可以仅利用上述反应得到的 CO2 和H2 进一步合成甲醇:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H<0
①在某 1L 恒温恒容密闭容器中充入 1mol CO2和 3molH2发生反应,测得 CO2(g)和 CH3OH (g)浓度随时间变化如下图 1 所示。则平衡时H2 (g)的转化率为 , 该温度下的平衡常数表达式为 K=。

②该反应在催化剂 Cu—ZnO—ZrO 2 表面进行,主反应历程如图 2 所示(催化剂表面吸附的物种用*标注),下列说法不正确的是。
A.该反应的原子利用率为 100%
B.催化剂可以降低反应活化能
C.反应②中,断裂和形成的共价键至少有 2种
D.使用催化剂可以提高反应的转化率
(3)、将合成的甲醇进行水蒸气重整是电动汽车氢氧燃料电池理想的氢源。该制氢(SRM)系统简单,产物中2H 含量高、CO 含量低(CO会损坏燃料电池的交换膜),反应如下:反应Ⅰ(主):CH3OH(g) + H2O(g) CO2(g) +3H2(g) △H 1 >0
反应Ⅱ(副):CO2(g) + H 2 (g) CO(g) + H2O(g) △H 2 >0
温度高于 300℃会同时发生反应Ⅲ:CH3OH(g) CO(g) + 2H 2 (g)
①反应 1能够自发进行的条件是。
②升温有利于提高 CH 3 OH 转化率,但也存在一个明显的缺点是。
③写出一条能提高 CH3OH 转化率而降低 CO生成率的措施。
四、综合题
-
18.(1)、I.乙烯是来自石油的重要的化工原料,乙烯的产量通常用来衡量一个国家的石油化工发展水平。

完成下列填空:C4H10和乙烷互为。(2)、反应①、②、③的反应类型分别为、、。(3)、反应④和反应⑥的反应方程式分别为、。(4)、II.反应为工业上合成硫酸的非常重要的一步。已知该反应在反应过程中体系温度会升高,下列有关说法正确的是____。
A、该反应为吸热反应 B、该催化剂对任何反应均能加快反应速率 C、该反应中,不可能100%转化为 D、保持其他条件不变,升高温度可以增大生成的速率(5)、一定温度下,向体积为的刚性密闭容器中充入和 , 发生反应:。反应过程中容器内某物质的物质的量浓度随时间变化关系如图所示:
①图中曲线表示的是(填“”“”或“”)的物质的量浓度随时间的变化,时的转化率为。
②内,用表示该反应的速率为。
19. 主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为 , 含少量、及铝、镁、钙等金属元素的氧化物)制取的工艺流程如图所示。
部分阳离子以氢氧化物形式沉淀时溶液
沉淀物
完全沉淀的
3.7
9.6
9.2
5.2
回答下列问题:
(1)、“溶浸”过程中,可以加快反应速率和提高原料利用率的方法是(写出一种即可),加入的作用是。(2)、“氧化”过程中金属离子与反应的离子方程式为 , 由此推测还原性:Fe2+Co2+(填“”或“”)。(3)、滤渣2的主要成分为(写化学式),检验铁元素的离子已被完全沉淀的实验操作及现象;取少量待测液于试管中,。(4)、已知某温度下 , 。该温度下,“沉淀除杂”时加入足量的溶液可将、沉淀除去,若所得滤液中 , 则滤液中为(保留2位有效数字)。(5)、在空气中充分煅烧,除得到产品外还产生了 , 则反应中与的化学计量数之比为。20. 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。以、为原料合成涉及的主要反应如下:Ⅰ.
Ⅱ.
回答下列问题:
(1)、已知 , 请计算。(2)、在恒温恒容的容器中发生上述反应,下列说法正确的有____。A、气体平均摩尔质量保持不变,反应体系已达平衡 B、加入催化剂,可提高的平衡转化率 C、平衡后缩小体积增大体系压强,有利于提高产率 D、平衡后升高温度,反应Ⅱ的正反应速率增大、逆反应速率减小,平衡正移(3)、研究表明:其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性。使用该催化剂,将和在密闭容器中进行反应,的平衡转化率和甲醇的选择率(甲醇的选择率:转化的中生成甲醇的物质的量分数)随温度的变化趋势如图所示:
①温度为 , 经体系达到平衡,则的平均反应速率为 , 该温度下反应Ⅰ的平衡常数。
②随着温度的升高,的平衡转化率增加但甲醇的选择率降低,分析其原因。
(4)、研究表明,在电解质水溶液中,可以被电化学还原。两种不同催化剂、上电还原为的反应进程中(溶液中被还原为的反应也同时发生)相对能量变化如图。由此判断,电解质溶液中主要发生还原为反应的是(填或),理由是。 21.(1)、I.将CO2转化成甲醇燃料是减排、环保的一种科学方法。
21.(1)、I.将CO2转化成甲醇燃料是减排、环保的一种科学方法。已知:2H2(g)+O2(g) =2H2O(g);△H=-483.6kJ·mol-1 ①
2CO2(g)+4H2O(g) = 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
则用CO2与H2反应制备 CH3OH(g),同时生成水蒸气的热化学方程式为:
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH=。
(2)、II.在容积为2L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
800℃时,0—5min内,以B表示的平均反应速率为。
(3)、能判断该反应达到化学平衡状态的依据是。a.容器中压强不变 b.混合气体中c(A)不变
c.2v正(B)=v逆(D) d.c(A)=c(C)
(4)、若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= , 该反应为反应(填吸热或放热),判断理由是。(5)、800℃时,某时刻测得体系中各物质的量如下:n(A)=0.9mol,n(B)=2.0mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。22. 氧和氮是大气的主要成分,氮的化合物在工业上均有重要的应用。(1)、根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:。H2SO4(aq)=SO2(g)+H2O(l)+O2(g)ΔH1=+327 kJ·mol-1
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq)ΔH2=-151 kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110 kJ·mol-1
(2)、在恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),下列说法可以证明反应已达到平衡状态的是(填序号)。①单位时间内生成n mol N2的同时生成2n mol NH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是(填字母)。
A.及时移出氨B.适当增大压强C.循环利用和不断补充氮气
D.减小压强E.降低温度
(3)、电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600 K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是。
 (4)、肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2 L的恒容密闭容器中充入2 mol N2H4 , 发生反应N2H4(g) N2(g)+2H2(g),(用x表示)与时间的关系如图所示,则该温度下,此反应的平衡常数K=。
(4)、肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2 L的恒容密闭容器中充入2 mol N2H4 , 发生反应N2H4(g) N2(g)+2H2(g),(用x表示)与时间的关系如图所示,则该温度下,此反应的平衡常数K=。
五、实验探究题
-
23. 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
温度
250 ℃
300 ℃
350 ℃
KⅠ
2.0
0.27
0.012
(1)、在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1 , 计算可得此段时间的反应速率(用H2表示)为mol·L-1·min-1。(2)、由表中数据判断ΔH1(填“>”“<”或“=”)0;反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=(用ΔH1和ΔH2表示)。(3)、若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是(填字母)。a.充入CO,使体系总压强增大b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大d.使用高效催化剂
(4)、写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡(填“正向”“逆向”或“不”)移动,平衡常数KⅡ(填“变大”“变小”或“不变”)。(5)、比较这两种合成甲醇的方法,原子利用率较高的是反应(填“Ⅰ”或“Ⅱ”)。24. 某小组研究化学平衡的移动(1)、已知反应:Fe3++3SCN- Fe(SCN)3
①i中现象为。
②ii中血红色褪去,结合离子反应和平衡移动解释原因。
③已知存在反应:2Fe3++SO +H2O=2Fe2++SO +2H+ , 则证明iii中平衡逆向移动的准确实验现象描述是。
(2)、已知反应:[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O ΔH>0取适量CuCl2固体进行下面实验
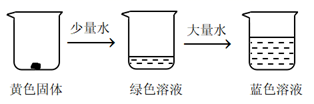
判断正误(括号里填“√”或“×”):
①加少量水,溶液为绿色的原因是:溶液中同时存在较多的[Cu(H2O)4]2+和[CuCl4]2- , 黄色和蓝色的混合色为绿色。。
②加大量水,溶液变为蓝色的原因是:提高了c(H2O),平衡逆向移动,黄色的[CuCl4]2-转化为蓝色的[Cu(H2O)4]2+ , 所以溶液变为蓝色。。
③对绿色溶液进行加热,溶液变为黄绿色,因为反应吸热,升温平衡正向移动。。