山东省威海市乳山市(五四制)2021-2022学年九年级上学期期中化学试题
试卷更新日期:2021-12-31 类型:期中考试
一、单选题
-
1. 溶液是一种重要的混合物。下列有关溶液的说法正确的是( )A、溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动 B、饱和溶液是一定温度下不能再溶解该物质的溶液 C、不饱和溶液通过降低温度一定能变成饱和溶液 D、一种物质分散到另一种物质里一定能形成溶液2. 小丽捡到一枚白色鹅卵石,这会不会是大理石呢?将其放在食醋中,有气泡产生.小丽认为鹅卵石中可能含有碳酸盐.在此过程中,没有应用的科学方法是( )A、猜想 B、实验 C、推理 D、归纳3. 如图是采用膜分离技术的海水淡化装置,对海水加压后,只有水分子可以通过淡化膜,离子等其他粒子不能通过淡化膜.加压后,装置右侧海水中增加的是( )
 A、溶质质量分数 B、溶剂质量 C、溶液质量 D、溶质质量4. 如图所示装置气密性良好、要使注射器中的活塞向右移动,使用的液体M和固体N可能是( )
A、溶质质量分数 B、溶剂质量 C、溶液质量 D、溶质质量4. 如图所示装置气密性良好、要使注射器中的活塞向右移动,使用的液体M和固体N可能是( )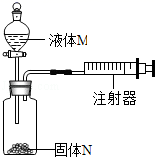
①稀盐酸和石灰石;②稀硫酸和锌;③水和氢氧化钠;④水和硝酸铵.
A、①②③④ B、①②③ C、①②④ D、②③④5. 下列关于溶液的说法错误的是( )A、与乳化作用相比,溶解能使物质混合得更均匀 B、20℃时,50g水中溶解了15g的硝酸钾,则20℃时硝酸钾的溶解度是30g C、一定温度下,固体物质的溶解度不随水的质量改变而改变 D、硝酸钾的饱和溶液恒温蒸发部分水后,剩余溶液溶质质量分数不变6. 下列各组离子能在指定溶液中大量共存的一组是( )A、在稀盐酸中:Ba2+、 、Zn2+ B、在氢氧化钠溶液中:H+、Mg2+、Cl- C、在硫酸铵溶液中:Na+、Ba2+、OH- D、在氯化钠溶液中:K+、Ca2+、7. 如图是甲、乙两物质的溶解度曲线图,下列说法错误的是( ) A、在t2℃时,甲的饱和溶液升温或降温都可变成不饱和溶液 B、将t2℃时甲的饱和溶液降温到t1℃时,有晶体析出 C、将t2C时甲、乙两物质的饱和溶液升温到t3℃,两溶液的溶质质量分数都减小 D、t1℃时甲乙两物质的饱和溶液的溶质质量分数相等8. 下列有关说法错误的是( )A、要证明氢氧化钠溶液是否变质不能用酚酞试液 B、要证明氢氧化钠与二氧化碳能否发生反应,可以向生成物中加入少量的稀盐酸 C、要证明氢氧化钠和盐酸能否发生反应,可以借助酸碱指示剂 D、要区分海水和蒸馏水可以用氯化钡溶液9. 在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是( )
A、在t2℃时,甲的饱和溶液升温或降温都可变成不饱和溶液 B、将t2℃时甲的饱和溶液降温到t1℃时,有晶体析出 C、将t2C时甲、乙两物质的饱和溶液升温到t3℃,两溶液的溶质质量分数都减小 D、t1℃时甲乙两物质的饱和溶液的溶质质量分数相等8. 下列有关说法错误的是( )A、要证明氢氧化钠溶液是否变质不能用酚酞试液 B、要证明氢氧化钠与二氧化碳能否发生反应,可以向生成物中加入少量的稀盐酸 C、要证明氢氧化钠和盐酸能否发生反应,可以借助酸碱指示剂 D、要区分海水和蒸馏水可以用氯化钡溶液9. 在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是( )①用量筒量取水时俯视读数 ②配制溶液的烧杯用少量蒸馏水润洗 ③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数 ④盛装溶液的试剂瓶用蒸馏水润洗 ⑤氯化钠晶体不纯
A、①②③④⑤ B、只有①②④⑤ C、只有①②③ D、只有②③④⑤10. 下列实验操作正确的是( )A、稀释浓硫酸时将浓硫酸沿着器壁慢慢注入盛水的量筒中,并用玻璃棒不断的搅拌 B、测定某溶液pH时应用玻璃棒蘸取待测液滴在湿润的pH试纸上,再与标准比色卡对照 C、配制100g质量分数5%的氯化钠溶液应先计算,再称量,最后溶解 D、碱溶液不小心流到实验台上应先用硼酸清洗再用大量的水冲洗11. 下列图象能正确反映对应变化关系的是( )A、 将表面生锈的铁钉放入稀盐酸中
B、
将表面生锈的铁钉放入稀盐酸中
B、 向盛有少量硫酸溶液的烧杯中滴加一定质量的水
C、
向盛有少量硫酸溶液的烧杯中滴加一定质量的水
C、 在恒温条件下,将饱和的KNO3溶液蒸发适量水
D、
在恒温条件下,将饱和的KNO3溶液蒸发适量水
D、 向饱和石灰水中加入少量生石灰
12. 逻辑推理是化学学习中常用的思维方法,下面推理中正确的是( )A、酸中都有氢元素,所以含有氢元素的化合物一定是酸 B、酸性溶液能使石蕊试液变红色,所以能使石蕊试液变红的溶液一定是酸性溶液 C、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 D、中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应13. 配制一定溶质质量分数的氯化钠溶液的一些操作步骤见图,正确的操作顺序是( )
向饱和石灰水中加入少量生石灰
12. 逻辑推理是化学学习中常用的思维方法,下面推理中正确的是( )A、酸中都有氢元素,所以含有氢元素的化合物一定是酸 B、酸性溶液能使石蕊试液变红色,所以能使石蕊试液变红的溶液一定是酸性溶液 C、溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 D、中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应13. 配制一定溶质质量分数的氯化钠溶液的一些操作步骤见图,正确的操作顺序是( ) A、④⑤①②③ B、①②③④⑤ C、③④①②⑤ D、②①④③⑤14. 除去下列物质中含有的少量杂质,所用试剂及用量均正确的是( )
A、④⑤①②③ B、①②③④⑤ C、③④①②⑤ D、②①④③⑤14. 除去下列物质中含有的少量杂质,所用试剂及用量均正确的是( )选项
物质
所含杂质
所选试剂及用量
A
盐酸
硫酸
适量的硝酸钡溶液
B
氯化钙溶液
盐酸
过量的碳酸钙
C
氧化钙
碳酸钙
适量的盐酸
D
氯化钾溶液
盐酸
过量的碳酸钾溶液
A、A B、B C、C D、D15. 2019年2月12日陕西省渭南市渭南市华州区少华山国家森林公园附近的一个硫酸厂发生爆炸,造成一定量的硫酸泄漏,为了防止污染的进一步扩散以及人员伤亡,下列措施适宜的是( )A、用土将硫酸掩埋 B、在泄漏的硫酸上撒氯化钡 C、用水冲洗泄露的硫酸 D、将熟石灰洒在泄漏出的硫酸上二、填空题
-
16. 如图为甲、乙、丙三种物质的溶解度曲线回答问题:
 (1)、P点的意义是。(2)、t2℃时,向30g甲物质中加入50g水,充分溶解后,所得溶液的溶质质量分数为(保留到0.1%)将其升高到t3℃时,所得溶液中溶质和溶液质量比为。(3)、t4℃时,把等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为。(4)、将t4℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数由大到小的顺序为 (填写选项序号)。A、丙>甲=乙 B、甲=乙>丙 C、甲>乙>丙 D、乙>丙>甲(5)、要配制100g的5%的甲溶液,需要20%的甲溶液g;需要的仪器有。17. “微观与宏观相联系”是化学独特的思维方式,请结合图示完成下列问题:(1)、物质性质反映其组成和结构。从宏观进入微观,探索物质变化规律。
(1)、P点的意义是。(2)、t2℃时,向30g甲物质中加入50g水,充分溶解后,所得溶液的溶质质量分数为(保留到0.1%)将其升高到t3℃时,所得溶液中溶质和溶液质量比为。(3)、t4℃时,把等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为。(4)、将t4℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数由大到小的顺序为 (填写选项序号)。A、丙>甲=乙 B、甲=乙>丙 C、甲>乙>丙 D、乙>丙>甲(5)、要配制100g的5%的甲溶液,需要20%的甲溶液g;需要的仪器有。17. “微观与宏观相联系”是化学独特的思维方式,请结合图示完成下列问题:(1)、物质性质反映其组成和结构。从宏观进入微观,探索物质变化规律。
①不同酸有相似的化学性质,但性质也存在差异。图1中能体现酸的通性的是(填字母序号,下同);稀盐酸不能与氯化钡溶液反应,而稀硫酸则能与之反应生成白色沉淀,据图从微粒的角度分析写出该反应的实质是;碱类物质存在通性,不同的碱也有不同的化学性质,例如:氢氧化钙与氢氧化钠,请举一例(用化学方程式表示)。
②一杯水中氢元素与氧元素的质量比和1个水分子中氢原子与氧原子的质量比。(填“相等”或“不相等”)
(2)、物质组成和结构决定其性质。从微观进入宏观,探索物质变化规律。①图2圆圈中表示这杯氯化钠溶液的构成则该氯化钠溶液中溶质和溶剂的质量比是。

②通过分析组成和结构,可以预测物质的某些性质。根据图3硫酸氢钠溶液的微观图示,分析推NaHSO4的性质,其中合理的是。
A.其水溶液能导电
B.其水溶液能使紫色石蕊试液变红
C.其水溶液能与硝酸钡溶液反应生成硫酸钡沉淀
D.能与某些金属反应生成氢气
三、综合题
-
18. 我们的家乡是座美丽的滨海小城,海洋蕴含着丰富的资源,以下是人们从海洋中获取某些物质的方法:
①膜法淡化海水获得淡水
②蒸馏法从海水中提取淡水
③向海水中添加石灰乳,再向得到的沉淀中加稀盐酸,然后电解获得的氯化镁制得镁
④开采出原油并进行分馏获得汽油、煤油等产品
⑤用贝壳(主要成分碳酸钙)制石灰乳
(1)、请从物质变化的角度对上述方法进行分类:一类是(填写序号),另一类是(填写序号),你的分类依据是。(2)、和①膜法淡化海水原理相同的一个实验操作是 , 原理都是依据不同将混合物中的各成分分离。(3)、在②蒸馏法淡化海水时水的三态变化过程与自然界中循环的原理类似。检验蒸馏法得到水是淡水的化学方法是。(用方程式表示)(4)、写出③中电解氯化镁的反应化学方程式。(5)、贝壳制得的生石灰可用来做干燥剂,日常生活中常见的干燥剂除了生石灰干燥剂外。还有一种硅胶干燥剂,硅胶吸附性能高、化学性质稳定,其内部为毛孔网状结构,能够吸收水分,并将水分保留住。根据提供的信息分析他们的干燥原理是否相同? , 理由是。19. 多角度认识盐酸。多角度认识物质,能帮助我们更全面了解物质。以盐酸为例,回答下列问题:(1)、认识盐酸的性质和检验①打开盛有浓盐酸的试剂瓶,可观察到瓶口有 , 说明浓盐酸具性。
②能区分稀盐酸与食盐水的一种试剂或相应的化学方程式是。
③区分稀盐酸与稀硫酸的一个化学方程式。
(2)、辩证地认识盐酸人体内胃酸的主要成分是盐酸,在食物的消化过程中起着重要的作用。但是胃酸过多会引起多种疾病。治疗胃酸过多服用的铝碳酸镁(其主要成分的化学式为AlMg(OH)3CO3)成分中能与胃酸发生反应的的粒子是(填粒子符号)。
20. 利用海水制备镁的流程如图所示: (1)、操作a的名称是 , 需要的玻璃仪器有。(2)、写出第②、③步反应的化学方程式:;。(3)、在③中加入石灰乳过量的目的是 , 可加入试剂观察到证明所加石灰乳已经过量。21. 实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图)化学小组的同学经过询间老师后只知道是NaOH、 NaCl、Na2CO3、 NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
(1)、操作a的名称是 , 需要的玻璃仪器有。(2)、写出第②、③步反应的化学方程式:;。(3)、在③中加入石灰乳过量的目的是 , 可加入试剂观察到证明所加石灰乳已经过量。21. 实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图)化学小组的同学经过询间老师后只知道是NaOH、 NaCl、Na2CO3、 NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
(进行猜想)
猜想1:原溶液的溶质是NaCl
猜想2:原溶液的溶质是NaOH
猜想3:原溶液的溶质是Na2CO3
猜想4:原溶液的溶质是NaHCO3
(查阅资料)常温下,有关物质的相关信息如下表:
物质
NaCl
NaOH
Na2CO3
NaHCO3
常温下的溶解度/g
36
109
21.5
9.6
常温下稀溶液的pH
7
13
11
9
(1)、从物质的相关信息可知,原溶液的溶质一定不是NaHCO3 , 因为。(2)、(进行实验)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是。
(3)、同学们另取样品又进行了如下实验,实验过程如下:
①写出有气泡生成反应的化学方程式。
②通过实验可以判断样品无色溶液中含有的溶质有。
(4)、(获得结论)实验完成后,最终得到的结论:原瓶中的溶质是且已经变质。
(5)、(进一步实验)小刚用上述变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验。他设计如下图所示的实验方案。
写出步骤①发生反应的化学方程式。
(6)、步骤③判断盐酸与氢氧化钠恰好完全反应的实验现象是。(7)、若步骤③中滴加盐酸可能过量,请设计实验证明反应后所得的氯化钠溶液中含有盐酸?(请用两种不同类别的物质验证,写出反应的化学方程式即可。方程式1。方程式2。四、计算题
-
22. 为测定一瓶久置的烧碱样品中NaOH含量,某同学取适量的烧碱样品,溶于一定量的水,得到200g溶液,再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。
请计算:
(1)、反应生成的CO2的质量为?(2)、若所取样品为50g,则样品中NaOH的质量分数是多少?