广西桂林市2020-2021学年高一下学期期末质量检测化学试题
试卷更新日期:2021-12-31 类型:期末考试
一、单选题
-
1. 2021年4月13日,日本政府向海洋排放核废水的决议在国际社会引起巨大反响。下列有关核燃料中铀( )的说法错误的是( )A、原子序数为92 B、核电荷数为92 C、中子数为235 D、质量数为2352. 下列气体的主要成分是甲烷的是( )A、天然气 B、水煤气 C、高炉气 D、焦炉气3. 下列反应既是氧化还原反应,又是放热反应的是( )A、 与 B、 与稀硫酸 C、红热的焦炭与水蒸气 D、 与稀盐酸4. 下列有关化学用语表示错误的是( )A、异丁烷的分子式: B、羧基的结构简式: C、CCl4的球棍模型:
 D、C2H4的电子式:
D、C2H4的电子式:  5. 下列物质属于共价化合物的是( )A、 B、 C、 D、6. 下列装置或操作图示错误的是( )A、海带灼烧
5. 下列物质属于共价化合物的是( )A、 B、 C、 D、6. 下列装置或操作图示错误的是( )A、海带灼烧 B、铝热反应
B、铝热反应  C、石油的分馏
C、石油的分馏  D、分离乙酸乙酯和水
D、分离乙酸乙酯和水  7. 下列说法错误的是( )A、可用电渗析法进行海水淡化 B、煤的干馏是指煤在空气中加强热使其分解的过程 C、大量排放含磷污水会导致水质恶化 D、硫氧化物和 是形成酸雨的主要物质8. 下列各组比较中,错误的是( )A、半径: B、热稳定性: C、酸性: D、还原性:9. 根据元素周期表和元素周期律分析,下列说法正确的是( )A、第IA族的元素全部是碱金属元素 B、硒( )的简单氢化物比硫化氢稳定 C、第三周期非金属元素共有5种 D、铍( )原子失电子能力比镁的强10. 下列说法错误的是( )A、 和 互为同位素 B、甲烷分子是正四面体结构 C、 含电子的数目为 D、淀粉和纤维素互为同分异构体11. 下列冶炼金属的方法错误的是( )A、火法炼 B、电解食盐水炼 C、铝热法炼 D、热分解法炼12. 下列有关化学和能源利用的说法错误的是( )A、煤、石油、天然气属于一次能源 B、化学反应中的能量变化主要由化学键变化引起 C、沼气是一种可再生的清洁能源 D、氢氧燃料电池主要的能量变化是电能转化成化学能13. 加热条件下,某物质可以与新制的 反应生成砖红色沉淀。该物质可能是( )A、乙醇 B、乙酸 C、葡萄糖 D、乙酸乙酯14. 下列名称或化学式只表示一种物质的是( )A、二氯甲烷 B、丁烷 C、 D、15. 下列反应属于取代反应的是( )A、苯制环己烷的反应 B、乙烯合成聚乙烯的反应 C、乙酸的酯化反应 D、乙醇与酸性高锰酸钾溶液反应16. 一定条件下,将 和 ,混合发生反应 。下列有关该反应的说法正确的是( )A、 中不可能含 B、当各物质均含 时,说明该反应达到平衡 C、转移的电子数目可能为 D、当反应达平衡时, 的质量不再变化17. 下列实验操作能达到相应实验目的的是( )
7. 下列说法错误的是( )A、可用电渗析法进行海水淡化 B、煤的干馏是指煤在空气中加强热使其分解的过程 C、大量排放含磷污水会导致水质恶化 D、硫氧化物和 是形成酸雨的主要物质8. 下列各组比较中,错误的是( )A、半径: B、热稳定性: C、酸性: D、还原性:9. 根据元素周期表和元素周期律分析,下列说法正确的是( )A、第IA族的元素全部是碱金属元素 B、硒( )的简单氢化物比硫化氢稳定 C、第三周期非金属元素共有5种 D、铍( )原子失电子能力比镁的强10. 下列说法错误的是( )A、 和 互为同位素 B、甲烷分子是正四面体结构 C、 含电子的数目为 D、淀粉和纤维素互为同分异构体11. 下列冶炼金属的方法错误的是( )A、火法炼 B、电解食盐水炼 C、铝热法炼 D、热分解法炼12. 下列有关化学和能源利用的说法错误的是( )A、煤、石油、天然气属于一次能源 B、化学反应中的能量变化主要由化学键变化引起 C、沼气是一种可再生的清洁能源 D、氢氧燃料电池主要的能量变化是电能转化成化学能13. 加热条件下,某物质可以与新制的 反应生成砖红色沉淀。该物质可能是( )A、乙醇 B、乙酸 C、葡萄糖 D、乙酸乙酯14. 下列名称或化学式只表示一种物质的是( )A、二氯甲烷 B、丁烷 C、 D、15. 下列反应属于取代反应的是( )A、苯制环己烷的反应 B、乙烯合成聚乙烯的反应 C、乙酸的酯化反应 D、乙醇与酸性高锰酸钾溶液反应16. 一定条件下,将 和 ,混合发生反应 。下列有关该反应的说法正确的是( )A、 中不可能含 B、当各物质均含 时,说明该反应达到平衡 C、转移的电子数目可能为 D、当反应达平衡时, 的质量不再变化17. 下列实验操作能达到相应实验目的的是( )选项
实验操作
实验目的
A
将铜片插入 溶液中
比较 和 的活泼性
B
将相同的铁片分别加到等体积的稀硝酸和浓硝酸溶液中
探究浓度对化学反应速率的影响
C
将足量稀盐酸加到 溶液中
比较 和 的非金属性强弱
D
向盛有少量苯的试管中加入酸性 溶液
验证苯分子是否存在碳碳双键
A、A B、B C、C D、D18. 将 和 在 的密闭容器中混合,一定条件下发生反应: , 后测得 剩余 , 的平均反应速率为 ,则 为( )A、1 B、2 C、3 D、419. 在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列说法正确的是( )A、铁为负极,发生还原反应 B、电池工作时, 向正极移动 C、将铜片换成铝片,铁片上有气泡产生 D、当产生 时,电路中转移的电子数目为20. 、 、 、 、 是原子序数依次增大的5种短周期主族元素。5种元素中只有 为金属; 和 的最外层电子数相等; 的某种核素常用来测定一些文物的年代; 、 同主族,且 与 可形成一种淡黄色的固体化合物。下列说法正确的是( )A、 的氢化物的沸点比 的氢化物的沸点高 B、 与 形成的四核化合物既有离子键又有共价键 C、由 、 、 、 四种元素形成的化合物一定是 D、 均可与其余4种元素形成化合物,且 元素的化合价都是+1价二、综合题
-
21. 现有A、B、C、D、E、F六种短周期元素,其相关性质信息如下。请回答下列问题:
元素
特征
元素
特征
A
常见金属,其最高价氧化物对应的水化物可以溶于强碱
D
在地壳中含量最多
B
常见化肥的主要元素,单质常温下呈气态
E
单质为黄绿色有毒气体
C
在短周期主族元素中,原子半径最大
F
原子的核外电子只有1个
(1)、元素D在元素周期表中的位置为 , 其原子的结构示意图为。(2)、A,C,D对应的简单离子的半径由大到小的排序是(用离子符号表示)。(3)、B的最简单氢化物的稳定性(填“>”、“<”或“=”) 的稳定性。(4)、 溶液中存在的化学键类型有(填“离子键”、“共价键”或“离子键和共价键”)。A的最高价氧化物的水化物与 溶液反应的离子方程式为。(5)、用电子式表示化合物 的形成过程。(6)、已知 是一种强氧化性漂白剂,它在碱性环境中稳定存在。在碱性条件下, 和 恰好完全反应,该反应的离子方程式为。三、综合题
-
22. 根据所学知识,回答下列问题。(1)、I.铁片与稀硫酸反应的能量变化特征如图所示:

该反应为反应(填“吸热”或“放热”)。
(2)、若要使该反应速率加快,下列措施可行的是_______(填符合题意选项的字母编号)。A、改用铁粉 B、改用98%的硫酸 C、适当升高温度(3)、II.以相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:实验编号
水果种类
电极间距离/cm
电流/μA

1
番茄
1
98.7
2
番茄
2
72.5
3
苹果
2
27.2
该实验目的是研究水果种类和对水果电池电流大小的影响。
(4)、该实验装置中,正极的材料是 , 负极的电极反应式是。当有 参与反应,转移的电子数目为。(5)、Ⅲ.某温度下,体积为1L恒容密闭容器中,X、Y两种气体物质的量随时间的变化曲线如图所示。请回答下列问题: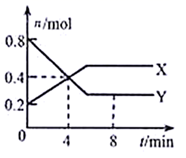
由图中数据分析,该反应的化学方程式为。
(6)、4min时容器内的压强与起始压强之比为。(7)、不能说明该反应达到平衡状态的是_______(填符合题意选项的字母编号)。A、容器内压强不再变化 B、混合气体的密度不再变化 C、X气体与Y气体的浓度不再变化 D、容器内混合气体平均摩尔质量不再变化23. 硫酸镁广泛应用于建材、医药、工业、农业等方面,工业上常用纯橄岩制硫酸镁。纯橄岩是含镁的硅酸盐矿物,含有 、 、 、 和一些有机物等杂质,其制备工艺流程如下:
已知:① 不溶于水,可溶于硫酸溶液② 不溶于稀硫酸
③ 时, 以 形式完全沉淀
(1)、酸浸时,将纯橄岩粉碎的目的是。(2)、酸浸时温度控制在 ,可采用的合适加热方式是。(3)、滤渣Ⅰ中的主要成分是 , 实验室中过滤操作所需玻璃仪器有烧杯、漏斗、。(4)、加入 溶液,可将滤液I中的 氧化成 ,同时也将 氧化成 。生成 反应的离子方程式是。检验滤液Ⅱ是否还含有 :取适量溶液于试管中,加入试剂 ,观察现象。X最好选择(填符合题意选项的字母编号)。A. 溶液 B.酸性 溶液 C. 溶液
(5)、取10g洗净并已干燥的滤渣II,加入足量稀硫酸,充分反应后得4.65g固体,则滤渣II中铁元素的质量分数为。24. 烃A是一种重要的化工原料,其气体密度是相同条件下H2的14倍,E是一种具有浓郁香味的有机物。A、B、C、D、E、F在一定条件下有如下转化关系(部分反应条件、产物被省略):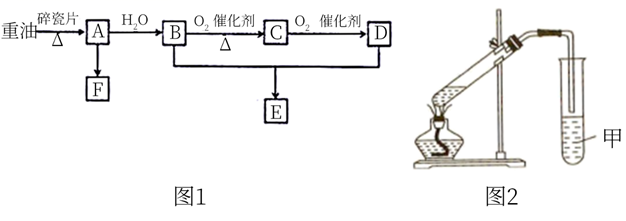 (1)、A的分子式是 , A转化成B的反应类型是。(2)、B分子中的官能团名称是;鉴别B和D可选用的试剂是(填符合题意选项的字母编号)。
(1)、A的分子式是 , A转化成B的反应类型是。(2)、B分子中的官能团名称是;鉴别B和D可选用的试剂是(填符合题意选项的字母编号)。A. 溶液 B.酸性 溶液 C.蒸馏水
(3)、F是一种高分子材料,其名称是 , 结构简式为。(4)、B生成C的化学方程式是。(5)、现用3.0gD与4.6gB制取E,其装置如图2所示。甲试管盛有滴加了酚酞的饱和 溶液。①实验中 溶液的作用是吸收乙醇、中和、降低乙酸乙酯的溶解度,利于其分层析出。
②实验结束后,观察到试管中上层为透明、不溶于水的油状液体。但仔细对比,甲试管溶液的颜色比实验前要浅一些,你认为可能的原因是。
③若实验中乙酸乙酯的产率为67%,则实际得到的乙酸乙酯的质量为g(结果保留两位小数)。
-