四川省雅安市2020-2021学年高一下学期期末检测化学试题
试卷更新日期:2021-12-31 类型:期末考试
一、单选题
-
1. 下列变化不属于化学变化的是( )A、煤的干馏 B、石油分馏 C、重油裂化 D、NO2通入水中2. 下列变化过程不属于金属冶炼的是( )A、电解氧化铝 B、铁在氧气中燃烧 C、金属氧化物与焦炭在高温下反应 D、高温下CO还原CuO3. 下列反应不属于可逆反应的是( )A、NO与氧气反应 B、H2与N2反应合成NH3 C、NH3溶于水 D、Cl2溶于水4. 使用非环保合成材料进行室内装修,易造成居室和办公室的空气污染,这种污染物的主要成分是( )A、一氧化碳 B、甲醛 C、一氧化氮 D、二氧化硫5. 下列反应中既属于氧化还原反应又属于放热反应的是( )A、氢氧化钾与硫酸的反应 B、碳酸钠与盐酸反应放出气体 C、镁条在空气中燃烧 D、Ba(OH)2•8H2O与NH4Cl反应6. 你认为减少酸雨可采取的措施是( )
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④开发新能源
A、①②③ B、②③④ C、①③④ D、①③7. 关于糖类的说法正确的是( )A、糖类都有甜味 B、淀粉和纤维素均不是糖类 C、糖类都可以水解 D、糖类都含有C,H和O元素8. 按下述实验方法制备气体,合理又实用的是( )A、锌粒与稀硝酸反应制备H2 B、加热分解NH4Cl固体制备NH3 C、亚硫酸钠与浓硫酸反应制备SO2 D、大理石与浓硫酸反应制备CO29. 下列物质中不含共价键的是( )A、水 B、甲烷 C、二氧化碳 D、单质氦10. 某实验兴趣小组以Zn和Cu为电极,稀硫酸为电解质溶液研究原电池,并对实验进行了拓展,以下实验记录错误的是( )A、铜片上有气泡产生,锌片逐渐溶解 B、电子在溶液中从Cu电极流向Zn电极 C、把铜片换成石墨,实验现象相同 D、把稀硫酸换成硫酸铜溶液,电流计指针依然偏转11. 下列关于离子化合物的说法正确的是( )A、离子化合物一定能导电 B、离子化合物不一定易溶于水 C、能导电的物质一定是离子化合物 D、溶于水能导电的化合物一定是离子化合物12. 在某一化学反应中,反应物A的浓度在10s内从0.8 mol·L-1变为0.2 mol·L-1 , 则在这10s内A的化学反应速率为( )A、0.06 mol·L-1·s-1 B、0.02 mol·L-1·s-1 C、0.02 mol·L-1 D、0.08 mol·L-1·s-113. 氢氧燃料电池已经用于航天飞机,以30%KOH溶液为电解质溶液的这种电池总反应为2H2+O2=2H2O。下列有关该电池的说法中正确的是( )A、H2在负极上发生还原反应 B、正极反应:O2+2H2O+4e-=4OH- C、使用后溶液中的c(OH-)会增大 D、该电池的能量转化率一定是100%14. 下列叙述正确的是( )A、同一元素的各种同位素性质相同 B、所有主族元素的原子,形成简单离子时,化合价和它的族序数相等 C、同一周期中的第ⅡA族和第ⅢA族元素的原子序数相差1或11或25 D、因为酸性:HCl>H2S,所以非金属性:Cl>S15. 下列各组离子能在溶液中大量共存的是( )A、H+、Fe2+、NO、Cl- B、Na+、Ba2+、NO、SO C、NH、HCO、NO、OH- D、K+、H+、SO、NO16. 下列各组性质的比较中正确的是( )A、酸性:HClO4<HBrO4<HIO4 B、稳定性:H2Se>H2S>H2O C、碱性:KOH>NaOH>LiOH D、氧化性:I2>Br2>Cl217. CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )A、CO全部转化为乙醇 B、正反应和逆反应的化学反应速率均为0 C、CO和H2以1∶2的物质的量之比反应生成乙醇 D、反应体系中乙醇的物质的量浓度不再变化18. 金刚石和石墨是碳元素的两种结构不同的单质(同素异形体),在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能,据此,试判断在100kPa下,下列结论正确的是( )A、石墨比金刚石稳定 B、金刚石比石墨稳定 C、1mol石墨比1mol金刚石总能量高 D、金刚石转化为石墨是物理变化19. 汽车尾气管中安装有尾气处理装置,以降低汽车使用过程中对环境的污染,其工作原理如图所示,下列说法正确的是( )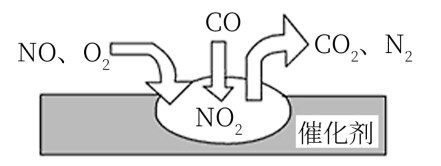 A、反应中NO为氧化剂,N2为氧化产物 B、汽车尾气的主要污染成分包括CO、NO和N2 C、催化转化总反应为2NO+O2+4CO4CO2+N2 D、NO和O2必须在催化剂表面才能反应20. 聚丙烯(
A、反应中NO为氧化剂,N2为氧化产物 B、汽车尾气的主要污染成分包括CO、NO和N2 C、催化转化总反应为2NO+O2+4CO4CO2+N2 D、NO和O2必须在催化剂表面才能反应20. 聚丙烯( )是生产口罩的关键材料之一,下列说法错误的是( ) A、聚丙烯的单体是CH3CH=CH2 B、合成聚丙烯的反应类型是加聚反应 C、聚丙烯是合成高分子化合物 D、聚丙烯可跟溴水反应21. 相同质量的四份铜片,分别置于足量的下列酸中,在一定条件下反应,所得到的气体的物质的量最多的是( )A、浓硫酸 B、稀硫酸 C、浓硝酸 D、稀硝酸
)是生产口罩的关键材料之一,下列说法错误的是( ) A、聚丙烯的单体是CH3CH=CH2 B、合成聚丙烯的反应类型是加聚反应 C、聚丙烯是合成高分子化合物 D、聚丙烯可跟溴水反应21. 相同质量的四份铜片,分别置于足量的下列酸中,在一定条件下反应,所得到的气体的物质的量最多的是( )A、浓硫酸 B、稀硫酸 C、浓硝酸 D、稀硝酸二、填空题
-
22. 有机物的特征性质是由分子的特征结构(官能团)决定的,例如乙烯的加成反应,氧化反应都是因为乙烯分子中含有碳碳双键官能团所致。丙烯的结构简式可以表示为CH3CH=CH2或者
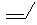 , 因此丙烯也可以发生加成反应和氧化反应。
, 因此丙烯也可以发生加成反应和氧化反应。下列三种有机物是某些香水中的常见部分成分。
 (1)、月桂烯的分子式是。1mol月桂烯最多能够跟molBr2发生加成反应。月桂烯的一氯取代物有种。(2)、柠檬醛和香叶醇是否是同分异构体(填“是”或“否”),理由是。(3)、香叶醇含有的官能团是(填写官能团名称)。下列物质能与香叶醇发生反应的是(填字母代号)。
(1)、月桂烯的分子式是。1mol月桂烯最多能够跟molBr2发生加成反应。月桂烯的一氯取代物有种。(2)、柠檬醛和香叶醇是否是同分异构体(填“是”或“否”),理由是。(3)、香叶醇含有的官能团是(填写官能团名称)。下列物质能与香叶醇发生反应的是(填字母代号)。A.酸性KMnO4溶液 B.Br2/CCl4 C.Na D.NaOH E.NaHCO3
三、综合题
-
23. 某实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
 (1)、实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式。(2)、在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化氧化反应是(填“放热”或“吸热”)反应。进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如下图所示。试解释出现图中现象的原因。
(1)、实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式。(2)、在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化氧化反应是(填“放热”或“吸热”)反应。进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如下图所示。试解释出现图中现象的原因。 (3)、甲和乙两个水浴作用不相同。甲的作用是;乙的作用是。(4)、若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可在混合液中加入(填写字母)。
(3)、甲和乙两个水浴作用不相同。甲的作用是;乙的作用是。(4)、若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可在混合液中加入(填写字母)。A.氯化钠溶液B.苯
C.碳酸氢钠溶液D.四氯化碳
然后,再通过(填实验操作名称)即可除去。
24. 海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了如图所示的实验:
请回答下列问题:
(1)、实验时灼烧海带应在(填仪器名称)内进行。(2)、步骤④中反应的离子方程式是。(3)、步骤⑤中选用的溶剂X可以是(填试剂名称)。(4)、上述流程中的实验操作包括下列选项中____(按操作顺序选填代号)。A、过滤 B、蒸发 C、蒸馏 D、分液(5)、请设计一个简单的实验方案,检验步骤⑤提取碘后的溶液中是否还含有单质碘。25. 短周期中的A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质在不同条件下反应生成一种淡黄色的固体E或白色固体F;D元素的单质为黄绿色气体。(1)、元素D的原子结构示意图为;它在周期表中的位置是周期族。(2)、D元素的最高价氧化物对应的水化物与C的最高价氧化物对应水化物在水溶液中反应的离子方程式为。(3)、F属于(离子、共价)化合物,F的电子式表示为。(4)、在E与水的反应中,反应物的总能量生成物的总能量(填“高于”、“低于”、“等于”),生成的化合物中的化学键含有(填“离子键”、“极性键”、“非极性键”),该反应的化学方程式为。(5)、写出AB2分子的结构式 , AB2与C的最高价氧化物对应水化物以物质的量之比按1︰1在溶液中进行反应的离子方程式为。26. 含有不同价态硫元素的物质之间的转化在工业生产中具有重要的应用。(1)、硫酸是重要的基础化工原料,可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
①工业上常以黄铁矿(FeS2)为原料来制备SO2 , 配平该反应的化学方程式
FeS2+ O2 Fe2O3+ SO2
②写出催化反应室中SO2被氧化为SO3的化学方程式。
③硫酸工业的尾气中含有少量SO2 , 若直接排放会污染空气,并导致硫酸型酸雨。下列物质中,能吸收SO2的有(填字母)。
A.氨水B.酸性KMnO4溶液C.生石灰D.Na2CO3溶液
(2)、石油加氢精制和天然气净化等过程产生有毒的H2S,直接排放会污染空气。工业上用克劳斯工艺处理含H2S的尾气,并获得硫单质,流程如下:
①反应炉中发生反应:2H2S+3O22SO2+2H2O
②催化转化器中发生反应的化学方程式。
③为了提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率为(填字母)。[转化率=反应的n(A)/起始的n(A)]
A. B. C.D.1
-