四川省成都市龙泉驿区2020-2021学年高一下学期末学业质量监测联考化学试题
试卷更新日期:2021-12-31 类型:期末考试
一、单选题
-
1. 2022年成都大运会办赛理念为“绿色、智慧、活力、共享”,提倡“健康生活、积极运动”是大运会的宗旨和目的。下列有关说法错误的是( )A、把环境保护作为大运会设施规划和建设的首要条件 B、鼓励观众乘坐公共交通工具、骑行自行车等到赛场观看比赛 C、尽可能佩戴口罩,防止新冠病毒等交叉感染 D、体育场馆建设尽可能使用天然材料,不使用合成材料
-
2. 下列叙述正确的是( )A、符合通式的一定属于糖类 B、疫苗一般应冷藏存放,以避免蛋白质变性 C、植物油氢化过程中发生了取代反应 D、葡萄糖和蔗糖属于同系物,淀粉和纤维素互为同分异构体
-
3. 下列化学用语正确的是( )A、乙醛的结构简式: B、次氯酸的结构式: C、原子核内有18个中子的氯原子: D、的电子式:

-
4. 下列性质比较中错误的是( )A、还原性: B、熔点: C、碱性: D、氧化性:
-
5. 化石燃料对人类社会的发展具有十分重要的作用。下列说法正确的是( )A、化石燃料十分重要,要尽可能地开发利用 B、天然气是一种清洁的化石燃料,也可用作化工原料合成氨和生产甲醇等 C、煤气化为气体燃料可减少二氧化碳的排放,避免出现温室效应 D、石油分馏可得到乙烯、丙烯、甲烷等重要化工基本原料
-
6. 能用来鉴别苯、己烯和乙醇的是( )A、金属钠 B、氢氧化钠溶液 C、溴水 D、饱和溶液
-
7. 以乙烯为原料生产环氧乙烷。其经典方法是氯代乙醇法,它包括两步反应:
① , ②ClCH2CH2OH+HCl+Ca(OH)2
 +2H2O+CaCl2 , 现代方法中石油化工采用银作催化剂,一步完成,其反应的化学方程式为:2CH2=CH2+O2 2
+2H2O+CaCl2 , 现代方法中石油化工采用银作催化剂,一步完成,其反应的化学方程式为:2CH2=CH2+O2 2 。比较上述两种方法,下列说法错误的是( )A、现代方法原子利用率更高 B、经典方法更易腐蚀设备 C、经典方法生产成本更高 D、两种方法中都运用了加成、取代反应原理
。比较上述两种方法,下列说法错误的是( )A、现代方法原子利用率更高 B、经典方法更易腐蚀设备 C、经典方法生产成本更高 D、两种方法中都运用了加成、取代反应原理 -
8. 已知化学反应的能量变化曲线如图所示。
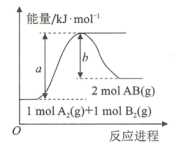
下列叙述错误的是能量( )
A、反应物的总能量低于生成物的总能量 B、生成1molAB需吸收(a-b)kJ的热量 C、 D、加入催化剂不会改变该反应的反应热 -
9. 丙氨酸的结构简式为
 , 下列有关该物质的叙述正确的是( ) A、只有一种官能团-COOH B、与乙酸互为同系物 C、某些蛋白质分子中含有-CONH-,则丙氨酸在一定条件下能发生分子间反应 D、1mol该物质与足量的碳酸钠溶液反应生成
, 下列有关该物质的叙述正确的是( ) A、只有一种官能团-COOH B、与乙酸互为同系物 C、某些蛋白质分子中含有-CONH-,则丙氨酸在一定条件下能发生分子间反应 D、1mol该物质与足量的碳酸钠溶液反应生成 -
10. 为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,和的混合气体中含有个氧原子 B、和17g-OH所含电子数均为 C、与在光照条件下反应,生成的分子数为 D、38.0g正丁烷38.0g正丁烷的混合物中共价键数目为
-
11. 下列判断正确的是( )A、酸性 , 则硫元素的非金属性比碳元素强 B、向含有、的溶液中加入足量的Fe粉,先析出Ag,后析出Cu,则金属性Fe>Cu>Ag C、向某无色溶液中加入少量溶液,有白色沉淀产生,则该溶液中一定含有 D、相同质量的Al和Fe与足量的稀盐酸反应,Al放出的多,则Al的金属性比Fe强
-
12. 已知: , 下列说法正确的是( )A、的燃烧热为 B、该反应能说明比稳定 C、 D、由于题设没有条件限制,所以反应中的能量变化与反应体系的温度和压强无关
-
13. X、Y、Z均为短周期元素,、、简单离子的电子层结构相同,下列说法正确的是( )A、原子序数:X>Y>Z B、离子半径: C、的氧化性一定大于 D、X与Z可能形成既含离子键又含共价键的化合物
-
14. 航天飞机用铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵分解,其反应为: , 下列叙述错误的是( )A、化合反应一定是放热反应,分解反应一定是吸热反应 B、在该反应中,既是氧化剂,又是还原剂 C、从能量变化看,整个反应过程主要是化学能转变为热能和动能 D、分解瞬间产生大量的高温气体推动航天飞机飞行
-
15. 下列由实验得出的结论正确的是( )
实验
结论
A
将石蜡油加强热后产生的气体持续通入酸性溶液中,溶液最终变为无色
产生的气体中一定含有乙烯和丙烯
B
用乙酸较长时间持续浸泡水壶中的水垢,水垢最终溶解消除
乙酸的酸性小于碳酸的酸性
C
向油脂皂化后的溶液中滴入酚酞试液,溶液变红色
油脂皂化生成有碱
D
蔗糖溶液在稀硫酸存在下水浴加热一段时间后,加氢氧化钠溶液调溶液至碱性,再加入银氨溶液混合加热,有光亮的银生成
蔗糖一定发生了水解
A、A B、B C、C D、D -
16. 常温下,1mol化学键分解成气态原子所需能量用表示,结合表中信息,下列说法正确的是( )
共价键
H-H
H-F
H-Cl
H-I
F-F
436
568
432
298
157
A、上述共价键中F-F最稳定 B、断裂H-F需要吸收568kJ的热量 C、 D、 -
17. 2021年6月17日,我国神舟十二号载人飞船成功发射,中国空间站和国际空间站将同时在轨运营,此举开创了国际航天事业的新篇章,制造神舟十二号载人飞船的材料中含有的主族元素W、X、Y、Z,分布在三个短周期中,其原子序数依次增大,X、Z同主族,X的最外层电子数是W和Y的最外层电子数之和,它们的单质中只有Y的单质为金属,能与NaOH溶液反应。下列叙述正确的是( )A、原子半径大小顺序为Z>Y>X>W B、Z的氧化物为酸性氧化物,能与水反应生成对应的酸 C、W与X形成的化合物分子都呈正四面体结构 D、Z单质可广泛应用于制造光电池、芯片等
-
18. 有机物A的分子式为 , 可发生如下转化。已知B、D是生活中的两种常见有机物。下列说法错误的是( )
 A、有机物E的结构简式为 B、由有机物B生成C的化学方程式为: C、用饱和溶液可鉴别B、D、E D、由B、D制备E时常用浓硫酸作催化剂和吸水剂
A、有机物E的结构简式为 B、由有机物B生成C的化学方程式为: C、用饱和溶液可鉴别B、D、E D、由B、D制备E时常用浓硫酸作催化剂和吸水剂 -
19. 短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21,下列分析正确的是( )
W
X
Y
Z
A、氢化物的沸点:X<Y B、化合物的熔点: C、中X的化合价为+2 D、与W单质反应能生成气体 -
20. 海洋约占地球表面积的70%,对其开发利用具有广阔的前景。对于下列流程说法错误的是( )
 A、粗盐中含有的需依次加入溶液、溶液、稀HCl除去 B、苦卤中提溴反应的离子方程式为 C、工业上“试剂1”最好选择石灰乳 D、工业上电解熔融的MgO可冶炼金属Mg
A、粗盐中含有的需依次加入溶液、溶液、稀HCl除去 B、苦卤中提溴反应的离子方程式为 C、工业上“试剂1”最好选择石灰乳 D、工业上电解熔融的MgO可冶炼金属Mg -
21. 已知
①
②
③
则的值为( )
A、 B、 C、 D、
二、综合题
-
22. A、B、C、D、E为原子序数依次增大的五种短周期主族元素。其中A的原子半径在短周期主族元素中是最小的;B的阴离子与C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体甲;D的L层电子数等于K、M两个电子层上电子数之和。
回答下列问题:
(1)、E元素在周期表中的位置为;固体甲的电子式为。(2)、D,E的简单氢化物中,最稳定的是(填化学式),B的简单氢化物沸点较高,其原因是。B、C、D、E的简单离子的离子半径由大到小的顺序为(填离子符号)。(3)、A,C,D能形成CAD的化合物,该化合物中存在的化学键有;A、C能形成离子化合物乙,写出物质乙与水反应的化学方程式。(4)、A,B,C,D能组成两种均含该四种元素的化合物,这两种化合物在水溶液中能发生反应,其反应的离子方程式为。 -
23. 当今,塑料制品的大量生产与使用给环境造成了严重的“白色污染”,亟需寻找有效途径予以治理。某些废旧塑料可采用如图所示方法进行处理:将废弃塑料隔绝空气加强热(加热装置略),使其变成有用的物质。已知对废弃塑料加强热得到的产物有氢气、甲烷、乙烯、丙烯、苯、甲苯、炭等。

回答下列问题:
(1)、试管B中收集到的产品有;C处的现象是;D处点燃的气体除可用作燃料外,还可以(任写另一种用途)。(2)、乙烯、丙烯都是生产塑料的主要原料,其中丙烯的结构简式为;在一定条件下,由乙烯生产聚乙烯的化学方程式为。(3)、苯、甲苯都是重要的化学试剂与化工原料。实验室可用苯制备溴苯,其实验装置如图所示。
①圆底烧瓶中发生的有机反应化学方程式为 , 反应类型为。
②装置b中的作用是 , 装置c中溶液的作用是。
(4)、甲苯在一定条件下与溴反应能生成的有机化合物,该有机化合物属于芳香类的化合物有种。 -
24. 某化学课外兴趣小组设计了如下实验装置,用来比较乙酸、碳酸和硅酸的酸性强弱。回答下列问题:
 (1)、装置甲、装置乙中所盛药品分别是、。(2)、装置C中发生反应的离子方程式为。(3)、得出的实验结论是。(4)、若去掉装置B进行实验,能否得出上述实验结论?(填“能”或“否”),理由是。(5)、利用去掉B后的装置来比较Cl、C和Si的非金属性,装置甲中盛放的药品是(填溶质的化学式);得出的结论是。
(1)、装置甲、装置乙中所盛药品分别是、。(2)、装置C中发生反应的离子方程式为。(3)、得出的实验结论是。(4)、若去掉装置B进行实验,能否得出上述实验结论?(填“能”或“否”),理由是。(5)、利用去掉B后的装置来比较Cl、C和Si的非金属性,装置甲中盛放的药品是(填溶质的化学式);得出的结论是。
三、填空题
-
25. 回答下列问题:(1)、Ⅰ.已知: , 现用下图所示装置测定中和热。

回答下列问题:
碎泡沫塑料的作用是;若将A换为“铜丝搅拌棒”测得的将(填“偏大”、“偏小”或“不变”)。
(2)、若用配制成稀溶液,与足量的稀硝酸反应,放出的热量为kJ。(3)、Ⅱ.2021年5月29日天舟二号货运飞船成功发射,为中国空间站进一步开展在轨建造奠定了坚实基础,该飞船由长征七号遥三运载火箭搭载。长征七号遥三运载火箭使用煤油为燃料煤油的主要成分为 , 已知完全燃烧生成气态水时放出1386.2kJ热量;。则表示煤油燃烧热的热化学方程式为。
(4)、前期的火箭曾用液态肼()与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出256.7kJ的热量,则此反应的热化学方程式为。(5)、Ⅲ.将氧化铁还原为铁的技术在人类文明进步中占据十分重要的地位。高炉炼铁中发生的部分反应为:①
②
已知。则高炉内被CO还原为Fe的热化学方程式为。
(6)、碳(s)在氧气不足的情况下燃烧,会生成CO,但同时也有部分生成 , 因此无法通过实验直接测得反应:的 , 计算时需要测得的实验数据有。若根据上述信息可计算出该反应的kJ/mol。 -
26. 锡、钨、锦和稀土并称为中国的四大战略资源,工业上主要以锡石(主要成分为 , 还含有、、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:

查阅资料可知:钨酸钙()难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
回答下列问题:
(1)、氧化焙烧时加快反应速率的方法有(任填一种),气体甲的主要成分是(填化学式)。(2)、在固体1中加入溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是(填化学式);固体2中Pb元素的化合价为。(3)、固体3通过还原冶炼可得到粗锡,若使用焦炭在高温条件下进行,其反应原理与二氧化硅和碳反应相似,则还原制得锡的化学方程式为。(4)、具有强还原性,在酸性条件易被空气中的氧化,其反应的离子方程式为。(5)、通过下列过程可以测定粗锡中锡的纯度:将粗锡样品溶于盐酸中得到溶液,再加入过量的溶液转化为 , 然后用已知浓度的溶液去滴定生成的。现有粗锡样品0.613g,经上述各步反应后,共用去溶液16.0mL,则该粗锡样品中锡的质量分数为(假设杂质不参与反应)。
