四川省成都市简阳市2020~2021学年高一下期期末调研考试化学试题
试卷更新日期:2021-12-31 类型:期末考试
一、单选题
-
1. “垃圾分类、绿色环保”。生活中,废塑料、易拉罐应对应放入的垃圾桶是( )A、可回收物
 B、其它垃圾
B、其它垃圾 C、有害垃圾
C、有害垃圾 D、餐厨垃圾
D、餐厨垃圾 2. 在新冠疫情的防控期间,常用医用酒精、过氧乙酸(CH3COOOH)、84消毒液等消杀病毒。下列有关说法正确的是( )A、医用酒精含乙醇95% B、84消毒液可与酒精混合使用 C、过氧乙酸的摩尔质量为76g D、病毒中的蛋白质属于高分子化合物3. 下列金属中,通常采用热还原法冶炼的是( )A、K B、Al C、Fe D、Au(金)4. 化学与社会发展密切相关。下列说法错误的是( )A、天然气是一种清洁的化石燃料 B、绿色化学的核心是治理被污染的环境 C、煤的干馏、石油裂化均属于化学变化 D、燃煤中加入CaO可减少酸雨的形成5. 下列化学用语正确的是( )A、HCl的电子式:
2. 在新冠疫情的防控期间,常用医用酒精、过氧乙酸(CH3COOOH)、84消毒液等消杀病毒。下列有关说法正确的是( )A、医用酒精含乙醇95% B、84消毒液可与酒精混合使用 C、过氧乙酸的摩尔质量为76g D、病毒中的蛋白质属于高分子化合物3. 下列金属中,通常采用热还原法冶炼的是( )A、K B、Al C、Fe D、Au(金)4. 化学与社会发展密切相关。下列说法错误的是( )A、天然气是一种清洁的化石燃料 B、绿色化学的核心是治理被污染的环境 C、煤的干馏、石油裂化均属于化学变化 D、燃煤中加入CaO可减少酸雨的形成5. 下列化学用语正确的是( )A、HCl的电子式: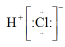 B、CCl4的比例模型(充填模型):
B、CCl4的比例模型(充填模型): C、中子数为2的氢原子:
D、异丁烷的结构简式:(CH3)2CHCH3
6. 下列过程中,化学键未被破坏的是( )A、HCl溶于水 B、将NaCl固体加热至熔融 C、干冰升华 D、将Cl2通入水中7. 下列各组比较中错误的是( )A、稳定性:NH3<HF B、与钠反应的剧烈程度:C2H5OH<H2O C、阴离子的还原性: D、碱性:KOH>NaOH>Mg(OH)28. 同温同压下,等体积的两容器中分别充14N2和13C16O两种气体。下列对两容器中气体的判断正确的是( )A、质量数相同 B、分子数不同 C、中子数相同 D、质子数相同9. 某有机物的结构简式为HO-CH2CH=CHCH2COOH。下列有关该有机物的说法正确的是( )A、分子中含有两种官能团 B、能与乙醇、乙酸反应,且反应类型相同 C、1mol该有机物与足量金属钠反应可产生0.5mol H2 D、可使溴的CCl4溶液、酸性KMnO4溶液褪色,且原理相同10. 下列图示实验正确的是( )A、制备氨水
C、中子数为2的氢原子:
D、异丁烷的结构简式:(CH3)2CHCH3
6. 下列过程中,化学键未被破坏的是( )A、HCl溶于水 B、将NaCl固体加热至熔融 C、干冰升华 D、将Cl2通入水中7. 下列各组比较中错误的是( )A、稳定性:NH3<HF B、与钠反应的剧烈程度:C2H5OH<H2O C、阴离子的还原性: D、碱性:KOH>NaOH>Mg(OH)28. 同温同压下,等体积的两容器中分别充14N2和13C16O两种气体。下列对两容器中气体的判断正确的是( )A、质量数相同 B、分子数不同 C、中子数相同 D、质子数相同9. 某有机物的结构简式为HO-CH2CH=CHCH2COOH。下列有关该有机物的说法正确的是( )A、分子中含有两种官能团 B、能与乙醇、乙酸反应,且反应类型相同 C、1mol该有机物与足量金属钠反应可产生0.5mol H2 D、可使溴的CCl4溶液、酸性KMnO4溶液褪色,且原理相同10. 下列图示实验正确的是( )A、制备氨水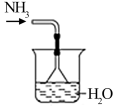 B、配制0.1mol·L-1 NaCl溶液
B、配制0.1mol·L-1 NaCl溶液 C、制备时收集乙酸乙酯
C、制备时收集乙酸乙酯 D、灼烧海带变为灰烬
D、灼烧海带变为灰烬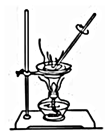 11. W、X、Y、Z为原子序数依次增大的短周期主族元素,它们原子的最外层电子数之和为20。与Y+的电子层结构相同。下列说法错误的是( )A、原子半径:Y>Z>W>X B、非金属性:X>W>Z C、Y2W2含有离子键、非极性共价键 D、Z的氧化物对应的水化物均为强酸12. 下列关于常见有机物的说法错误的是( )A、乙醇、乙酸、苯可以用Na2CO3溶液区分 B、正丁烷的二氯代物的同分异构体有6种 C、油脂属于酯类,不能使溴水褪色 D、淀粉、纤维素、油脂、蛋白质均能发生水解反应13. 下列事实不能说明氯元素的非金属性比硫元素强的是( )A、Cl2能与H2S反应生成S B、溶于水时,HCl是强酸,H2S是弱酸 C、HClO4的酸性强于H2SO4 D、受热时,H2S易分解,HCl不易分解14. 下表所列各组物质中,物质之间不能通过一步反应实现如图转化的是( )
11. W、X、Y、Z为原子序数依次增大的短周期主族元素,它们原子的最外层电子数之和为20。与Y+的电子层结构相同。下列说法错误的是( )A、原子半径:Y>Z>W>X B、非金属性:X>W>Z C、Y2W2含有离子键、非极性共价键 D、Z的氧化物对应的水化物均为强酸12. 下列关于常见有机物的说法错误的是( )A、乙醇、乙酸、苯可以用Na2CO3溶液区分 B、正丁烷的二氯代物的同分异构体有6种 C、油脂属于酯类,不能使溴水褪色 D、淀粉、纤维素、油脂、蛋白质均能发生水解反应13. 下列事实不能说明氯元素的非金属性比硫元素强的是( )A、Cl2能与H2S反应生成S B、溶于水时,HCl是强酸,H2S是弱酸 C、HClO4的酸性强于H2SO4 D、受热时,H2S易分解,HCl不易分解14. 下表所列各组物质中,物质之间不能通过一步反应实现如图转化的是( )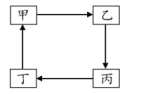
选项
甲
乙
丙
丁
A
Na
NaOH
Na2CO3
NaCl
B
Ca
CaO
Ca(OH)2
CaCO3
C
Al2O3
AlCl3
NaAlO2
Al(OH)3
D
乙醇
乙醛
乙酸
乙酸乙酯
A、A B、B C、C D、D15. 设NA是阿伏加德罗常数的值。下列说法正确的是( )A、2.4g石墨烯与金刚石的混合物中含有的碳原子数为0.2NA B、7.8g苯分子中含有碳碳双键的数目为0.3NA、碳碳单键的数目为0.3NA C、0.1molOH和1.7g羟基(-OH)的电子数均为NA D、标准状况下,11.2L二氯甲烷中含共用电子对数为2NA16. 能符合题意表示下列反应的离子方程式的是( )A、往FeI2溶液中通入少量 B、将水垢浸泡在醋酸中 C、NaOH溶液与过量Ca(HCO3)2溶液反应 D、向NaAlO2溶液中通入过量17. 下图表示以太阳能为热源分解Fe3O4制H2的过程。下列有关叙述错误的是( ) A、过程I是将太阳能转化为了化学能 B、过程I既是分解反应,又是氧化还原反应 C、过程II中每消耗72gFeO转移2mol电子 D、该方法具有节约能源、产物易分离等优点18. 下列关于实验原理或操作的叙述,正确的是( )A、用乙醇代替CCl4萃取碘水中的碘 B、用酸性高锰酸钾溶液除去乙烷中混有的乙烯 C、将乙醇和乙酸加入浓硫酸中混合加热以制取乙酸乙酯 D、除去溴苯中混有的溴,加稀NaOH溶液反复洗涤、分液19. 由下列实验及现象所得出的结论正确的是( )
A、过程I是将太阳能转化为了化学能 B、过程I既是分解反应,又是氧化还原反应 C、过程II中每消耗72gFeO转移2mol电子 D、该方法具有节约能源、产物易分离等优点18. 下列关于实验原理或操作的叙述,正确的是( )A、用乙醇代替CCl4萃取碘水中的碘 B、用酸性高锰酸钾溶液除去乙烷中混有的乙烯 C、将乙醇和乙酸加入浓硫酸中混合加热以制取乙酸乙酯 D、除去溴苯中混有的溴,加稀NaOH溶液反复洗涤、分液19. 由下列实验及现象所得出的结论正确的是( )选项
实验
现象
结论
A
①某溶液中加入硝酸钡溶液
②再加入足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中不一定含有
B
加热盛有NH4Cl固体的试管
试管底部固体消失、试管口有晶体凝结
NH4Cl固体可以升华
C
向久置于空气中的FeSO4溶液中滴入KSCN溶液
溶液变红
FeSO4溶液完全变质
D
水浴加热蔗糖与稀硫酸混合溶液,然后加入新制氢氧化铜悬浊液,再加热
未出现砖红色沉淀
蔗糖未发生水解
A、A B、B C、C D、D20. 海水开发利用的部分过程如图所示,下列有关说法正确的是( ) A、除去粗盐中的Ca2+、Mg2+、 , 加入试剂的顺序是:Na2CO3→NaOH→BaCl2→过滤后加盐酸 B、步骤②在工业生产中常选用石灰乳作Mg2+的沉淀剂 C、第④步反应中氧化产物与还原产物的物质的量之比为5:1 D、第⑤步反应的离子方程式为:
A、除去粗盐中的Ca2+、Mg2+、 , 加入试剂的顺序是:Na2CO3→NaOH→BaCl2→过滤后加盐酸 B、步骤②在工业生产中常选用石灰乳作Mg2+的沉淀剂 C、第④步反应中氧化产物与还原产物的物质的量之比为5:1 D、第⑤步反应的离子方程式为:二、综合题
-
21.(1)、A、红磷与白磷 B、蔗糖与麦芽糖 C、
 与
与 D、与
E、环氧乙烷(
D、与
E、环氧乙烷( )与乙醛
F、与
G、与
)与乙醛
F、与
G、与
同位素___________。
I.从下列物质中选出合适组号填写在对应空格上。(2)、同系物。(3)、同分异构体。(4)、同一物质。(5)、II.已知:a是元素周期表中半径最小的元素,b是短周期中金属性最强的元素:下图是部分短周期元素在周期表中的位置,且g元素的最高正价与最低负价之和为4。c
d
e
f
g
h
c处于周期表的第周期族;g的简单阴离子的结构示意图为。
(6)、a、d、h形成的常见离子化合物的电子式为。(7)、用电子式表示b、h形成化合物的过程。(8)、d、e、h元素对应的简单离子半径由小到大的顺序是(用离子符号表示)。(9)、d的简单氢化物比f的简单氢化物的沸点高,原因是。(10)、写出e的单质与b的最高价氧化物对应的水化物反应的离子方程式。22. 石油是一种重要的化工原料。下图表示以石油为原料经过深加工合成聚丙烯、丙酸乙酯等物质的流程。
已知:I. (R表示烃基)
II. (R表示烃基)
回答下列问题:
(1)、石油是一种混合物,利用沸点不同从原油中分离出石蜡油的过程叫做。(2)、上述①~⑥的反应中属于取代反应的是(填序号);C、E中所含官能团的名称分别是、。(3)、反应③中可能会产生一种有机副产物,其结构简式为。(4)、丙烯分子中最多有个原子在同一个平面内;若要鉴别丙烯与A,可选用的试剂是。(5)、写出下列反应的化学方程式:a.CH2=CHCH3→聚丙烯:;
b.C+G→丙酸乙酯:。
(6)、写出符合下列条件的丙酸乙酯的所有同分异构体。a.能与NaHCO3溶液反应放出CO2 b.分子结构中仅含2个甲基
23. 磺酰氯(化学式为SO2Cl2)是一种重要的有机合成试剂,实验室常用SO2和Cl2在活性炭作催化剂的条件下合成SO2Cl2. , 某兴趣小组拟利用下图所示装置制取少量磺酰氯。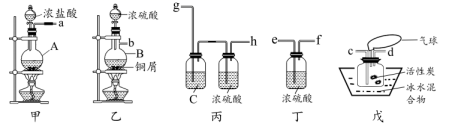
查阅资料:
I.磺酰氯遇水会发生水解反应,生成两种强酸:一种含氧酸、一种无氧酸。
II.磺酰氯在室温下较稳定,但在100℃以上时便会分解产成SO2和Cl2。
III.磺酰氯的熔点℃、沸点69.1℃;H2SO4的熔点10.4℃、沸点338℃,不易分解。
回答下列问题:
(1)、磺酰氯中硫元素的化合价为价;仪器B的名称是。(2)、图甲A中的黑色固体是(填化学式);图乙B中发生反应的化学方程式为。(3)、装置的组装顺序是a→→→ , b→→→:仪器组装完毕后,进行实验前要先。(4)、C中的试剂为。戊中“气球”的作用是。(5)、若缺少装置丙和丁,戊中所得产物反应的化学方程式为。(6)、磺酰氯也可用氯磺酸(ClSO3H)分解获得,反应原理为:。①要从产物(假定氯磺酸已分解完全,下同)中获得纯净的磺酰氯,可采用的方法是;
②请设计实验证明该方法获得的产物中含有H2SO4:(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)。
24. 卤块的主要成分是MgCl2 , 此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
已知:I.氢氧化亚铁呈絮状。
II.右表是25℃时生成氢氧化物沉淀对应的pH。
离子
开始沉淀的pH
完全沉淀的pH
Fe2+
7.6
9.6
Fe3+
2.7
3.7
Mn2+
8.3
9.8
Mg2+
9.6
11.1
回答下列问题:
(1)、溶解时要先将卤块粉碎,其目的是。(2)、加入双氧水的目的是;不能用酸性KMnO4溶液代替双氧水的原因是。(3)、“除杂”时,溶液pH至少应调至;滤渣A的主要成分是。(4)、“沉镁”的主要反应的离子方程式为;“煮沸”时产生气体的化学方程式为。(5)、“操作a”包括过滤、洗涤沉淀等操作。若要检测“洗涤沉淀”是否完成,其方法是(包括操作、现象、结论)。(6)、若该工艺中用285t卤块(含MgCl290%)为原料,制得102.6t轻质氧化镁,则MgO的产率为。