安徽省芜湖市2020-2021学年高一下学期期末质量检测联考化学试题
试卷更新日期:2021-12-31 类型:期末考试
一、单选题
-
1. 2020年9月22日,中国国家主席习近平在第七十五届联合国大会上发表重要讲话指出,中国将力争于2030年前实现碳达峰,2060年前实现碳中和。“碳中和”是指CO2的排放总量和减少总量相当。下列说法中错误的是( )
 A、通过清洁煤技术减少煤燃烧污染 B、开发核能、太阳能、风能等新能源,减少对矿物能源的依赖 C、鼓励农村居民燃烧农作物秸秆用于做饭、冬季取暖 D、大力发展电动汽车、氢燃料电池汽车等新能源汽车2. 在电影《我和我的祖国》中有一场景是修复国旗旗杆上的不锈钢阻断球。不锈钢是常见的合金。关于合金,下列说法错误的是( )A、多数合金熔点低于其组分中任意一种组成金属的熔点 B、我国使用最早的合金是铁合金 C、钠钾合金是原子反应堆的导热剂 D、目前世界上使用量最大的合金是铁碳合金3. 下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )A、加热氧化铝 B、加热氧化汞 C、电解熔融氯化钠 D、氢气还原氧化铁4. 简单原子的原子结构可用下图形象的表示:其中●表示质子或电子,O表示中子,则下列有关的叙述正确的是( )
A、通过清洁煤技术减少煤燃烧污染 B、开发核能、太阳能、风能等新能源,减少对矿物能源的依赖 C、鼓励农村居民燃烧农作物秸秆用于做饭、冬季取暖 D、大力发展电动汽车、氢燃料电池汽车等新能源汽车2. 在电影《我和我的祖国》中有一场景是修复国旗旗杆上的不锈钢阻断球。不锈钢是常见的合金。关于合金,下列说法错误的是( )A、多数合金熔点低于其组分中任意一种组成金属的熔点 B、我国使用最早的合金是铁合金 C、钠钾合金是原子反应堆的导热剂 D、目前世界上使用量最大的合金是铁碳合金3. 下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )A、加热氧化铝 B、加热氧化汞 C、电解熔融氯化钠 D、氢气还原氧化铁4. 简单原子的原子结构可用下图形象的表示:其中●表示质子或电子,O表示中子,则下列有关的叙述正确的是( ) A、①②③是三种化学性质不同的粒子。 B、①②③具有相同的质量数. C、①②③为同素异形体 D、①②③互为同位素5. 元素周期表中的金属和非金属元素的分界线处用虚线表示。下列说法正确的是( )
A、①②③是三种化学性质不同的粒子。 B、①②③具有相同的质量数. C、①②③为同素异形体 D、①②③互为同位素5. 元素周期表中的金属和非金属元素的分界线处用虚线表示。下列说法正确的是( ) A、元素周期表中最右上角的氦元素是得电子能力最强的元素 B、紧靠虚线两侧的元素都是两性金属元素 C、可在虚线附近寻找半导体材料(如Ge、Si等) D、可在虚线的右上方寻找耐高温材料6. 下列事实不能用元素周期律解释的是( )A、酸性:H2SO3>H2CO3 B、还原性:S2->Cl- C、气态氢化物的稳定性:H2O>NH3 D、Cl2从KBr溶液中置换出Br27. X、Y、Z、W 是原子序数依次增大的不同主族的短周期元素,X、Y 的简单离子的核外电子数相同,Y 的原子半径是短周期主族元素原子中最大的,Z原子最外层电子数是K 层的3 倍。下列说法正确的是( )A、简单离子半径:Y>Z B、X 只能形成HXO3型的酸 C、气态氢化物的热稳定性:W D、Y与Z、W都能形成离子化合物8. 二氧化硅是酸性氧化物,纯净的天然二氧化硅晶体,是一种坚硬、脆性、不溶的无色透明的固体,常用于制造光学仪器等。在一定条件下,下列物质不能与二氧化硅反应的是( )
A、元素周期表中最右上角的氦元素是得电子能力最强的元素 B、紧靠虚线两侧的元素都是两性金属元素 C、可在虚线附近寻找半导体材料(如Ge、Si等) D、可在虚线的右上方寻找耐高温材料6. 下列事实不能用元素周期律解释的是( )A、酸性:H2SO3>H2CO3 B、还原性:S2->Cl- C、气态氢化物的稳定性:H2O>NH3 D、Cl2从KBr溶液中置换出Br27. X、Y、Z、W 是原子序数依次增大的不同主族的短周期元素,X、Y 的简单离子的核外电子数相同,Y 的原子半径是短周期主族元素原子中最大的,Z原子最外层电子数是K 层的3 倍。下列说法正确的是( )A、简单离子半径:Y>Z B、X 只能形成HXO3型的酸 C、气态氢化物的热稳定性:W D、Y与Z、W都能形成离子化合物8. 二氧化硅是酸性氧化物,纯净的天然二氧化硅晶体,是一种坚硬、脆性、不溶的无色透明的固体,常用于制造光学仪器等。在一定条件下,下列物质不能与二氧化硅反应的是( )①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦氧化钙 ⑧氮气
A、③⑤⑦⑧ B、⑤⑦⑧ C、⑤⑧ D、⑤⑦9. 一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质混合并发生反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )A、浓硫酸与水 B、生石灰与水 C、熟石灰与水 D、碳粉与水10. 下列各组反应(表中物质均为反应物)在反应刚开始时,放出H2的速率最大的是( )选项
金属(粉末状)及其物质的量/mol
酸的浓度及体积
反应温度/℃
A
Mg 0.1
6mol·L-1硝酸 10mL
30
B
Mg 0.1
3mol·L-1盐酸 10mL
30
C
Fe 0.1
3mol·L-1盐酸 10mL
30
D
Mg 0.1
3mol·L-1硫酸 10mL
30
A、A B、B C、C D、D11. “封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( ) A、加热时,①中上部汇集了NH4Cl固体 B、加热时,②中溶液变红,冷却后又都变为无色 C、加热时,③中溶液变红,冷却后红色褪去,体现SO2的还原性 D、三个“封管实验”中所发生的化学反应都是可逆反应12. 在检验的过程中,下列操作正确的是(提示:稀硝酸具有强氧化性,可将氧化为)( )A、先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有存在 B、先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有存在 C、先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有存在 D、先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有存在13. 下列有关实验操作、现象和解释或结论都正确的是( )
A、加热时,①中上部汇集了NH4Cl固体 B、加热时,②中溶液变红,冷却后又都变为无色 C、加热时,③中溶液变红,冷却后红色褪去,体现SO2的还原性 D、三个“封管实验”中所发生的化学反应都是可逆反应12. 在检验的过程中,下列操作正确的是(提示:稀硝酸具有强氧化性,可将氧化为)( )A、先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有存在 B、先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有存在 C、先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有存在 D、先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有存在13. 下列有关实验操作、现象和解释或结论都正确的是( )选项
操作
现象
解释或结论
A
过量的Fe粉中加入稀硝酸,充分反应后,滴加KSCN溶液
溶液呈红色
稀硝酸将Fe氧化为Fe3+
B
Al箔插入稀硝酸中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
C
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
D
向盛有某溶液的试管中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无
A、A B、B C、C D、D14. 下述实验中均有红棕色气体产生,对比分析所得结论错误的是( )


①
②
③
A、由①中的红棕色气体,推断产生的气体一定是混合气体 B、红棕色气体不能表明②中木炭与浓硝酸发生了反应 C、由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 D、③的气体产物中检测出 , 由此说明木炭一定与浓硝酸发生了反应15. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.12LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )A、60mL B、50mL C、45mL D、30mL16. NSR技术能降低柴油发动机在空气过量条件下NOx的排放,其工作原理如图所示。下列说法错误的是( ) A、降低NOx排放可以减少酸雨的形成 B、储存过程中NOx被氧化 C、还原过程中消耗1molBa(NO3)2转移的电子数为5NA(NA为阿伏加德罗常数的值) D、通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原17. 化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )A、
A、降低NOx排放可以减少酸雨的形成 B、储存过程中NOx被氧化 C、还原过程中消耗1molBa(NO3)2转移的电子数为5NA(NA为阿伏加德罗常数的值) D、通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原17. 化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )A、 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B、
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B、 正极的电极反应式为Ag2O+2e−+H2O=2Ag+2OH−
C、
正极的电极反应式为Ag2O+2e−+H2O=2Ag+2OH−
C、 锌筒作负极,发生氧化反应,锌筒会变薄
D、
锌筒作负极,发生氧化反应,锌筒会变薄
D、 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
18. 一定条件下,在体积为10L的固定容器中发生反应:N2(g)+3H2(g)⇌2NH3(g),反应过程如图:
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
18. 一定条件下,在体积为10L的固定容器中发生反应:N2(g)+3H2(g)⇌2NH3(g),反应过程如图:
下列说法正确的是( )
A、t1min时正、逆反应速率相等 B、X曲线表示NH3的物质的量随时间变化的关系 C、0~8min,H2的平均反应速率v(H2)=0.75mol·L-1·min-1 D、10~12min,N2的平均反应速率v(N2)=0.005mol·L-1·min-119. 在一定温度下的定容容器中,发生反应:2A(g)+B(s)C(g)+D(g),下列描述中能表明反应已达到平衡状态的是( )①混合气体的压强不变
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④C(g)的物质的量浓度不变
⑤容器内A,C,D三种气体的浓度之比为2:1:1
⑥单位时间内生成n molD,同时生成2n mol A
⑦单位时间内生成n molC,同时生成n mol D
A、①②③ B、②③④⑥ C、②③⑤⑥⑦ D、①③⑤⑦20. 某同学设计以下实验方案,从海带中提取I2。下列说法错误的是( ) A、操作①是过滤 B、含I2的溶液经3步转化为I2的悬浊液,其目的是富集 C、③的离子方程式是5I–+IO+6H+=3I2+3H2O D、②中双氧水作还原剂
A、操作①是过滤 B、含I2的溶液经3步转化为I2的悬浊液,其目的是富集 C、③的离子方程式是5I–+IO+6H+=3I2+3H2O D、②中双氧水作还原剂二、填空题
-
21. 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
 (1)、X的化学式是;从硫元素的化合价变化角度分析,图中Y与H2O2的反应时,Y体现了性(填“氧化”或“还原”);写出检验物质Y的一种方法是。(2)、Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为。(3)、Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是____(填字母)。A、Na2S+S B、Na2SO3+S C、SO2+Na2SO4 D、Na2SO3+Na2SO4(4)、已知Na2SO3能被K2Cr2O7氧化为Na2SO4 , 则24mL0.05mol·L-1的Na2SO3溶液与20mL0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为。22. 工业上制取硝酸铵的流程图如图,请回答下列问题:
(1)、X的化学式是;从硫元素的化合价变化角度分析,图中Y与H2O2的反应时,Y体现了性(填“氧化”或“还原”);写出检验物质Y的一种方法是。(2)、Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为。(3)、Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是____(填字母)。A、Na2S+S B、Na2SO3+S C、SO2+Na2SO4 D、Na2SO3+Na2SO4(4)、已知Na2SO3能被K2Cr2O7氧化为Na2SO4 , 则24mL0.05mol·L-1的Na2SO3溶液与20mL0.02mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为。22. 工业上制取硝酸铵的流程图如图,请回答下列问题: (1)、在工业制硝酸的生产中,B中发生反应的化学方程式为:。(2)、在合成硝酸的吸收塔中通入空气的目的是:。(3)、生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
(1)、在工业制硝酸的生产中,B中发生反应的化学方程式为:。(2)、在合成硝酸的吸收塔中通入空气的目的是:。(3)、生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:碱液吸收法:NO+NO2+2NaOH2NaNO2+H2O
NH3还原法: NH3+ NO2 N2+ H2O
①配平NH3还原法的化学方程式。
②以上两种方法中,符合绿色化学的是。
③某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的百分比含量为(计算结果精确到0.1)。
23.(1)、I.已知Na2S2O3与硫酸的反应为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某研究小组为研究外界条件对化学反应速率的影响,设计实验如下,请回答下列问题。
根据“控制变量”的原则,实验①②研究的是对化学反应速率的影响。实验序号 反应温度 加入0.1mol/LNa2S2O3溶液 加入0.1mol/LH2SO4溶液 加入水的体积 出现浑浊的时间 ① 20℃ 2mL 2mL 0 t1s ② 40℃ 2mL V1mL 0 t2s ③ 20℃ 1mL 2mL V2mL t3s (2)、V2=。(3)、t1、t2、t3由大到小的顺序是。(4)、II.炼铁高炉中存在可逆反应Fe(s)+CO2(g)⇌FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。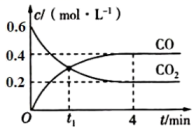
t1时,正反应速率(填“>“”<”或“=”)逆反应速率。
(5)、0~4min时间段内,v(CO)=mol·L-1·min-1。反应达最大限度时,体系内混合气体的平均相对分子质量是(计算结果精确到0.1)。(6)、下列条件的改变能减慢其反应速率的是。a.降低温度
b.减少铁粉的质量
c.保持压强不变,充入He使容器的体积增大
d.保持体积不变,充入He使体系压强增大
三、综合题
-
24. 某兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下系列实验,实验结果记录如下:
编号
电极材料
电解质溶液
电流计指针偏转方向
1
Mg、Al
稀盐酸
偏向Al
2
Al、Cu
稀盐酸
偏向Cu
3
Al、C(石墨)
稀盐酸
偏向石墨
4
Mg、Al
NaOH溶液
偏向Mg
5
Al、Cu
浓硝酸
偏向Al
注:①实验均为常温下完成;②电流计指针偏转方向为正极方向。试根据表中实验现象完成下列问题:
(1)、实验1、2中Al电极的作用(填“相同”或“不同”)。(2)、实验3中,Al为极,电极反应式为。(3)、实验4中,Al为极,电池总反应的离子方程式是。(4)、解释实验5中电流计偏向Al的原因。(5)、根据实验结果总结出影响铝在电池中做正极或负极的因素有。