黑龙江省齐齐哈尔市2020-2021学年高二下学期期末考试化学试题
试卷更新日期:2021-12-31 类型:期末考试
一、单选题
-
1. 分离乙醇和水,需要用到的仪器是( )A、
 B、
B、 C、
C、 D、
D、 2. 用下列图示实验装置进行实验,能达到相应实验目的的是( )
2. 用下列图示实验装置进行实验,能达到相应实验目的的是( )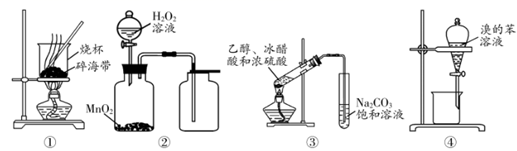 A、用图①所示装置灼烧碎海带 B、用图②所示装置制取并收集O2 C、用图③所示装置制取乙酸乙酯 D、用图④所示装置分离溴和苯3. 下列除杂过程中,所选用的试剂和操作方法正确的是( )
A、用图①所示装置灼烧碎海带 B、用图②所示装置制取并收集O2 C、用图③所示装置制取乙酸乙酯 D、用图④所示装置分离溴和苯3. 下列除杂过程中,所选用的试剂和操作方法正确的是( )选项
物质
杂质(少量)
试剂和操作方法
A
氯化钾固体
氯酸钾
加入二氧化锰并加热
B
硫酸亚铁溶液
硫酸铁
加入过量的铁粉后过滤
C
氯化氢
二氧化碳
通过饱和 溶液
D
硝酸钠溶液
硝酸钡溶液
加入适量的硫酸钾溶液后过滤
A、A B、B C、C D、D4. 实验室需要 的硫酸溶液,现用市售98%浓硫酸(密度为 )配制,用量筒取用的浓硫酸体积最适宜的是( )A、 B、 C、 D、5. 把 含有 和 的混合溶液分成两等份,一份加入含 的溶液,恰好使镁离子沉淀完全;另一份加入含 的溶液,恰好使硫酸根离子沉淀完全。则原混合溶液中钾离子的浓度为( )A、 B、 C、 D、6. 设 表示阿伏加德罗常数的值,下列说法正确的是( )A、 和 的混合物中,所含原子总数为 B、足量的 与 反应转移电子数为 C、 溶液中含 数目为 D、 中含中子数为7. “春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是( )A、蚕丝的主要成分是蛋白质 B、蚕丝属于天然高分子材料 C、“蜡炬成灰”过程中发生了氧化反应 D、古代的蜡是高级脂肪酸酯,属于高分子聚合物8. 磁流体是电子材料的新秀。在一定条件下,将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,可得到分散质粒子大小在36-55nm之间的黑色磁流体。下列说法中正确的( )A、所得的分散系属于悬浊液 B、用一束光照射该分散系能产生丁达尔效应 C、所得的分散系中分散质为Fe2O3 , 不能透过滤纸 D、分散系为胶体,分散质粒子大小即Fe(OH)3分子直径大小9. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、 溶液中: 、 、 、 B、无色透明的溶液中: 、 、 、 C、使酚酞变红的溶液中: 、 、 、 D、 的溶液: 、 、 ,10. 已知下列四个反应:①
②
③
④
下列说法正确的是( )
A、反应①②③④中的氧化产物依次是 、 、 、 B、氧化性: C、根据反应①可以推理得到 D、在反应③中,当有 参加反应时,有 被氧化11. 亚氯酸钠( )是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
下列说法错误的是( )
A、反应①阶段,参加反应的 和 的物质的量之比为 B、若反应①通过原电池来实现,则 是正极产物 C、反应②中的 可用 代替 D、反应②条件下, 的氧化性大于12. 对于下列实验,能正确描述其反应的离子方程式是( )A、用Na2SO3溶液吸收少量Cl2: B、向CaCl2溶液中通入CO2: C、向H2O2溶液中滴加少量FeCl3: D、同浓度同体积NH4HSO4溶液与NaOH溶液混合:13. 在给定条件下,下列选项中的物质转化关系一定不能实现的是( )A、饱和NaCl(aq) NaHCO3(s) Na2CO3(s) B、MnO2 Cl2(g) FeCl3(s) C、SiO2(s) SiCl4(g) Si(s) D、NH3(g) NO(g) HNO3(aq)14. 将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2 , 红色也褪去。以下推测肯定错误的是( )A、①中红色褪去的原因是KMnO4将SCN-氧化 B、②中红色褪去的原因是SO2将Fe3+还原成Fe2+ C、②中红色褪去的原因是SO2将SCN-还原 D、SCN-在适当条件下可失去电子被氧化为(SCN)215. 铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法错误的是 ( ) A、通过调节分液漏斗的活塞以控制①中气泡产生快慢 B、装置①的作用是干燥氢气 C、装置②、③中的药品分别是无水硫酸铜、碱石灰 D、加热装置Y前,应先让X反应一段时间,排除装置中的空气16. 过氧乙酸(CH3COOOH)是“抗非典”的主要消毒剂,也能将新型冠状病毒杀死,可由乙酸和H2O2反应制得。下列说法错误的是( )A、过氧乙酸能杀灭病毒的主要原因是其具有强氧化性而使病毒变性 B、过氧乙酸不稳定,易分解,保存时应避光,低温保存 C、过氧乙酸属于有机物,故属于非电解质 D、制备过氧乙酸时不应在金属容器中进行且不可用于金属器械的消毒17. 向500 mL稀硝酸中加入一定量的铁粉,铁粉完全溶解后,放出NO 6.272L(标准状况下),同时溶液质量增加11.2g。下列判断错误的是( )A、原HNO3溶液的物质的量浓度为2.24 mol·L-1 B、原溶液中投入铁粉的物质的量是0.2 mol C、反应后溶液中c(Fe3+):c(Fe2+)=2:3 D、反应后的溶液还可以溶解铜粉4.48g18. 某含H+浓度为0.5mol/L的溶液X100mL,其余可能含有Na+、Al3+、NH 、Fe2+、Fe3+、SO 、SO 、Cl-、NO 中的一种或几种。现将该溶液进行连续实验,实验过程如图:
A、通过调节分液漏斗的活塞以控制①中气泡产生快慢 B、装置①的作用是干燥氢气 C、装置②、③中的药品分别是无水硫酸铜、碱石灰 D、加热装置Y前,应先让X反应一段时间,排除装置中的空气16. 过氧乙酸(CH3COOOH)是“抗非典”的主要消毒剂,也能将新型冠状病毒杀死,可由乙酸和H2O2反应制得。下列说法错误的是( )A、过氧乙酸能杀灭病毒的主要原因是其具有强氧化性而使病毒变性 B、过氧乙酸不稳定,易分解,保存时应避光,低温保存 C、过氧乙酸属于有机物,故属于非电解质 D、制备过氧乙酸时不应在金属容器中进行且不可用于金属器械的消毒17. 向500 mL稀硝酸中加入一定量的铁粉,铁粉完全溶解后,放出NO 6.272L(标准状况下),同时溶液质量增加11.2g。下列判断错误的是( )A、原HNO3溶液的物质的量浓度为2.24 mol·L-1 B、原溶液中投入铁粉的物质的量是0.2 mol C、反应后溶液中c(Fe3+):c(Fe2+)=2:3 D、反应后的溶液还可以溶解铜粉4.48g18. 某含H+浓度为0.5mol/L的溶液X100mL,其余可能含有Na+、Al3+、NH 、Fe2+、Fe3+、SO 、SO 、Cl-、NO 中的一种或几种。现将该溶液进行连续实验,实验过程如图:
下列说法正确的是( )
A、溶液中一定不含NO ;而Fe2+、SO 则至少含一种 B、溶液中可能含Na+ , 可取少量溶液F进行焰色反应加以确定 C、溶液F加入CO2产生白色沉淀,可推测溶液X中一定含Al3+ D、溶液X中一定含Cl- , 且n(Cl-)≥0.02mol19. 氨硼烷(NH3·BH3)是一种颇具潜力的固体储氢材料,具有较高的稳定性和环境友好性。下列关于氨硼烷的说法错误的是( )A、氨硼烷结构与乙烷相似,固态时均为分子晶体 B、氨硼烷与水分子间可形成氢键,故易溶于水 C、分子中N原子的第一电离能小于B原子 D、分子中由N原子提供孤电子对与B原子形成配位键20. 缺电子化合物是指电子数不符合路易斯结构(一个原子通过共用电子使其价电子数达到8、H原子达到2所形成的稳定分子结构)要求的类化合物。下列说法错误的是( )A、 、 、 中只有 是缺电子化合物 B、 、 的中心原子的杂化方式分别为 、 C、 是非极性分子 D、 的键角小于21. 根据如图几种晶体结构,下列说法中错误的是( ) A、钛酸钙的化学式为 B、在金刚石晶体中,碳原子与碳碳键( )数目之比为 C、硒化锌晶体中与一个 距离最近且相等的 有8个 D、 中 与距离最近的 所形成的键的夹角为22. 香豆素-3-羧酸是日用化学工业中重要香料之一,它可以通过水杨醛经多步反应合成:
A、钛酸钙的化学式为 B、在金刚石晶体中,碳原子与碳碳键( )数目之比为 C、硒化锌晶体中与一个 距离最近且相等的 有8个 D、 中 与距离最近的 所形成的键的夹角为22. 香豆素-3-羧酸是日用化学工业中重要香料之一,它可以通过水杨醛经多步反应合成: 下列说法正确的是( )A、 水杨醛最多能与 发生加成反应 B、可用酸性高锰酸钾溶液检验中间体A中是否混有水杨醛 C、 香豆素-3-羧酸最多能与 发生反应 D、中间体A、香豆素-3-羧酸互为同系物23. 茚地那韦被用于新型冠状病毒肺炎的治疗,其结构简式如图所示(未画出其空间结构)。
下列说法正确的是( )A、 水杨醛最多能与 发生加成反应 B、可用酸性高锰酸钾溶液检验中间体A中是否混有水杨醛 C、 香豆素-3-羧酸最多能与 发生反应 D、中间体A、香豆素-3-羧酸互为同系物23. 茚地那韦被用于新型冠状病毒肺炎的治疗,其结构简式如图所示(未画出其空间结构)。
下列说法正确的是( )
A、茚地那韦属于芳香族化合物,易溶于水 B、虚线框内的所有碳、氧原子均处于同一平面 C、茚地那韦可与氯化铁溶液发生显色反应 D、茚地那韦在碱性条件下完全水解,最终可生成三种有机物24. 分子式为 的有机物,其结构中含有苯环且可以与饱和 溶液反应放出气体的同分异构体(不考虑立体异构)有( )A、11种 B、12种 C、13种 D、14种二、综合题
-
25. 醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:
 (1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 , 仪器a的名称是。(2)、将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2 , 关闭K3。
(1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 , 仪器a的名称是。(2)、将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2 , 关闭K3。①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为。
②同时c中有气体产生,该气体的作用是。
(3)、打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是、、洗涤、干燥。(4)、指出装置d可能存在的缺点。26. 一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)、步骤①混合研磨成细粉的主要目的是;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为。(2)、步骤③所得酸性滤液可能含有Fe2+ , 为了除去Fe2+可先加入;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4-5,再继续煮沸一段时间,“继续煮沸”的目的是。步骤⑤所得滤渣为(填化学式)。(3)、步骤⑦需在90-100℃下进行,该反应的化学方程式。(4)、测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=。27. ⅡB-ⅥA化合物半导体纳米材料(如 、 、 、 )等在光电子器件、太阳能电池以及生物探针等方面有广阔前景。回答下列问题:(1)、砷元素基态原子价层电子排布式为:(2)、下列状态的锌,分别失去最外层一个电子所需能量最小的是___________。A、 B、
B、 C、
C、 D、
D、 (3)、雄黄( )如图1和雌黄( )如图2是提取砷的主要矿物原料,二者在自然界中共生。图1中 原子轨道杂化类型为。图2中 键角 键角(填 , 或 )。
(3)、雄黄( )如图1和雌黄( )如图2是提取砷的主要矿物原料,二者在自然界中共生。图1中 原子轨道杂化类型为。图2中 键角 键角(填 , 或 )。 (4)、 分子中 键数目有个,分子的空间构型为。分子中大 键可用符号 表示,其中m代表参与形成的大 键原子数,n代表参与形成大 键电子数(如苯分子中的 键可表示为 ,则 中大 键应表示为。(5)、 具有独特的电学及光学特性,是一种应用广泛的功能材料。
(4)、 分子中 键数目有个,分子的空间构型为。分子中大 键可用符号 表示,其中m代表参与形成的大 键原子数,n代表参与形成大 键电子数(如苯分子中的 键可表示为 ,则 中大 键应表示为。(5)、 具有独特的电学及光学特性,是一种应用广泛的功能材料。①已知 和O的电负性分别为1.65、3.5, 中化学键类型为 , 可以与 溶液溶解生成 ,请从化学键角度解释能形成该离子的原因。
②一种 晶体的晶胞(立方体)如图3所示, 为阿伏加德罗常数的值, 原子半径为 。图4是沿着立方格子对角面取得的截图,则 原子与O原子间最短距离x= 。晶体的密度为 (列出计算式即可)。
 28. 杂必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
28. 杂必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
已知:乙酸酐的结构简式为

请回答下列问题:
(1)、A的名称是;B中所含官能团的名称是。(2)、A与足量 溶液反应的化学方程式为 , 反应⑤的反应类型是。(3)、碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。则G分子中的手性碳原子个数为个(4)、写出满足下列条件的E的同分异构体的结构简式:、。Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ. 该物质与足量 溶液反应生成
(5)、根据已有知识并结合相关信息,将以 为原料制备
为原料制备  的合成路线流程,补充完整(无机试剂任选)合成路线流程图示例如下:
的合成路线流程,补充完整(无机试剂任选)合成路线流程图示例如下: 