陕西省商洛市2020-2021学年高二下学期期末教学质量检测化学试题
试卷更新日期:2021-12-27 类型:期末考试
一、单选题
-
1. 下列化学用语错误的是( )A、NaCl的电子式: B、CH4的球棍模型:
 C、乙烯的分子比例模型:
C、乙烯的分子比例模型: D、氮气的电子式:
2. 下列实验装置或操作不能达到相应实验目的的是( )
D、氮气的电子式:
2. 下列实验装置或操作不能达到相应实验目的的是( )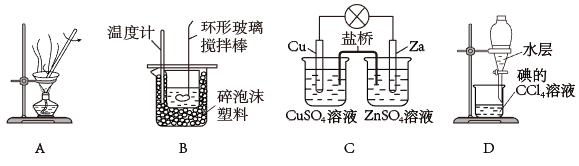 A、图A是蒸干硫酸铁溶液,得到无水硫酸铁 B、图B是中和热的测定 C、图C是验证化学能转化为电能 D、图D是CCl4萃取碘水中的碘的分离操作3. 为探究海水对钢铁的腐蚀,某兴趣小组设计了如下五种装置,铁片在这五种装置中的腐蚀速率由慢到快的顺序为( )
A、图A是蒸干硫酸铁溶液,得到无水硫酸铁 B、图B是中和热的测定 C、图C是验证化学能转化为电能 D、图D是CCl4萃取碘水中的碘的分离操作3. 为探究海水对钢铁的腐蚀,某兴趣小组设计了如下五种装置,铁片在这五种装置中的腐蚀速率由慢到快的顺序为( )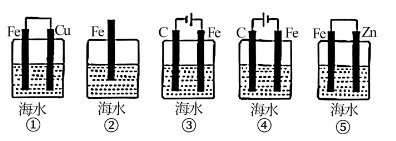 A、①⑤④③② B、③①②①⑤ C、④③①⑤② D、④⑤②①③。4. 某吸水性高分子化合物(Z)的一种合成路线如下:
A、①⑤④③② B、③①②①⑤ C、④③①⑤② D、④⑤②①③。4. 某吸水性高分子化合物(Z)的一种合成路线如下:
下列说法错误的是( )
A、X、Y、Z均为纯净物 B、Y中至少有7个碳原子共面 C、X、Y、Z均能发生酯化反应 D、一定条件下,X、Y、Z都能与H2发生加成反应5. 类推是学习化学的一种重要方法,下列类推一定正确的是( )A、碳酸钙受热分解为吸热反应,故分解反应均为吸热反应 B、室温下, 的 溶液的 ,故 的 溶液的 C、 溶液呈中性,故 溶液也呈中性 D、工业上通过电解熔融的 获得金属 ,故也可以通过电解熔融的 获得金属6. 短周期主族元素W、X、Y、Z在元素周期表中的相对位置如图所示,其中Z元素所形成的一种固体单质为黄色,且在空气中燃烧后生成一种可形成酸雨的气体。下列说法错误的是( )W
X
Y
Z
A、原子半径: Y>Z>W>X B、X、Y、Z、W中非金属性最强的是X C、Y、Z的常见单质均为固体 D、X、W、Y元素形成的氢化物的水溶液都是强酸7. 某温度时,向容积为1L的恒容密闭容器中加入1.8mol , 发生反应:。其中的物质的量浓度随时间的变化曲线如图所示。下列说法正确的是( ) A、从反应开始到刚达到平衡的时间内, B、其他条件不变。将容器容积改为0.5L,反应达到平衡后, C、该温度下,该反应的平衡常数K=1 D、a、b两时刻生成X的速率:8. 某期刊中有文献报道,CO2可以在酸性水溶液中用惰性电极电解制得乙烯 , 其工作原理如图所示,下列说法正确的是( )
A、从反应开始到刚达到平衡的时间内, B、其他条件不变。将容器容积改为0.5L,反应达到平衡后, C、该温度下,该反应的平衡常数K=1 D、a、b两时刻生成X的速率:8. 某期刊中有文献报道,CO2可以在酸性水溶液中用惰性电极电解制得乙烯 , 其工作原理如图所示,下列说法正确的是( ) A、电池工作时,电极a上发生还原反应 B、电池工作时,H+通过质子交换膜移向b极 C、d一定为氧气 D、电路中每转移0.3mol电子时,产生0.56L乙烯9. 25℃时,用的NaOH溶液,分别滴定20mL、浓度均为的两种酸HX、HY。所加NaOH溶液的体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
A、电池工作时,电极a上发生还原反应 B、电池工作时,H+通过质子交换膜移向b极 C、d一定为氧气 D、电路中每转移0.3mol电子时,产生0.56L乙烯9. 25℃时,用的NaOH溶液,分别滴定20mL、浓度均为的两种酸HX、HY。所加NaOH溶液的体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( ) A、酸性:HX<HY B、分别向两种溶液中加入20mLNaOH溶液时,两种溶液的pH均为7 C、溶液中水的电离程度:a点>b点 D、b点溶液中,
A、酸性:HX<HY B、分别向两种溶液中加入20mLNaOH溶液时,两种溶液的pH均为7 C、溶液中水的电离程度:a点>b点 D、b点溶液中,二、综合题
-
10. Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中可稳定存在。
I.制备
反应原理:
实验步骤:
①称取mgNa2SO3加入仪器a中,再加入一定量的蒸馏水。另取ng研细的硫粉,用无水乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置已略去),沸水浴恒温反应60min。

③趁热过滤,将滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,得到产品。
Ⅱ.测定产品纯度
准确称取0.3g产品(杂质不参与反应),用一定量的蒸馏水溶解,用的酸性高锰酸钾标准溶液进行滴定,发生的反应为。
回答下列问题:
(1)、仪器a的名称是 , 仪器d的进水口是(填标号)。(2)、Na2S2O3在酸性条件下不能稳定存在,用离子方程式表示其原因: , 每生成1mol黄色固体,转移的电子数为。(3)、①实验Ⅱ中滴定达到终点的标志是。②滴定起始和终点的液面位置如图,则消耗酸性高锰酸钾标准溶液的体积为mL。

③产品的纯度为(保留三位有效数字)%。
(4)、还原性较强,常用作脱氯剂,在溶液中易被Cl2氧化成 , 检验与Cl2反应后的溶液中是否存在的方法为。11. 镍是一种常用的催化剂。以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,制取纳米镍粉,同时获得净水剂黄钠铁矾的工艺流程如下:
回答下列问题:
(1)、黄钠铁矾中,铁的化合价为价;黄钠铁矾能净水的原因是。(2)、过滤操作时要遵循“一贴、二低、三靠”的原则,其中“二低”指的是滤纸边缘略低于漏斗口、。(3)、“沉铁”过程加入Na2CO3的目的是 , 控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在120℃时进行,加入的Na2CO3偏多,则所得黄钠铁矾中混有的杂质是(填化学式);检验沉铁反应是否完全的方法是。 (4)、“转化”过程,向“过滤II”所得滤液(富含Ni2+)中加入N2H4 , 控制溶液中NaOH的浓度,可得到不同晶态物质(、Ni或二者的混合物)。当生成和Ni的物质的量之比为1:2时,该反应的离子方程式为;在其他条件不变的情况下,随NaOH浓度增大,产物中Ni的含量增加,原因是。(5)、化学镀镍是金属表面镀镍的常用方法,以NiSO4为镀液,次亚磷酸钠(NaH2PO2)为还原剂,在90℃的酸性溶液中发生反应,NaH2PO2被氧化为亚磷酸(H3PO3)。写出化学镀镍反应的离子方程式:。12. 羰基硫(COS)是硫循环的重要中间体其在催化剂作用下与或反应的热化学方程式如下;
(4)、“转化”过程,向“过滤II”所得滤液(富含Ni2+)中加入N2H4 , 控制溶液中NaOH的浓度,可得到不同晶态物质(、Ni或二者的混合物)。当生成和Ni的物质的量之比为1:2时,该反应的离子方程式为;在其他条件不变的情况下,随NaOH浓度增大,产物中Ni的含量增加,原因是。(5)、化学镀镍是金属表面镀镍的常用方法,以NiSO4为镀液,次亚磷酸钠(NaH2PO2)为还原剂,在90℃的酸性溶液中发生反应,NaH2PO2被氧化为亚磷酸(H3PO3)。写出化学镀镍反应的离子方程式:。12. 羰基硫(COS)是硫循环的重要中间体其在催化剂作用下与或反应的热化学方程式如下;Ⅰ.
Ⅱ.
回答下列问题:
(1)、写出与反应的热化学方程式:。(2)、已知反应Ⅰ中相关的化学键键能数据如下:化学健
1076
742
577
339
表中。
(3)、某温度下,向容积为2L的恒容密闭容器中通入0.2mol和0.4mol , 发生反应Ⅰ,经过一段时间后反应达到平衡。①起始时,。
②该温度下,上述反应的平衡常数(填表达式)。
③只改变一种条件,使上述反应中COS的平衡转化率增大的措施有。
(4)、在两个恒压密闭容器中分别均充入等物质的量的与发生反应Ⅱ。 的平衡转化率与温度的关系如图所示。
①a、c点对应的平衡常数:(填“>”、“<”或“=”,下同)。
②b点与c点的速率关系为。
(5)、在绝热恒容密闭容器中进行反应Ⅱ。下列能说明反应Ⅱ已达到平衡状态的是____(填标号)。A、容器中混合气体密度保持不变 B、容器内的总压强不变 C、保持不变 D、容器中混合气体的平均摩尔质量保持不变13. 第ⅣA族元素及其化合物是结构化学研究的热点。几种晶体结构如图所示: (1)、基态锗(Ge)的核外电子排布式为。(2)、上述四种晶体中,熔点最低的是填名称),金刚石中碳原子之间含有的作用力是(填“σ键”、“π键”或“σ健和π键”)。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、与碳同周期的主族元素中,第一电离能最大的是(填元素符号,下同),电负性最小的是。(5)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为3∶2的分子的结构简式为(写一种)。(6)、硅晶体结构类似于金刚石(如图甲),则1mol硅晶体中含mol共价键,在干冰(如图乙)晶体中,与二氧化碳分子最近的二氧化碳分子的数目为。(7)、设为阿伏加德罗常数的值,已知干冰的晶胞参数为pm,则干冰的密度为(用含和的代数式表示)。14. G是一种新型香料的主要成分之一,其结构中含有三个六元环。G的合成路线(部分产物和部分反应条件已略去)如下:
(1)、基态锗(Ge)的核外电子排布式为。(2)、上述四种晶体中,熔点最低的是填名称),金刚石中碳原子之间含有的作用力是(填“σ键”、“π键”或“σ健和π键”)。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、与碳同周期的主族元素中,第一电离能最大的是(填元素符号,下同),电负性最小的是。(5)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为3∶2的分子的结构简式为(写一种)。(6)、硅晶体结构类似于金刚石(如图甲),则1mol硅晶体中含mol共价键,在干冰(如图乙)晶体中,与二氧化碳分子最近的二氧化碳分子的数目为。(7)、设为阿伏加德罗常数的值,已知干冰的晶胞参数为pm,则干冰的密度为(用含和的代数式表示)。14. G是一种新型香料的主要成分之一,其结构中含有三个六元环。G的合成路线(部分产物和部分反应条件已略去)如下:
已知:
①;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子;
③D和F是同系物。
请回答下列问题:
(1)、(CH3)2C=CH2的化学名称为。(2)、写出反应④的化学方程式:。(3)、G的合成路线中,属于氧化反应的有个,D分子中官能团的名称为。(4)、同时满足下列条件的F的同分异构体有种。①苯环上有两个取代基;②有羟基且能发生银镜反应;③可以发生水解反应。
其中能与溶液发生显色反应,且核磁共振氢谱有5组峰的结构简式为。
(5)、已知: +
+
 。参照上述合成路线和信息,设计由
。参照上述合成路线和信息,设计由 制取
制取 的合成路线 (无机试剂及有机溶剂任选)。
的合成路线 (无机试剂及有机溶剂任选)。