陕西省汉中市2020~2021学年下学期期末校级联考高一化学试题
试卷更新日期:2021-12-27 类型:期末考试
一、单选题
-
1. 在“绿色化学”工艺中,理想的状态是反应物中的原子全部转化为期望的最终产物,即原子的利用率为100%。下列反应类型中原子利用率不能达到100%的是( )A、化合反应 B、加聚反应 C、取代反应 D、加成反应2. 铝热反应有广泛的用途,实验装置如图1所示。下列说法错误的是( )
 A、铝热反应的能量变化可用图2表示 B、工业上可以利用铝热反应的方法冶炼金属镁 C、该实验的现象为火星四溅,漏斗下方有红热熔融物流出 D、铝热反应可用于焊接铁轨,反应的化学方程式为3. 分子式为 , 且分子中含有两个、两个、一个
A、铝热反应的能量变化可用图2表示 B、工业上可以利用铝热反应的方法冶炼金属镁 C、该实验的现象为火星四溅,漏斗下方有红热熔融物流出 D、铝热反应可用于焊接铁轨,反应的化学方程式为3. 分子式为 , 且分子中含有两个、两个、一个 和一个-Cl的结构有( ) A、3种 B、4种 C、5种 D、6种4. 1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一、如图是元素周期表的一部分,下列说法正确的是( )
和一个-Cl的结构有( ) A、3种 B、4种 C、5种 D、6种4. 1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一、如图是元素周期表的一部分,下列说法正确的是( ) A、氢化物的还原性: B、最高价氧化物对应水化物的酸性: C、Bi的最高价氧化物为 D、阴影部分元素中,简单氢化物稳定性最强的是At5. 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假设氯气在水中的溶解度可以忽略。将该装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。下列说法错误的是( )
A、氢化物的还原性: B、最高价氧化物对应水化物的酸性: C、Bi的最高价氧化物为 D、阴影部分元素中,简单氢化物稳定性最强的是At5. 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假设氯气在水中的溶解度可以忽略。将该装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。下列说法错误的是( )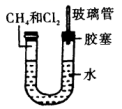 A、经过几个小时的反应后,U形管右端的液面会降低 B、若水中含有 , 则在U形管左端会观察到有白色胶状沉淀生成 C、若最终无甲烷剩余,且生成了等物质的量的四种有机取代物,则氯气的转化率为62.5% D、若将U形管中的水换成饱和食盐水,则可看到有白色沉淀先产生后消失
A、经过几个小时的反应后,U形管右端的液面会降低 B、若水中含有 , 则在U形管左端会观察到有白色胶状沉淀生成 C、若最终无甲烷剩余,且生成了等物质的量的四种有机取代物,则氯气的转化率为62.5% D、若将U形管中的水换成饱和食盐水,则可看到有白色沉淀先产生后消失二、填空题
-
6. 我国在催化加氢制取汽油方面取得突破性进展,转化过程示意图如图所示:
 (1)、二氧化碳分子中的化学键是。(2)、图中有机物乙是汽油的主要成分之一,其名称为;有机物、、、、甲、乙均符合通式 , 则m与n的关系为。(3)、实验室常用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,反应过程中产生二氧化碳的体积(V)与时间(t)的关系如图所示:
(1)、二氧化碳分子中的化学键是。(2)、图中有机物乙是汽油的主要成分之一,其名称为;有机物、、、、甲、乙均符合通式 , 则m与n的关系为。(3)、实验室常用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,反应过程中产生二氧化碳的体积(V)与时间(t)的关系如图所示:
①由图象分析,化学反应速率最快的是(填字母)段。
②为了增大上述反应的速率,下列操作可行的是(填字母)。
a.加蒸馏水 b.加氯化钠溶液 c.加浓盐酸 d.加热
(4)、一定条件下,工业上也可用合成甲醇():。将与充入容积为0.5L的密闭容器中发生上述反应,时测得甲醇的物质的量为 , 则内的平均反应速率。7. 能量转化是化学变化的主要特征之一,按要求回答下列问题。(1)、页岩气是从页岩层中开采出来的天然气,成分以甲烷为主。下列有关页岩气的叙述错误的是____(填字母)。A、页岩气属于新能源 B、沼气、煤矿坑道气的主要成分与页岩气相同 C、甲烷中每个原子的最外层电子排布都达到8电子稳定结构 D、页岩气可以作燃料电池的负极燃料(2)、部分常见的电池装置如下:编号
a
b
c
d
电池装置

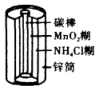


①上述四种电池中,属于二次电池的是(填字母,下同),属于干电池的是。
②a装置中,外电路中电子的流向是(填“从Zn流向Cu”或“从Cu流向Zn”)。
③c装置中,若将电解质改为碱性介质,则负极的电极反应式为。
(3)、氧化还原反应一般可以设计成原电池。若将反应设计成原电池,则:①该电池的电解质溶液可以是。
②当外电路中转移1mol电子时,电解质溶液的质量增加g。
三、综合题
-
8. 乙烯和苯是来自石油和煤的两种重要化工原料。(1)、下列物质中,不能通过乙烯发生加成反应得到的是____(填字母)。A、 B、 C、(2)、将苯加入到盛有少量酸性高锰酸钾溶液的试管中,振荡,酸性高锰酸钾溶液不褪色,说明苯分子中(填“有”或“没有”)碳碳双键。苯分子的空间构型为。(3)、一定条件下,乙烯和苯都能与溴发生反应。乙烯与溴发生反应的化学方程式为;苯与液溴在催化作用下发生的反应属于(填反应类型)。(4)、实验室制硝基苯的反应原理为(用化学方程式表示),在制备和纯化硝基苯的实验中,下列操作未涉及的是(填字母)。
A.
 B.
B. C.
C. D.
D. 9. 乙酸乙酯是一种重要的化工原料,广泛用于药物染料、香料等工业。(1)、I.下图所示是乙酸乙酯的绿色合成路线之一:
9. 乙酸乙酯是一种重要的化工原料,广泛用于药物染料、香料等工业。(1)、I.下图所示是乙酸乙酯的绿色合成路线之一: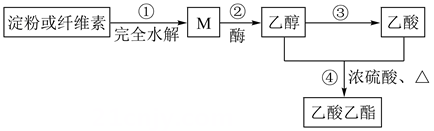
M的分子式为。(2)、下列说法错误的是(填字母)。a.淀粉和纤维素的分子式均为(C6H10O5)n , 但n值不同
b.反应③的类型为加成反应
c.M可与银氨溶液在碱性、加热条件下反应析出银
(3)、II.某课外小组同学设计如图所示装置制取并提纯乙酸乙酯。A中盛有浓硫酸,B中盛有一定量无水乙醇和冰醋酸,D中盛有饱和碳酸钠溶液。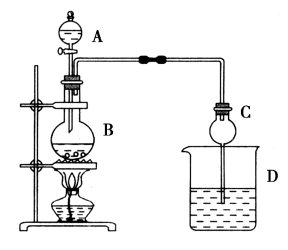
已知:①氯化钙可与乙醇形成微溶于水的;
②;
③有关有机物的沸点如下表:
试剂
乙醚
乙醇
乙酸
乙酸乙酯
沸点/℃
34.7
78.8
118
77.1
加热一段时间,B中生成乙酸乙酯的化学反应方程式为。
(4)、球形干燥管C的主要作用是。(5)、若反应前向D中加入几滴无色酚酞试液,反应结束后振荡、静置,可观察到D中的现象是。(6)、从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;再加(填字母)除水;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。a.五氧化二磷 b.碱石灰 c.无水硫酸钠 d.生石灰
(7)、加热有利于提高乙酸乙酯的产率,但实验过程中发现,温度过高乙酸乙酯的产率反而降低,可能的原因是(填一种)。(8)、用30g乙酸与46g乙醇反应,若实际产量是理论产量的70%,则实际得到乙酸乙酯的质量为 g。10. 已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y的原子最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。回答下列问题:(1)、M2Z的电子式为。(2)、上述元素的最高价氧化物对应的水化物中,碱性最强的是(填化学式)。(3)、Y、Z、M、G四种元素的原子半径由大到小的顺序为(用元素符号表示)。(4)、如图所示,将Q单质的水溶液分别滴入盛有不同试剂的试管中:
①试管a中发生反应的化学方程式为 , 该反应可用于制备漂白液。
②试管b中的现象为 , 说明非金属性:Q(填“>”、“<”或“=”)I。
(5)、镓(Ga)与G同主族且相邻,氮化镓(GaN)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。下列说法正确的是(填字母)。a.元素Ga位于周期表的第4周期IIIA族
b.一定条件下,Ga既能溶于稀盐酸又能溶于氢氧化钠溶液
c.离子半径:
d.常温下,Ga可与水剧烈反应放出氢气