陕西省渭南市大荔县2020-2021学年高一下学期期末考试化学试题
试卷更新日期:2021-12-27 类型:期末考试
一、单选题
-
1. 化学与生活密切相关,下列说法正确的是( )A、酒精浓度越大,对新冠肺炎病毒的杀菌消毒效果越好 B、废旧电池属于有害垃圾,不可随意丢弃,需专门回收 C、“祝触号”火星车使用的铝基碳化硅复合材料属于有机高分子材料 D、尽量使用含12C的产品,减少使用含13C或14C的产品,有利于实现碳中和2. 在我国北斗三号全球卫星导航系统中使用了“铷()原子钟”,它被誉为卫星的“心脏”,下列有关说法错误的是( )A、铷元素位于第五周期第IA族 B、和具有相同的电子数 C、的中子数为48 D、和互为同素异形体3. 下列物质中既含有离子键又含有共价键的是( )A、BaCl2 B、H2SO4 C、KOH D、Na2O4. 日常生活中的下列做法,与调控化学反应速率无关的是( )A、燃煤时将煤块粉碎为煤粉 B、制作绿豆糕时添加适量的食品防腐剂 C、空运水果时在包装箱中放入冰袋 D、炼铁时采用增加炉子高度的方法减少尾气排放5. 下列有关化学用语的表示方法正确的是( )A、次氯酸的电子式: B、
 为乙烯的球棍模型
C、用电子式表示MgCl2的形成过程为:
为乙烯的球棍模型
C、用电子式表示MgCl2的形成过程为: D、氮离子()的结构示意图:
D、氮离子()的结构示意图: 6. W、X、Y、Z均为短周期元素月原子序数依次增大,其中W元素的单质是自然界最轻的气体,X元的最高正价与最低负价的代数和为0,Y元素的原子最外层电子数是次外层电子数的3倍,在短周期中Z元素的原子半径最大。下列说法正确的是( )A、简单离子半径:Z>Y>W B、氢化物稳定性:X>Y C、Y、Z形成的化合物之一可用作供氧剂 D、X、Y、Z分别与W可形成10电子微粒7. 下图为元素周期表的一部分,下列说法正确的是( )
6. W、X、Y、Z均为短周期元素月原子序数依次增大,其中W元素的单质是自然界最轻的气体,X元的最高正价与最低负价的代数和为0,Y元素的原子最外层电子数是次外层电子数的3倍,在短周期中Z元素的原子半径最大。下列说法正确的是( )A、简单离子半径:Z>Y>W B、氢化物稳定性:X>Y C、Y、Z形成的化合物之一可用作供氧剂 D、X、Y、Z分别与W可形成10电子微粒7. 下图为元素周期表的一部分,下列说法正确的是( )X
Y
Z
W
A、X、Z、W的氢化物的水溶液均显酸性 B、X、Y、Z、W元素形成的原子半径由小到大的顺序为:X +Br2
+Br2 +HBr
D、三氯甲烷与液氯混合后,强光照射,发生反应:
12. 下列用系统命名法命名的有机物名称正确的是( )A、4-甲基戊烷 B、2-乙基丁烷 C、2,3-二甲基戊烷 D、1,1-二甲基丁烷13. 下列说法中错误的是( )
+HBr
D、三氯甲烷与液氯混合后,强光照射,发生反应:
12. 下列用系统命名法命名的有机物名称正确的是( )A、4-甲基戊烷 B、2-乙基丁烷 C、2,3-二甲基戊烷 D、1,1-二甲基丁烷13. 下列说法中错误的是( )①油脂、乙酸乙酯都属于酯类
②检验乙醇中是否含水,可用金属钠来检验
③石油的分馏,煤的气化、液化、干馏等过程均为化学变化
④蛋白质溶液中加入少量浓硝酸,微热,不发生化学反应
⑤塑料、合成橡胶和合成纤维是三大合成材料
⑥糖类、油脂、蛋白质都是只含有C、H、O三种元素的有机物
A、②③④⑥ B、①②③⑤ C、④⑤⑥ D、①②③14. 下列实验装置能达到实验目的的是( )选项
A
B
C
D
反应装置




实验目的
测定锌与稀硫酸的反应速率
除去NaCl中混有的NH4Cl
验证化学能转化为电能
制备乙酸乙酯
A、A B、B C、C D、D15. 海水是十分重要的自然资源。下图是对海水的部分利用,有关说法错误的是( ) A、海水晒盐得到粗盐和母液的过程属于物理变化 B、步骤②中加入石灰乳,反应的离子方程式为: C、工业上采用电解MgCl2溶液制得金属镁 D、步骤③可以通入Cl2 , ④⑤的目的是为了富集溴元素16. 我国卫生部门规定市面上销告的碘盐中必须含有KIO3 , 某学生通过查阅资料知道:。该同学为了检验销售的碘盐中是否含有KIO3 , 用试纸和生活中常见的物质进行实验来验证。可选择的物质有:①自来水②碘化钾淀粉试纸③酒精④食醋⑤淀粉⑥食糖。进行实验时必须使用的物质是( )A、②④ B、①② C、③④⑤ D、①②④⑤
A、海水晒盐得到粗盐和母液的过程属于物理变化 B、步骤②中加入石灰乳,反应的离子方程式为: C、工业上采用电解MgCl2溶液制得金属镁 D、步骤③可以通入Cl2 , ④⑤的目的是为了富集溴元素16. 我国卫生部门规定市面上销告的碘盐中必须含有KIO3 , 某学生通过查阅资料知道:。该同学为了检验销售的碘盐中是否含有KIO3 , 用试纸和生活中常见的物质进行实验来验证。可选择的物质有:①自来水②碘化钾淀粉试纸③酒精④食醋⑤淀粉⑥食糖。进行实验时必须使用的物质是( )A、②④ B、①② C、③④⑤ D、①②④⑤二、综合题
-
17. 下图是元系周期表的一部分,同答下列有关问题:
周期族
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
①
②
③
3
④
⑤
⑥
⑦
⑧
⑨
(1)、⑨的元素符号为。在这些元素中,非金属性最强的元素是(用元素符号填答)。(2)、在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最弱的物质反应的化学方程式。(3)、在④⑤⑧形成的三个简单离子中,离子半径由大到小的顺序是(用离子符号填答)。(4)、①与②形成原子个数比为1:2的物质的电子式为。(5)、设计一种简单实验确认⑤与⑥的金属性强弱,你的实验方案为。三、计算题
-
18. 在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+nD(g),开始时A为4mol,B为6mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol·L-1·min-1。计算:(1)、5 min末A的物质的量浓度为 , A的转化率为。(2)、前5 min内用B表示的化学反应速率v(B)为。(3)、化学方程式中n=。(4)、此反应在四种不同情况下的反应速率分别为:①v(A)=5 mol·L-1·min-1②v(B)=6 mol·L-1·min-1③v(C)=0.2 mol·L-1·s-1④v(D)=8 mol·L-1·min-1。其中反应速率最快的是(填序号)。
四、综合题
-
19. 有机物的种类和数目非常庞大,认识简单的有机物是我们学习有机化学的开始。现有如图所示9种烃的结构:

回答下列问题:
(1)、依据上述结构图分析,我们可得出有机物种类繁多的原因,其中正确的是(填编号)。A.有机物中普遍存在同分异构现象
B.有机物里的碳元素有多种同位素
C.有机物分子里碳原子间的连接方式可以是链状,也可以是环状
D.碳原子间通过共用电子对形成共价键时,可以以单键、双键或叁键结合
(2)、F、G二者互为;A、B、H三者互为。(3)、C能使溴的四氯化碳溶液褪色,反应的化学方程式是 , 其反应类型为。(4)、有机物H中的一个氢原子被氯原子替代后的物质有种;有机物I的分子式为。(5)、写出D转化成 的化学方程式。 20. 某烃A是有机化学工业的基本原料,其产量可以用来衡暈一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据下图回答下列问题:
的化学方程式。 20. 某烃A是有机化学工业的基本原料,其产量可以用来衡暈一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据下图回答下列问题: (1)、写出A的结构式为;D的分子式为。(2)、写出反应类型③;⑤。(3)、D中含有官能团的名称为;高分子化合物E的结构简式为;F为环状化合物,其结构简式为。(4)、写出反应②的化学方程式(5)、G是B的一种同系物,其相对分子质量为86,则G的同分异构体有种。21.(1)、利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如图所示。写出该氧化还原反应的离子方程式:。该装置中的负极材料是(填化学式),正极反应式是。
(1)、写出A的结构式为;D的分子式为。(2)、写出反应类型③;⑤。(3)、D中含有官能团的名称为;高分子化合物E的结构简式为;F为环状化合物,其结构简式为。(4)、写出反应②的化学方程式(5)、G是B的一种同系物,其相对分子质量为86,则G的同分异构体有种。21.(1)、利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱,如图所示。写出该氧化还原反应的离子方程式:。该装置中的负极材料是(填化学式),正极反应式是。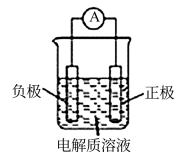 (2)、某研究性学习小组为证明为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。
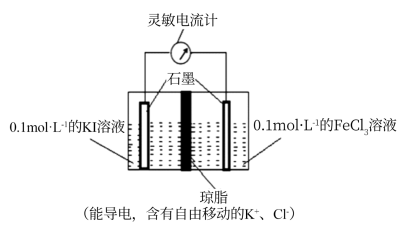
(2)、某研究性学习小组为证明为可逆反应,设计如下两种方案(已知:酸性溶液中Fe2+易被空气氧化为Fe3+)。方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3济液,滴入5滴稀盐酸,再继续加入2mLCCl4 , 充分振荡、静置、分层,取上层清液,滴加KSCN溶液,现象是 , 即可证明该反应为可逆反应。你认为此方案(“不严密”或“严密”),理由是(用离子方程式表示)。
方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行;电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池了中加入1mol/L FeCl2溶液,灵敏电流计指针向左偏转,即可证明该反应为可逆反应。你认为灵敏电流计“读数变为零”的原因是。
-
-