广东省揭阳市揭东区2020-2021学年高一下学期期末考试化学试题
试卷更新日期:2021-12-27 类型:期末考试
一、单选题
-
1. 新中国成立70年以来,高分子材料以独特的结构和性能在科学技术、国防建设和国民经济等领域发挥重要作用。下列材料中主要成分不属于有机高分子的是( )




A.宇航服
B.汽车轮胎
C.口罩的聚丙烯熔喷布
D.螺纹钢
A、A B、B C、C D、D2. “低碳生活”是指减少能源消耗、节约资源,从而减少二氧化碳排放的生活方式.下列不符合“低碳生活”的做法是 ( )A、太阳能热水器代替燃气热水器 B、环保袋代替一次性塑料袋 C、自驾车代替骑自行车出行 D、节能灯代替白炽灯3. 下列物质中属于电解质的是( )A、NH3 B、乙醇 C、氯化钠 D、氯水4. 硅被誉为无机非金属材料的主角.下列物品用到硅单质的是( )A、玻璃制品 B、计算机芯片 C、石英钟表 D、光导纤维5. 下列表示物质结构的化学用语或模型正确的是( )A、中子数为18的氯原子: B、丙烯的结构简式: C、CH3CHO的球棍模型: D、用电子式表示NaCl的形成过程:
D、用电子式表示NaCl的形成过程: 6. 下列反应既表现硝酸的氧化性,又表现硝酸的酸性的是( )A、 B、 C、 D、7. 下列有关物质性质的叙述正确的是( )A、铜不能与浓硫酸发生反应 B、氯水久置后,漂白性和酸性均增强 C、二氧化硫能与高锰酸钾等强氧化剂反应 D、二氧化硫与氯水混合使用漂白效果会更好8. 分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述错误的是( )
6. 下列反应既表现硝酸的氧化性,又表现硝酸的酸性的是( )A、 B、 C、 D、7. 下列有关物质性质的叙述正确的是( )A、铜不能与浓硫酸发生反应 B、氯水久置后,漂白性和酸性均增强 C、二氧化硫能与高锰酸钾等强氧化剂反应 D、二氧化硫与氯水混合使用漂白效果会更好8. 分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述错误的是( ) A、1mol分枝酸可以和3molH2发生加成反应 B、该有机物可发生取代反应、加成反应和氧化反应 C、该有机物中除了含有醚键(
A、1mol分枝酸可以和3molH2发生加成反应 B、该有机物可发生取代反应、加成反应和氧化反应 C、该有机物中除了含有醚键( )外,还有另外3种官能团
D、该有机物可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,并且褪色原理相同
9. 下列关于金属冶炼的说法正确的是( )A、金属的冶炼都是把金属单质从其矿物中分离出来 B、古代火烧孔雀石炼铜的方法属于热还原法中的焦炭法 C、工业上可用电解熔融态的MgCl2、AlCl3来制备Mg、Al D、利用该铝热反应炼铁,1mol氧化剂参加反应转移9NA个电子10. 已知X、Y、Z、W四种元素中,X是宇宙中最丰富的元素,Y元素原子最外层电子数是内层电子总数的2倍;Z是地壳中含量最高的元素;W元素原子K层和M 层电子总数等于其L层电子数。下列回答错误的是( )A、X2Z常温下为液态 B、Y的一种单质可导电 C、W的一种氧化物可形成酸雨 D、YZ2为碱性氧化物11. 2019年12月以来,我国部分地区突发的新冠病毒肺炎威胁着人们的身体健康。下列有关说法正确的是( )A、新型冠状病毒由C,H,O三种元素组成 B、口罩中间的熔喷布具有核心作用,其主要原料为聚丙烯,属于有机高分子材料 C、过氧化氢、乙醇、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的 D、“84”消毒液(有效成分为NaClO)可以与洁厕灵(主要成分为盐酸)混合使用12. 下列关于常见有机物的说法错误的是( )A、乙酸和油脂都能与NaOH溶液反应 B、淀粉水解与纤维素水解得到的最终产物相同 C、蛋白质、纤维素、蔗糖、油脂都是高分子化合物 D、乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别13. 下列说法中,正确的是( )A、30gNO含有的原子总数为6.02×1023 B、标准状况下,18gH2O的体积为22.4L C、常温常压下,22.4LCO2物质的量为1mol D、100mL1mol·L-1NaCl溶液中含有0.1molCl-14. 下面是某同学做完铜—锌—稀硫酸原电池的实验后得出的结论和认识,正确的是( )
)外,还有另外3种官能团
D、该有机物可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,并且褪色原理相同
9. 下列关于金属冶炼的说法正确的是( )A、金属的冶炼都是把金属单质从其矿物中分离出来 B、古代火烧孔雀石炼铜的方法属于热还原法中的焦炭法 C、工业上可用电解熔融态的MgCl2、AlCl3来制备Mg、Al D、利用该铝热反应炼铁,1mol氧化剂参加反应转移9NA个电子10. 已知X、Y、Z、W四种元素中,X是宇宙中最丰富的元素,Y元素原子最外层电子数是内层电子总数的2倍;Z是地壳中含量最高的元素;W元素原子K层和M 层电子总数等于其L层电子数。下列回答错误的是( )A、X2Z常温下为液态 B、Y的一种单质可导电 C、W的一种氧化物可形成酸雨 D、YZ2为碱性氧化物11. 2019年12月以来,我国部分地区突发的新冠病毒肺炎威胁着人们的身体健康。下列有关说法正确的是( )A、新型冠状病毒由C,H,O三种元素组成 B、口罩中间的熔喷布具有核心作用,其主要原料为聚丙烯,属于有机高分子材料 C、过氧化氢、乙醇、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的 D、“84”消毒液(有效成分为NaClO)可以与洁厕灵(主要成分为盐酸)混合使用12. 下列关于常见有机物的说法错误的是( )A、乙酸和油脂都能与NaOH溶液反应 B、淀粉水解与纤维素水解得到的最终产物相同 C、蛋白质、纤维素、蔗糖、油脂都是高分子化合物 D、乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别13. 下列说法中,正确的是( )A、30gNO含有的原子总数为6.02×1023 B、标准状况下,18gH2O的体积为22.4L C、常温常压下,22.4LCO2物质的量为1mol D、100mL1mol·L-1NaCl溶液中含有0.1molCl-14. 下面是某同学做完铜—锌—稀硫酸原电池的实验后得出的结论和认识,正确的是( ) A、硫酸溶液中Zn2+浓度增大 B、在该原电池中,铜作负极 C、外电路中的电流方向:Zn→Cu D、电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气15. 浩瀚的海洋是一个巨大的物质宝库,工业上常用浓缩海水提取溴.
A、硫酸溶液中Zn2+浓度增大 B、在该原电池中,铜作负极 C、外电路中的电流方向:Zn→Cu D、电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气15. 浩瀚的海洋是一个巨大的物质宝库,工业上常用浓缩海水提取溴.
下列说法错误的是( )
A、海水的淡化方法主要有蒸馏法、电渗析法、离子交换法等 B、步骤②中体现了溴易挥发的性质 C、步骤③反应的离子方程式为Br2+SO2+2H2O═2HBr+2H++SO42﹣ D、①﹣④目的是为了富集溴元素16. 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )选项
陈述Ⅰ
陈述Ⅱ
判断
A
向浓盐酸中加入浓硫酸可制备氯化氢气体
浓盐酸易挥发,浓硫酸与水作用放出大量的热
Ⅰ对,Ⅱ对; 有
B
Cu 能与浓 HNO3 反应
由于 Cu 具有还原性,浓HNO3 具有氧化性,在任何条件下生成的气体一定是 NO2
Ⅰ对,Ⅱ错; 无
C
硫单质在纯氧中燃烧有少量 SO3 生成
部分二氧化硫被氧化为SO3
Ⅰ对,Ⅱ对; 无
D
硝酸铵和碱石灰共热用于实验室制备 NH3
铵盐与碱能发生复分解反应
Ⅰ对,Ⅱ对; 有
A、A B、B C、C D、D二、综合题
-
17. 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨并探究相关性质。(1)、图1装置A中,烧瓶内药品可选用
 (2)、实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为。(3)、该实验缺少尾气吸收装置,图2中不能用来吸收尾气的装置是(填装置序号)。(4)、实验室还可用图3所示装置制备氨气,反应化学方程式为。用圆底烧瓶收集干燥的氨气,用图4装置进行喷泉实验,挤压胶头滴管时,可以得到红色喷泉,原因是(用化学方程式和适当的文字来说明)。(5)、图4装置中,若将胶头滴管中的水和烧杯中滴有酚酞的水换成下列选项的溶液,烧瓶中的气体变换成下列选项中的气体,不能形成喷泉实验现象的组合是____。
(2)、实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为。(3)、该实验缺少尾气吸收装置,图2中不能用来吸收尾气的装置是(填装置序号)。(4)、实验室还可用图3所示装置制备氨气,反应化学方程式为。用圆底烧瓶收集干燥的氨气,用图4装置进行喷泉实验,挤压胶头滴管时,可以得到红色喷泉,原因是(用化学方程式和适当的文字来说明)。(5)、图4装置中,若将胶头滴管中的水和烧杯中滴有酚酞的水换成下列选项的溶液,烧瓶中的气体变换成下列选项中的气体,不能形成喷泉实验现象的组合是____。 A、水、CO2 B、HCl溶液、NH3气体 C、NaOH溶液、HCl气体 D、NaOH溶液、CO2气体(6)、氨气极易溶于水,若标准状况下,将5.6L的氨气溶于水配成1L溶液,所得溶液的物质的量浓度为 mol∙L−118. 某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3 , 为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
A、水、CO2 B、HCl溶液、NH3气体 C、NaOH溶液、HCl气体 D、NaOH溶液、CO2气体(6)、氨气极易溶于水,若标准状况下,将5.6L的氨气溶于水配成1L溶液,所得溶液的物质的量浓度为 mol∙L−118. 某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3 , 为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)、写出步骤Ⅰ反应的离子方程式:、。(2)、试剂X是 , 溶液D是。(3)、在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是。 (4)、由固体F制取硫酸铜溶液,通常有两种方案:
(4)、由固体F制取硫酸铜溶液,通常有两种方案:方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀硫酸中,然后不断鼓入空气。
方案一的缺点为:。
请写出方案二中发生反应的化学方程式:。
19. 研究化学反应的快慢和限度,对工农业生产和人们生活有重要的意义。(1)、Ⅰ.某反应过程的能量变化如图所示:
由图中曲线变化可知,该反应为(填“放热”或“吸热”)反应,破坏旧键需要吸收的能量为(填“E1”、“E2”、“E1+E2”或“E2-E1”下同),破坏cmolC的化学键需要吸收的能量为。
(2)、Ⅱ.一定温度下,向容积为2L的恒容密闭容器中通入两种气体发生化学反应生成气态物质,反应中各气态物质的物质的量变化如图所示:
该反应的化学方程式为:;
(3)、0-6s内B的化学反应速率为:。(4)、Ⅱ.工业制硫酸的反应之一为: , 在2L恒容绝热密闭容器中投入2molSO2和适当过量的O2 , 在一定条件下充分反应,如图是SO2和SO3随时间的变化曲线。
下列叙述不能判断该反应达到平衡状态的是;
①容器中压强不再改变; ②容器中气体密度不再改变;
③O2的物质的量浓度不再改变; ④SO3的质量不再改变;
(5)、根据图示计算达到平衡时SO2的转化率为(6)、Ⅲ.碱性氢氧燃料电池是目前开发的燃料电池之一,这种燃料电池由氢气、空气(氧气)、KOH(电解质溶液)构成。其中正极反应式为下列说法错误的是
①电池放电时通入空气的电极为负极;
②电池放电时,电解质溶液的碱性逐渐减弱;
③电池放电时每消耗3.2gH2转移3.2mol电子。
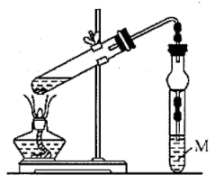
(7)、写出该燃料电池的负极反应式:。20. 以淀粉或以石油裂解产物F(其产量常用来衡量一个国家的石油化工发展水平)为原料制备一种具有果香味的物质E的生产流程如下:
请回答下列问题:
(1)、F的结构简式为;D中官能团的名称为。(2)、写出一种分子中含有HCOO-的E的同分异构体的结构简式:。(3)、写出B→C反应的化学方程式:。(4)、反应的实验装置如图,球形干燥管的作用是。反应前,要在大试管中加入几颗沸石或碎瓷片防暴沸,不小心忘记加,应当。装置中溶液M为 , 其作用是。该反应的化学方程式为。