陕西省宝鸡市金台区2020-2021学年高二下学期期末考试化学试题
试卷更新日期:2021-12-27 类型:期末考试
一、单选题
-
1. 下列各原子或离子的电子排布式错误的是( )A、K+ 1s22s22p63s23p6 B、As 1s22s22p63s23p63d104s24p3 C、N3- 1s22s22p6 D、Cr 1s22s22p63s23p63d44s22. 以下关于分子间作用力的叙述错误的是( )A、是一种较弱的化学键 B、分子间作用力较弱,破坏它所需能量较少 C、分子间作用力对物质的熔、沸点有影响 D、稀有气体原子间存在分子间作用力3. 下列物质的分子中既有σ键,又有π键,并含有非极性键的( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A、①②③ B、③④⑤⑥ C、①③⑥ D、③⑤⑥4. 根据如表所列键能数据,可推出下列分子中最不稳定的是( )化学键
H-H
H-Cl
H-Br
Cl-Cl
Br-Br
键能/(kJ•mol-1)
436.0
431.8
366.0
242.7
193.7
A、HCl B、HBr C、H2 D、Br25. 下列各组物质中,都是由极性键构成为极性分子的一组的是( )A、NH3和H2S B、PCl5和HCl C、CH4和H2O D、HCN和BF36. 用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )A、CS2为V形 B、HCN为V形 C、NH4+为正四面体形 D、PCl3为平面三角形7. 金属的下列性质中,与自由电子无关的是( )A、延展性好 B、容易导电 C、密度大小 D、易导热8. 下列主族元素氢化物的沸点依次升高的是( )A、第IVA族 B、第VA族 C、第VIA族 D、第VIIA族9. 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为( ) A、NaCl B、CsCl C、 D、10. 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均已单键结合,下列关于晶体说法正确的是( )A、C3N4晶体是分子晶体 B、C3N4晶体中,C-N键的键长比金刚石中C-C键的键长要长 C、C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 D、C3N4晶体中微粒间通过离子键结合11. 下列关于晶格能的说法中正确的是( )A、晶格能指形成1 mol离子键所放出的能量 B、晶格能指破坏1 mol离子键所吸收的能量 C、晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量 D、晶格能的大小与晶体的熔点、硬度都无关12. 试根据学过的知识,判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序可能是( )A、KCl>NaCl>BaO>CaO B、NaCl>KCl>CaO>BaO C、CaO>BaO>NaCl>KCl D、CaO>BaO>KCl>NaCl13. 下列晶体性质的比较中错误的是( )A、熔点:金刚石>碳化硅>晶体硅 B、沸点:NH3>PH3 C、硬度:白磷>冰>二氧化硅 D、熔点:SiI4>SiBr4>SiCl414. 下列说法正确的是( )A、CaCl2晶体中存在共价键 B、H2SO4溶于水能电离出H+和SO42- , 所以硫酸是离子化合物 C、SiO2属于原子晶体,熔化破坏共价键和分子间作用力 D、I2是分子晶体,加热升华过程中只需克服分子间作用力15. 下列说法错误的是( )A、ns电子的能量不一定高于(n-1)p电子的能量 B、基态C原子的电子排布式1s22s22p2 C、电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 D、电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理16. 下列说法正确的是( )A、冰融化时,分子中有H-O键发生断裂 B、卤化物CX4(X代表卤族元素)中,从F到I,分子间作用力逐渐增大,它们的熔沸点也逐渐升高 C、由于H-O键比H-S键牢固,所以水的熔沸点比H2S高 D、在由分子所构成的物质中,分子间作用力越大,该物质越稳定17. 有关晶体的结构如图所示,下列说法中错误的是( )
A、NaCl B、CsCl C、 D、10. 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均已单键结合,下列关于晶体说法正确的是( )A、C3N4晶体是分子晶体 B、C3N4晶体中,C-N键的键长比金刚石中C-C键的键长要长 C、C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 D、C3N4晶体中微粒间通过离子键结合11. 下列关于晶格能的说法中正确的是( )A、晶格能指形成1 mol离子键所放出的能量 B、晶格能指破坏1 mol离子键所吸收的能量 C、晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量 D、晶格能的大小与晶体的熔点、硬度都无关12. 试根据学过的知识,判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序可能是( )A、KCl>NaCl>BaO>CaO B、NaCl>KCl>CaO>BaO C、CaO>BaO>NaCl>KCl D、CaO>BaO>KCl>NaCl13. 下列晶体性质的比较中错误的是( )A、熔点:金刚石>碳化硅>晶体硅 B、沸点:NH3>PH3 C、硬度:白磷>冰>二氧化硅 D、熔点:SiI4>SiBr4>SiCl414. 下列说法正确的是( )A、CaCl2晶体中存在共价键 B、H2SO4溶于水能电离出H+和SO42- , 所以硫酸是离子化合物 C、SiO2属于原子晶体,熔化破坏共价键和分子间作用力 D、I2是分子晶体,加热升华过程中只需克服分子间作用力15. 下列说法错误的是( )A、ns电子的能量不一定高于(n-1)p电子的能量 B、基态C原子的电子排布式1s22s22p2 C、电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 D、电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理16. 下列说法正确的是( )A、冰融化时,分子中有H-O键发生断裂 B、卤化物CX4(X代表卤族元素)中,从F到I,分子间作用力逐渐增大,它们的熔沸点也逐渐升高 C、由于H-O键比H-S键牢固,所以水的熔沸点比H2S高 D、在由分子所构成的物质中,分子间作用力越大,该物质越稳定17. 有关晶体的结构如图所示,下列说法中错误的是( ) A、在NaCl 晶体中,距Na +最近的Cl- 形成正八面体 B、在 晶体中,每个晶胞平均占有4 个Ca2+ C、在金刚石晶体中,碳原子与碳碳键个数的比为1:2 D、该气态团簇分子的分子式为EF或FE18. 某晶体晶胞中A、B、C三种元素原子的排列如图所示,C(∆)在晶胞的中心,则晶体中A、B、C的原子个数之比( )
A、在NaCl 晶体中,距Na +最近的Cl- 形成正八面体 B、在 晶体中,每个晶胞平均占有4 个Ca2+ C、在金刚石晶体中,碳原子与碳碳键个数的比为1:2 D、该气态团簇分子的分子式为EF或FE18. 某晶体晶胞中A、B、C三种元素原子的排列如图所示,C(∆)在晶胞的中心,则晶体中A、B、C的原子个数之比( ) A、1∶3∶1 B、2∶3∶1 C、8∶6∶1 D、4∶3∶119. 如图所示是氯化铯晶体的晶胞结构示意图,已知晶胞中2个最近的的核间距为 , 氯化铯()的摩尔质量为 , 为阿伏加德罗常数的值,则氯化铯晶体的密度为( )
A、1∶3∶1 B、2∶3∶1 C、8∶6∶1 D、4∶3∶119. 如图所示是氯化铯晶体的晶胞结构示意图,已知晶胞中2个最近的的核间距为 , 氯化铯()的摩尔质量为 , 为阿伏加德罗常数的值,则氯化铯晶体的密度为( ) A、 B、 C、 D、20. 下列是典型晶体的结构示意图,从①到⑥对应正确的是( )
A、 B、 C、 D、20. 下列是典型晶体的结构示意图,从①到⑥对应正确的是( ) A、CsCl 金刚石 CaF2 Cu CO2 Fe B、CaF2 SiC 金刚石 Cu CO2 CsCl C、NaCl 单质硅 CaF2 Au CO2 K D、NaCl BN Au CaF2 CO2 Na
A、CsCl 金刚石 CaF2 Cu CO2 Fe B、CaF2 SiC 金刚石 Cu CO2 CsCl C、NaCl 单质硅 CaF2 Au CO2 K D、NaCl BN Au CaF2 CO2 Na二、填空题
-
21. 锌是人体必需的微量元素之一,常被人们誉为生命之花和智力之源。乳酸锌是常见的补锌剂,制取原理为(C3H5O3)2Ca+ZnSO4=(C3H5O3)2Zn+CaSO4↓。回答下列问题:(1)、基态Zn原子的价电子排布式为。(2)、氧元素的原子核外有种不同运动状态的电子,有种不同能量的电子,下列不同状态的氧原子其能量最低的是(填字母)。
A.
 B.
B.
C.
 D.
D. (3)、乳酸(CH3CHOHCOOH)分子中碳原子的轨道杂化类型为 , 分子中第一电离能最大的原子是。(4)、SO3分子的空间构型为;与为等电子体的分子为(写一种)。22. 某同学对科学探究实验有着浓厚兴趣,他喜欢自己动手做实验,记录实验现象,并探究现象后的本质。实验如下:(1)、向蓝色的硫酸铜溶液中慢慢滴加氨水,生成蓝色絮状沉淀(请用离子方程式说明),继续滴加沉淀消失,得到深蓝色溶液(用离子方程式说明)。(2)、已知Co(NH3)5BrSO4可形成两种Co的配合物。为了探索其化学式,他取了两种配合物的溶液于甲、乙两支试管中,甲中加BaCl2溶液无现象,加AgNO3溶液生成淡黄色沉淀,乙中加BaCl2生成白色沉淀,加AgNO3无现象,则甲、乙试管中的配合物化学式分别为、。
(3)、乳酸(CH3CHOHCOOH)分子中碳原子的轨道杂化类型为 , 分子中第一电离能最大的原子是。(4)、SO3分子的空间构型为;与为等电子体的分子为(写一种)。22. 某同学对科学探究实验有着浓厚兴趣,他喜欢自己动手做实验,记录实验现象,并探究现象后的本质。实验如下:(1)、向蓝色的硫酸铜溶液中慢慢滴加氨水,生成蓝色絮状沉淀(请用离子方程式说明),继续滴加沉淀消失,得到深蓝色溶液(用离子方程式说明)。(2)、已知Co(NH3)5BrSO4可形成两种Co的配合物。为了探索其化学式,他取了两种配合物的溶液于甲、乙两支试管中,甲中加BaCl2溶液无现象,加AgNO3溶液生成淡黄色沉淀,乙中加BaCl2生成白色沉淀,加AgNO3无现象,则甲、乙试管中的配合物化学式分别为、。三、综合题
-
23. 铬锆铜(CuCrZr)合金具有优良性能,广泛应用于机械制造工业的焊接。已知锆(40Zr)位于第IVB族,根据要求回答下列问题:(1)、铜元素在元素周期表的位置为。(2)、形成铬锆铜合金的元素中,基态原子中未成对电子最少的是(填元素符号)。(3)、对于基态Cr原子,下列叙述正确的是____(填标号)。A、轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1 B、4s电子能量较高,总是在比3s电子离核更远的地方运动 C、电负性比钾高,原子对键合电子的吸引力比钾大(4)、三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 , 中心离子的配位数为。(5)、下表是Fe与Cu的部分电离能数据,I2(Cu)大于I2(Fe)的主要原因是。
元素
Fe
Cu
第一电离能能I1(kJ•mol-1)
759
746
第二电离能I2(kJ•mol-1)
1561
1958
24. 第IVA族元素及其化合物是结构化学研究的热点。几种晶体结构如图所示: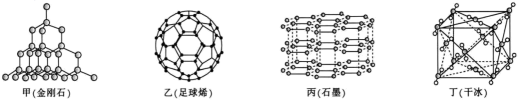 (1)、基态锗(G)的价电子排布图为。(2)、上述四种晶体中,石墨中碳原子之间具有的作用有。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为5:1的分子的结构简式为(写一种)。(5)、硅晶体结构类似于金刚石(如图甲),则14g硅晶体中含mol共价键。1mol石墨如图丙晶体中含mol共价键。(6)、设NA为阿伏加德罗常数的值,已知干冰(如图丁)的晶胞边长为apm,则干冰的密度为g•cm-3(用含a和NA的代数式表示)。
(1)、基态锗(G)的价电子排布图为。(2)、上述四种晶体中,石墨中碳原子之间具有的作用有。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为5:1的分子的结构简式为(写一种)。(5)、硅晶体结构类似于金刚石(如图甲),则14g硅晶体中含mol共价键。1mol石墨如图丙晶体中含mol共价键。(6)、设NA为阿伏加德罗常数的值,已知干冰(如图丁)的晶胞边长为apm,则干冰的密度为g•cm-3(用含a和NA的代数式表示)。