广东省汕尾市2020-2021学年高二下学期期末考试化学试题
试卷更新日期:2021-12-27 类型:期末考试
一、单选题
-
1. 中华传统文化中蕴含着许多化学知识。下列诗句分析错误的是( )A、刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”说明金的化学性质稳定,在自然界中常以单质形态存在 B、中国古代炼丹家制硫酸时用“炼石胆(胆矾)取其精华”,在制硫酸过程中,涉及分解反应 C、《本草纲目》中收载“烧酒”篇:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是蒸馏 D、《抱朴子》中“丹砂烧之成水银,积变又还成丹砂”两个反应互为可逆反应2. 下列有关物质性质与应用的说法正确的是( )A、具有氧化性,可用于漂白纸浆 B、氢氟酸具有酸性,可用于雕刻玻璃 C、能与反应生成 , 可作为呼吸面具中氧气的来源 D、有导电性,可以用于制造光导纤维3. 设为阿伏加德罗常数的数值,下列说法正确的是( )A、通常状况下,2.24L和的混合气体中氮原子和氧原子个数之比为1∶2 B、1L的氨水中含有0.1个 C、56gFe和64gCu分别与1molS反应转移的电子数均为2 D、46g甲苯中含有碳碳双键的数目为1.54. 下列关于有机物的说法正确的是( )A、汽油、柴油、植物油都是碳氢化合物 B、用碳酸氢钠溶液可区分乙酸、乙醇和苯 C、分子式为的同分异构体有4种 D、异丙苯(
 )中所有碳原子可能处于同一平面上
5. 下列有关实验的操作方法或实验结论错误的是( )A、用分液漏斗滴加液体时,应打开上口的玻璃塞或将玻璃塞上的凹槽对准口颈部的小孔 B、向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色,能制得氢氧化铁胶体 C、液溴保存应选用带玻璃塞的细口棕色试剂瓶,再在液溴上加一层水,并放在阴凉处 D、中和滴定实验中,盛标准液的滴定管滴定前无气泡、滴定后出现气泡,会使测定结果偏低6. 下列叙述正确的是( )A、蔗糖与浓硫酸反应有海绵状的炭生成,说明浓硫酸具有吸水性 B、向饱和食盐水中通入过量 , 无明显现象;再通入 , 溶液变浑浊 C、溶液可用于铜质印刷线路板制作是因为能从含的溶液中置换出铜 D、在足量的中灼烧使之转化为CuO,反应后固体物质的质量不变7. 下列表示对应化学反应的离子方程式正确的是( )A、酸性氯化亚铁溶液中加入双氧水: B、向碳酸氢铵溶液中加入过量的NaOH溶液: C、用过量氨水吸收工业尾气中的: D、向溶液中加入稀盐酸:8. 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,其工作原理为。下列说法正确的是( )
)中所有碳原子可能处于同一平面上
5. 下列有关实验的操作方法或实验结论错误的是( )A、用分液漏斗滴加液体时,应打开上口的玻璃塞或将玻璃塞上的凹槽对准口颈部的小孔 B、向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色,能制得氢氧化铁胶体 C、液溴保存应选用带玻璃塞的细口棕色试剂瓶,再在液溴上加一层水,并放在阴凉处 D、中和滴定实验中,盛标准液的滴定管滴定前无气泡、滴定后出现气泡,会使测定结果偏低6. 下列叙述正确的是( )A、蔗糖与浓硫酸反应有海绵状的炭生成,说明浓硫酸具有吸水性 B、向饱和食盐水中通入过量 , 无明显现象;再通入 , 溶液变浑浊 C、溶液可用于铜质印刷线路板制作是因为能从含的溶液中置换出铜 D、在足量的中灼烧使之转化为CuO,反应后固体物质的质量不变7. 下列表示对应化学反应的离子方程式正确的是( )A、酸性氯化亚铁溶液中加入双氧水: B、向碳酸氢铵溶液中加入过量的NaOH溶液: C、用过量氨水吸收工业尾气中的: D、向溶液中加入稀盐酸:8. 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,其工作原理为。下列说法正确的是( ) A、氧化性: B、电池放电时,负极的电极反应式为 C、电池放电时,从负极室穿过选择性透过膜移向正极室 D、充电时,阴极的电极反应式为9. O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2 , 下列说法正确的是( )A、氧气是氧化产物 B、O2F2既是氧化剂又是还原剂 C、还原剂与氧化剂的物质的量之比为1∶4 D、若生成4.48LHF,则转移0.8mol电子10. 依据图中氮元素及其化合物的转化关系,判断下列说法错误的是( )
A、氧化性: B、电池放电时,负极的电极反应式为 C、电池放电时,从负极室穿过选择性透过膜移向正极室 D、充电时,阴极的电极反应式为9. O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2 , 下列说法正确的是( )A、氧气是氧化产物 B、O2F2既是氧化剂又是还原剂 C、还原剂与氧化剂的物质的量之比为1∶4 D、若生成4.48LHF,则转移0.8mol电子10. 依据图中氮元素及其化合物的转化关系,判断下列说法错误的是( ) A、可用排水法收集NO、NO2气体 B、X是N2O5 C、工业上以NH3、空气、水为原料生产硝酸 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现11. 药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
A、可用排水法收集NO、NO2气体 B、X是N2O5 C、工业上以NH3、空气、水为原料生产硝酸 D、由NH3→N2 , 从原理上看,NH3可与NO2反应实现11. 药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
下列有关叙述错误的是( )
A、可用溶液区分乙酰水杨酸和对乙酰氨基酚 B、贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 C、1mol乙酰水杨酸最多消耗3molNaOH D、贝诺酯分子中有两种含氧官能团12. 由SO2和O2制备SO3(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示)(加热和夹持装置省略):
下列说法正确的是( )
A、装置①中的试剂为饱和NaHSO3溶液 B、实验室可用铜与稀硫酸在加热条件下制取SO2 C、装置③反应管中的铂石棉用作反应的催化剂 D、从装置⑤逸出的气体有过量的SO2和O213. 短周期主族元素X、Y、Z、R的原子半径与原子序数的关系如图所示。X和R同族,Z的最高正化合价和最低负化合价之和为2,Y的最高价氧化物对应的水化物能与盐酸、氢氧化钠反应。X有两种气态单质和 , 用湿润的淀粉KI试纸检验时生成和。下列说法错误的是( ) A、非金属性:X>R>Z B、化合物在水中能稳定存在 C、X和Z组成的化合物可能是干燥剂 D、气态氢化物的热稳定性:R>Z14. 南海争端、南海仲裁案一直牵动国人的心,南海是一个巨大的资源宝库,海水开发利用的部分过程如下图所示。下列有关说法正确的是( )
A、非金属性:X>R>Z B、化合物在水中能稳定存在 C、X和Z组成的化合物可能是干燥剂 D、气态氢化物的热稳定性:R>Z14. 南海争端、南海仲裁案一直牵动国人的心,南海是一个巨大的资源宝库,海水开发利用的部分过程如下图所示。下列有关说法正确的是( ) A、第①步中除去粗盐中的SO42-、Ca 2+、Mg2+等杂质,加入药品的顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液、过滤后加盐酸 B、第②步的关键要低温小火烘干 C、氯碱工业的阴极产物是Cl2 D、从第③步到第⑤步的目的是为了富集溴元素15. 下列有关叙述正确的是( )A、常温下,等体积的的盐酸与的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计) B、室温下,pH均为4的稀硫酸、溶液中,水的电离程度相同 C、25℃时,的HA溶液中 , 则该溶液中由水电离出的 D、在饱和AgCl、AgBr的混合溶液中加入少量溶液,增大16. 是一种新型硝化剂,在一定温度下可发生如下反应: 。温度时,向密闭容器中通入一定量的气体,反应时间以及对应的浓度数据见下表:
A、第①步中除去粗盐中的SO42-、Ca 2+、Mg2+等杂质,加入药品的顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液、过滤后加盐酸 B、第②步的关键要低温小火烘干 C、氯碱工业的阴极产物是Cl2 D、从第③步到第⑤步的目的是为了富集溴元素15. 下列有关叙述正确的是( )A、常温下,等体积的的盐酸与的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计) B、室温下,pH均为4的稀硫酸、溶液中,水的电离程度相同 C、25℃时,的HA溶液中 , 则该溶液中由水电离出的 D、在饱和AgCl、AgBr的混合溶液中加入少量溶液,增大16. 是一种新型硝化剂,在一定温度下可发生如下反应: 。温度时,向密闭容器中通入一定量的气体,反应时间以及对应的浓度数据见下表:时间/s
0
500
1000
1500
5.00
3.52
2.50
2.50
下列说法正确的是( )
A、500s内的生成速率为 B、温度下该反应平衡时的转化率为29.6% C、达到平衡后其他条件不变,将容器的体积压缩到原来的1/2,则 D、温度下的平衡常数为 , 温度下的平衡常数为 , 若 , 则二、综合题
-
17. 如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。

已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)、①实验中控制氯气与空气的体积比的方法是。②使用多孔球泡的作用是。
(2)、①装置B中产生Cl2O的化学方程式为。②若B无冷却装置,进入C中的Cl2O会大量减少。其原因是。
(3)、装置C中采用棕色圆底烧瓶是因为。(4)、已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案:用量取20.00 mL次氯酸溶液于烧杯中,。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)18. 无水具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量、、、等杂质)生产无水氯化钙的主要流程如下: (1)、为了提高步骤①的反应速率,可以采取的措施是。(2)、加入试剂b的目的是使溶液酸化,试剂b可以选择____(选填字母)试剂。A、硫酸 B、硝酸 C、氢硫酸 D、盐酸(3)、写出步骤②的离子方程式:。(4)、步骤⑤涉及的操作方法有蒸发浓缩、。(5)、已知、、生成氢氧化物沉淀或沉淀溶解的pH如下:
(1)、为了提高步骤①的反应速率,可以采取的措施是。(2)、加入试剂b的目的是使溶液酸化,试剂b可以选择____(选填字母)试剂。A、硫酸 B、硝酸 C、氢硫酸 D、盐酸(3)、写出步骤②的离子方程式:。(4)、步骤⑤涉及的操作方法有蒸发浓缩、。(5)、已知、、生成氢氧化物沉淀或沉淀溶解的pH如下:开始沉淀
3.7
6.5
1.5
12.4
开始溶解
7.8
沉淀完全
5.3
9.7
3.3
13.8
完全溶解
10.0
可以通过加入试剂a调节溶液Ⅱ的pH,调节溶液Ⅱ的pH的目的是 , 调节pH的范围为。
(6)、已知某一温度时 , 向的溶液中加入NaOH固体,假设溶液的体积不变,要使沉淀完全,溶液中最小为。19. 对机动车尾气中的N、C元素进行处理,可以保护环境,减少污染。(1)、①可在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应经历如下两步:反应Ⅰ:;
反应Ⅱ:。
则由NO生成1mol的kJ/mol。
②若反应Ⅰ比反应Ⅱ的反应速率大,下列能正确表示反应的在有催化剂(a)和无催化剂(b)时反应过程能量变化的图是(选填字母)。
A.
 B.
B. C.
C. D.
D. (2)、相同温度下,两个体积均为1L的恒容密闭容器中,发生反应 , 各物质的物质的量如下表:
(2)、相同温度下,两个体积均为1L的恒容密闭容器中,发生反应 , 各物质的物质的量如下表:容器编号
起始时物质的量/mol
平衡时物质的量/mol
NO
CO
Ⅰ
0.2
0.2
0
0
a
Ⅱ
0.3
0.3
b
0.1
0.2
①容器Ⅰ中平衡后气体的压强为开始时的0.875倍,则。
②容器Ⅱ平衡时的平衡常数。
(3)、汽车使用乙醇汽油并不能减少的排放,某研究小组在实验室中以耐高温试剂Ag-ZSW-5作为催化剂,测得NO转化为的平衡转化率随温度的变化情况如下图所示。
①在n(NO)/n(CO)=1条件下,最佳温度应控制在左右。
②用平衡移动原理解释加入CO后NO转化为的平衡转化率增大的原因:。
20. 下表是前20号元素中的部分元素的一些数据:A
B
C
D
E
F
G
H
I
J
原子半径(10-10m)
1.02
2.27
0.74
1.43
0.77
1.10
0.99
1.86
0.75
1.17
最高价态
+6
+1
-
+3
+4
+5
+7
+1
+5
+4
最低价态
-2
-
-2
-
-4
-3
-1
-
-3
-4
试回答下列问题:
(1)、以上10种元素电负性最大的是(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第周期,第族,其基态原子的核外电子排布式是。(2)、H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)。(3)、元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成个σ键,个π键。(4)、I与氢元素形成的10电子分子X的空间构型为;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为 , 其中X与Cu2+之间以键结合。(5)、下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a.。
b.。
(6)、如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为 , 若晶胞边长为a cm,则晶体的密度为(用含a、NA的代数式表示)(g/mL)。 21. 芳香烃A既可以合成扁桃酸也可以合成H。以下是合成线路(部分产物、反应条件已略去):
21. 芳香烃A既可以合成扁桃酸也可以合成H。以下是合成线路(部分产物、反应条件已略去):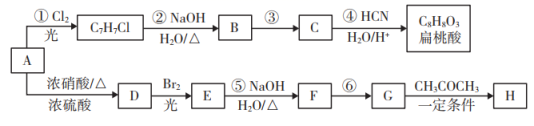
已知:
Ⅰ.R-CHO+HCN→
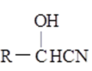
Ⅱ.
Ⅲ.
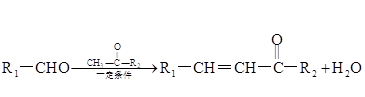
Ⅳ.D的苯环上连有两个对位取代基,相对分子质量为137
请回答下列问题:
(1)、扁桃酸中含氧官能团的名称是;物质B的结构简式为。(2)、上述①~⑥反应中属于取代反应的有。(3)、关于H物质,下列说法正确的是____(选填字母)。A、具有酸性 B、可以发生加成反应、聚合反应、氧化反应和还原反应 C、H与G都能与新制反应(4)、写出反应⑥的化学方程式:。(5)、X是扁桃酸的同分异构体,1molX可与2mol反应,其核磁共振氢谱有四组峰,峰面积之比为3∶2∶2∶1,其结构简式为(任写两种)。(6)、请结合所学知识和上述信息,写出由A和乙醛为原料(无机试剂任用)制备肉桂醛( )的合成路线图:。
)的合成路线图:。