四川省内江市2020-2021学年高一上学期期末检测化学试题
试卷更新日期:2021-12-24 类型:期末考试
一、单选题
-
1. 化学研究最重要的方法是( )A、观察法 B、实验法 C、推理法 D、计算法2. 化学与生产、生活及社会发展密切相关。下列有关说法错误的是( )A、司母戊鼎、飞机外壳和石灰石均属于合金 B、高纯度的硅单质广泛用于制作半导体材料和太阳能电池 C、铁盐和铝盐均可用于净水 D、利用焰色反应可制成节日烟花3. 国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿(CHCl3)等均可有效灭活病毒。对于上述有关药品,下列说法错误的是( )A、乙醇能与水以任意比例互溶 B、NaClO通过氧化灭活病毒 C、过氧乙酸摩尔质量为76 D、乙醚和氯仿均有毒,使用时应注意防护4. 下列有关实验操作的说法正确的是( )A、用容量瓶配制溶液时,摇匀后发现液面低于刻度线,立即加水至刻度线 B、进行分液操作时,先从分液漏斗上口倒出上层液体,后通过下端活塞放出下层液体 C、往沸水中滴加饱和氯化铁溶液制备氢氧化铁胶体时,要边滴溶液边搅拌防止溶液飞溅 D、蒸馏时温度计水银球应位于蒸馏烧瓶支管口处5. 下列叙述正确的是( )A、卤水点豆腐和静电除尘都应用了胶体聚沉的性质 B、溶液和胶体的本质区别是能否产生丁达尔效应 C、合金的熔点一般比组成成分的金属熔点低 D、树状分类法是唯一能表示物质分类的方法6. 下列组合正确的是( )
纯净物
混合物
电解质
非电解质
A
氯水
水煤气
NaCl
酒精
B
氢氧化钡
冰水混合物
冰醋酸
硫酸钡
C
胆矾
石灰水
KOH
二氧化碳
D
硫酸
碳素钢
盐酸
氮气
A、A B、B C、C D、D7. 下列实验装置或操作与微粒的大小无直接关系的是( )A、过滤 B、渗析
B、渗析 C、萃取
C、萃取 D、丁达尔效应
D、丁达尔效应 8. 某国外化学教材中有一张关于氧化还原反应的插图(如下图所示),由图可知
8. 某国外化学教材中有一张关于氧化还原反应的插图(如下图所示),由图可知 在该反应中( )
在该反应中( ) A、作氧化剂 B、被氧化 C、发生还原反应 D、是还原产物9. 下列物质既能与盐酸又能与氢氧化钠溶液反应的是( )A、Cu B、Fe2O3 C、Al2O3 D、Na2CO310. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、NaOH溶液:Na+、K+、CO、Al3+ B、FeSO4溶液:H+、Mg2+、Cl-、NO C、KHCO3溶液:Na+、Cl-、SO、CO D、H2SO4溶液:K+、Ba2+、NO、CH3COO-11. 如图所示,是某反应的微观示意图,下列有关说法正确的是( )
A、作氧化剂 B、被氧化 C、发生还原反应 D、是还原产物9. 下列物质既能与盐酸又能与氢氧化钠溶液反应的是( )A、Cu B、Fe2O3 C、Al2O3 D、Na2CO310. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、NaOH溶液:Na+、K+、CO、Al3+ B、FeSO4溶液:H+、Mg2+、Cl-、NO C、KHCO3溶液:Na+、Cl-、SO、CO D、H2SO4溶液:K+、Ba2+、NO、CH3COO-11. 如图所示,是某反应的微观示意图,下列有关说法正确的是( ) A、生成的物质都是氧化物 B、反应物都刚好完全反应 C、该反应的基本类型属于置换反应 D、反应方程式为2H2S+4O22SO3+2H2O12. 喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )
A、生成的物质都是氧化物 B、反应物都刚好完全反应 C、该反应的基本类型属于置换反应 D、反应方程式为2H2S+4O22SO3+2H2O12. 喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是( )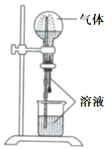
气体
溶液
A.
H2S
稀盐酸
B.
HCl
稀氨水
C.
NO
稀H2SO4
D.
CO2
饱和NaHCO3溶液
A、A B、B C、C D、D13. 下列离子方程式书写正确的是( )A、三氯化铁溶液中加入铁粉:Fe3++Fe=Fe2+ B、氯气通入水中:Cl2+H2O=2H++ClO-+Cl- C、氢氧化铜与稀盐酸反应:Cu(OH)2+2H+=Cu2++2H2O D、碳酸氢钠溶液与烧碱溶液混合:HCO+OH-=CO2↑+H2O14. 某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:① 混合物溶于水,得到澄清透明溶液;② 做焰色反应,通过钴玻璃可观察到紫色;③ 向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为( )A、KCl、NaCl B、KCl、MgSO4 C、KCl、CaCO3 D、MgSO4、NaCl15. 下列物质间的转化能通过一步反应实现的是( )A、NH3→NO B、Al2O3→Al(OH)3 C、SiO2→H2SiO3 D、Cu→Cu(OH)216. 对下列事实的原因分析正确的是( )选项
事实
原因
A
H2SO4是酸
H2SO4中含有氢元素
B
浓硝酸在光照下颜色变黄
浓硝酸具有挥发性
C
在蔗糖中加入浓硫酸后出现发黑现象
浓硫酸具有吸水性
D
用可溶性铝盐和氨水制备氢氧化铝
氢氧化铝碱性比氨水弱且很难与氨水反应
A、A B、B C、C D、D17. 除去下列物质中的杂质,所用试剂和方法正确的是( )选项
物质
杂质
除杂质所用试剂和方法
A
NaHCO3固体
Na2CO3
加热
B
KNO3
K2SO4
BaCl2溶液过滤
C
Cu
CuO
稀硫酸,过滤
D
CaCO3
CaO
盐酸,过滤
A、A B、B C、C D、D18. 设NA为阿伏加德罗常数的值,则下列叙述中正确的是( )A、25℃,101 kPa时,22.4 L氮气中含有原子数为2NA B、常温常压下,O2和O3的混合物共64 g,所含氧原子数目一定为4NA C、2.3gNa与O2完全反应,转移的电子数为0.2NA D、1mol/L的Na2CO3溶液中含2NA个Na+19. 某溶液中大量存在以下五种离子:MnO4-、、Fe3+、Na+、R,它们的物质的量之比为n(MnO4-):n():n(Fe3+):n(Na+):n(R)=2:2:1:2:1,则R可能( )A、Ag+ B、Fe2+ C、CO D、K+20. 亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2.酸性KMnO4溶液与亚硝酸钠反应的离子方程式为:MnO+NO+H+→Mn2++NO+H2O(未配平),下列叙述错误的是( )A、生成1 mol Mn2+ , 转移电子为5 mol B、该反应中氮元素被氧化 C、配平后,水的化学计量数为6 D、反应中氧化剂与还原剂的物质的量之比为2:521. 工业上冶炼钼的化学原理为①2MoS2+7O22MoO3+4SO2
②MnO3+2NH3·H2O=(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl
④H2MoO4MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。则下列说法中错误的是( )
A、MoS2煅烧产生的尾气不可以直接排到空气中 B、MoO3是金属氧化物,也是碱性氧化物 C、H2MoO4热稳定性差 D、利用H2、CO分别还原等量的MoO3 , 所消耗还原剂的物质的量之比为1:1二、填空题
-
22. 现有下列八种物质:
①稀硫酸 ②小苏打 ③水玻璃 ④二氧化碳 ⑤Na ⑥NaOH溶液 ⑦Na2O2 ⑧Al
(1)、上述物质中有两种物质在水溶液中反应的离子方程式为:H++OH-=H2O,这两种物质的序号是(填序号)。(2)、上述物质中有两种物质可用于呼吸面具或潜水艇中制备氧气,该反应的化学方程式是。(3)、上述物质中既能与HCl又能跟NaOH反应的物质是(填序号)。(4)、向③中通入CO2 , 会出现软而透明的凝胶胶体,其化学方程式是。(5)、②可用于治疗胃酸过多,其原理是(用离子方程式表示)。(6)、⑤需密封保存,其中一个目的是与水隔离,原因是(用化学方程式表示)。(7)、用18.4 mol/L的浓硫酸配制500 mL 0.5mol/L的①,所需主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要 , 定容时由于仰视刻度线,则对所配溶液浓度产生的影响为(填“偏大”、“偏小”或“无影响”)。23. 铁及其化合物在生产、生活中有着广泛的应用。(1)、钢(一种铁碳合金)是用量最大、用途最广的合金。钢的硬度比纯铁(填“大” 或“小”)。(2)、高铁酸钾(K2FeO4)是一种新型高效、无毒的多功能水处理剂,K2FeO4中Fe的化合价为。(3)、若一定量的普通铁粉和水蒸气在高温下反应生成44.8 LH2(标准状况),则转移电子的物质的量为mol。(4)、FeSO4可作补血剂,用于治疗缺铁性贫血症。用FeSO4溶液制备Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的目的是。(5)、印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,该反应的离子方程式为 , 检验反应后的溶液中是否还有三价铁离子的试剂是。(6)、聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4 , 含少量碳及二氧化硅)为原料制备的流程如下:
①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为。
②酸浸时,通入O2的目的是。
③“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+ , 再用酸性K2Cr2O7 , 标准溶液测定Fe2+的量(Cr2O被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是。
24. 氮氧化合物和二氧化硫是引起雾霾重要物质,工业用多种方法来治理。某种综合处理含NH废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
已知:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)、NO是色的气体,(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2 , NO2能与水发生化学反应,写出NO2与水反应的化学方程式为。(2)、SO2造成的一种常见的环境污染为。(3)、固体1的主要成分有Ca(OH)2、、(填化学式)。(4)、用NaNO2溶液处理含NH废水反应的离子方程式为。(5)、验证废水中NH已基本除净的方法是(写出操作现象与结论)。(6)、捕获剂捕获的气体主要是(填化学式)。(7)、流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,I2可以使淀粉溶液变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl固体。需选用的物质是(填序号)。①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
25. 新冠肺炎疫情期间,环境消毒是极其关键的,常常喷洒“84”消毒液,其有效成分为NaClO。实验室利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)、盛放浓盐酸的仪器名称是。(2)、a的作用是。(3)、b中采用的加热方式是 , c中发生反应的离子方程式是。(4)、d中可选用试剂____(填标号)。A、Na2SO3溶液 B、NaCl溶液 C、NaOH溶液 D、稀H2SO4(5)、反应结束后,取出b中试管,经冷却、结晶、、及干燥,得到KClO3晶体。(6)、取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变,2号试管溶液变为棕色,可知该条件下NaClO的氧化能力KClO3(填“大于”或“小于”)。(7)、已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常用水稀释100倍(体积之比)后使用。用水稀释后的溶液中c(Na+)=mol/L。(保留到小数点后两位)84消毒液
有效成分:NaClO
规格:100mL
质量分数:25%
密度:1.19g/cm3