陕西省宝鸡市金台区2021-2022学年高三第一次模拟检测化学试题
试卷更新日期:2021-12-24 类型:高考模拟
一、单选题
-
1. 化学推动着社会的进步和人类的发展。下列说法错误的是( )A、华为公司自主研发的“麒麟9000芯片”需要以高纯度的硅为原料 B、“半纤维素酶高效生产及应用关键技术”中半纤维素酶的主要成分是蛋白质 C、“废旧聚酯高效再生及纤维制备产业化集成技术”中聚酯是天然高分子有机物 D、“煤制烯烃大型现代煤化工成套技术开发及应用”中煤的气化属于化学变化2. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、7.8gNa2S和Na2O2的混合物中,含有的离子总数为0.3NA B、已知CrO5中Cr的化合价为+6价,则1molCrO5分子中过氧键的数目为NA C、1L1mol/LH2O2溶液完全反应,转移的电子数目一定为2NA D、常温下,pH=5的盐酸溶液中水电离出的H+数目为10-9NA3. 下列指定反应的离子方程式正确的是( )A、双氧水使酸性KMnO4溶液褪色:2MnO+5H2O2=2Mn2++5O2↑+6OH-+2H2O B、过量的铁粉溶于稀硝酸:Fe+4H++NO=Fe3++NO↑+2H2O C、用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O+5H2O=10H++2SO+8Cl- D、向NaAlO2溶液中通入过量CO2:2AlO+CO2+3H2O=2Al(OH)3↓+CO4. 用下列实验装置能达到相关实验目的的是( )
选项
A
B
C
D
实验装置

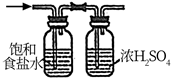

实验目的
用NaOH标准液滴定盐酸(锥形瓶中)
除去CO2气体中混有的HCl杂质
由CuSO4溶液制取胆矾
检查装置气密性
A、A B、B C、C D、D5. 已知有机物a、b、c的结构如图所示,下列说法正确的是( )(a)
 (b)
(b) (c)
(c) A、a、b、c均能与金属钠反应放出H2 B、含有相同官能团的c的同分异构体有7种(不考虑空间异构) C、1 mol a与1 mol CH3OH在一定条件下反应可生成1 mol b D、除去b中少量的a时,可加入NaOH溶液,振荡、静置、分液6. 原子序数依次增大的短周期主族元素W、X、Y、Z。X单质在空气中燃烧,火焰呈黄色,W的核外电子数与X、Z的最外层电子数之和相等,Y是地壳中含量排在第二位的元素,由W、X、Y三种元素形成的化合物M结构如图所示。下列叙述正确的是( )
A、a、b、c均能与金属钠反应放出H2 B、含有相同官能团的c的同分异构体有7种(不考虑空间异构) C、1 mol a与1 mol CH3OH在一定条件下反应可生成1 mol b D、除去b中少量的a时,可加入NaOH溶液,振荡、静置、分液6. 原子序数依次增大的短周期主族元素W、X、Y、Z。X单质在空气中燃烧,火焰呈黄色,W的核外电子数与X、Z的最外层电子数之和相等,Y是地壳中含量排在第二位的元素,由W、X、Y三种元素形成的化合物M结构如图所示。下列叙述正确的是( ) A、Y和Z元素简单氢化物的稳定性:Y>Z B、X与W形成的化合物的电子式为:
A、Y和Z元素简单氢化物的稳定性:Y>Z B、X与W形成的化合物的电子式为: C、X最高价氧化物对应水化物溶液可以用来吸收Z的单质
D、W、X、Z三种元素简单离子半径的大小顺序为:Z
C、X最高价氧化物对应水化物溶液可以用来吸收Z的单质
D、W、X、Z三种元素简单离子半径的大小顺序为:Z二、综合题
-
7. 俗名“大苏打”,是无色透明晶体,不溶于乙醇,易溶于水,在和时的溶解度分别为和212g。实验室常用与、共热制备 , 某兴趣小组拟用如下实验装置制备硫代硫酸钠。回答下列问题:
 (1)、属于填“纯净物”或“混合物” , 仪器a的名称。(2)、装置B中盛放的试剂是饱和溶液,下列属于装置B作用的是____。A、除去中混有的 B、观察的生成速率 C、用于观察装置否堵塞 D、用于除去A装置中挥发出的4(3)、在装置C中制备硫代硫酸钠时,有气体生成,写出该反应的化学方程式:。(4)、装置用于检验C中的吸收效率进而调整的流速,则D中盛装的试剂可以为填写一种即可。(5)、待反应结束后,从C中溶液获得的方法是:、、过滤、洗涤、干燥。其中洗涤时应选用做洗涤剂。(6)、测定粗产品中的含量。称取粗产品溶于水,用酸性溶液进行滴定假设杂质不与酸性溶液反应 , 当溶液中全部被氧化为达到滴定终点时,消耗高锰酸钾溶液40.00mL。则滴定达到终点时的现象是;产品中的质量分数为保留小数点后一位。8. 丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。回答下列问题。(1)、已知:I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) ∆H=-238 kJ·mol-1
(1)、属于填“纯净物”或“混合物” , 仪器a的名称。(2)、装置B中盛放的试剂是饱和溶液,下列属于装置B作用的是____。A、除去中混有的 B、观察的生成速率 C、用于观察装置否堵塞 D、用于除去A装置中挥发出的4(3)、在装置C中制备硫代硫酸钠时,有气体生成,写出该反应的化学方程式:。(4)、装置用于检验C中的吸收效率进而调整的流速,则D中盛装的试剂可以为填写一种即可。(5)、待反应结束后,从C中溶液获得的方法是:、、过滤、洗涤、干燥。其中洗涤时应选用做洗涤剂。(6)、测定粗产品中的含量。称取粗产品溶于水,用酸性溶液进行滴定假设杂质不与酸性溶液反应 , 当溶液中全部被氧化为达到滴定终点时,消耗高锰酸钾溶液40.00mL。则滴定达到终点时的现象是;产品中的质量分数为保留小数点后一位。8. 丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。回答下列问题。(1)、已知:I.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) ∆H=-238 kJ·mol-1II.2H2(g)+O2(g)=2H2O(g) ∆H=-484 kJ·mol-1
则丙烷脱氢制丙烯反应C3H8(g)⇌C3H6(g)+H2(g)的∆H为。
(2)、下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104 Pa和105 Pa)。
104 Pa时,图中表示丙烯的曲线是(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
(3)、一定温度下,向恒容密闭容器中充入1 mol C3H8 , 开始压强为p kPa,发生丙烷脱氢制丙烯反应。①下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是(填字母)。
A.该反应的焓变(∆H)保持不变 B.气体平均摩尔质量保持不变
C.气体密度保持不变 D.C3H8分解速率与C3H6消耗速率相等
②欲使丙烯的平衡产率提高,应采取的措施是 (填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
③为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则丙烷脱氢反应的平衡常数K (填“增大”、“减小”或“不变”),增大的值可提高丙烷的平衡转化率,解释其原因为。
(4)、丙烷脱氢制丙烯反应过程中,C3H8的气体体积分数与反应时间的关系如图a所示。此温度下该反应的平衡常数Kp=kPa(用含字母p(反应体系初始压强)的代数式表示,Kp是用反应体系中气体的分压表示的平衡常数,平衡分压=总压×物质的量分数)。 9. 孔雀石主要成分是 , 还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
9. 孔雀石主要成分是 , 还含少量 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
有关物质沉淀的pH数据如下:
物质
开始沉淀
完全沉淀
(1)、步骤Ⅰ加稀硫酸充分反应,过滤得到滤渣的主要成分是(填化学式),该物质进一步提纯后可用于制造。提高步骤Ⅰ反应速率的措施是(写一条即可)。(2)、步骤Ⅱ中试剂①应选用试剂 填代号 。a. b.稀 c.双氧水 d.氯水
相关反应的离子方程式为:。
(3)、步骤Ⅲ加入CuO调节溶液的pH至 (填写范围),目的是。(4)、步骤Ⅳ获得硫酸铜晶体的操作中,必须采取的实验措施是。(5)、常温下 的 , 若要将溶液中的 转化为 沉淀,使溶液中 降低至 , 必须将溶液调节至 。(6)、用 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的 可以产生 金属铜,则该反应的化学方程式为。