广东省广州市天河区2021-2022学年高三一模化学试题
试卷更新日期:2021-12-17 类型:高考模拟
一、单选题
-
1. 我国空间技术发展迅速,跻身世界先进国家行列。下列说法错误的是 ( )

“天问一号”火星探测器

“人造太阳”核聚变装置

“长征二号”运载火箭
 “中国天眼”射电望远镜
“中国天眼”射电望远镜A. 太阳能帆板实现光伏发电属原电池
B. 核聚变燃料、互为同位素
C. 扩散到空气中变为红棕色
D. 碳化硅陶瓷属于新型无机非金属材料
A、A B、B C、C D、D2. “化学,让生活更美好”。下列生产活动没有涉及化学变化的是( )A、研发可降解塑料,减少“白色污染” B、合成药物,让人类更健康 C、汽车尾气净化,让环境更宜居 D、风力发电,让能源更清洁3. 华夏文明源远流长,上下五千年,勤劳智慧的中国人民为人类文明进步做出了巨大贡献。下列说法正确的是( )A、四千余年前用谷物酿造出酒和醋,酒和醋的主要化学成分相同 B、商代后期铸造出工艺精湛的后母戊鼎,该鼎属于铜合金制品 C、汉代烧制出“明如镜、声如磬”的瓷器,其成分与水晶、玛瑙相同 D、屠呦呦用乙醚从青蒿中提取青蒿素,该操作过程为蒸馏4. “物质的性质决定其用途”。下列有关物质的性质与用途不对应的是( )A、受热易分解,可用作化肥 B、稀硫酸具有酸性,可用于除去铁锈 C、具有漂白性,可用于纸浆漂白 D、明矾溶于水形成胶体,可用于自来水厂净水5. 青蒿酸具有抗疟作用,结构简式如图所示。下列有关说法正确的是 ( ) A、属于芳香族化合物 B、分子式为 C、分子中所有碳原子可能处于同一平面 D、能使溴的四氯化碳溶液褪色6. 已知:一元弱酸HA的电离平衡常数K =。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
A、属于芳香族化合物 B、分子式为 C、分子中所有碳原子可能处于同一平面 D、能使溴的四氯化碳溶液褪色6. 已知:一元弱酸HA的电离平衡常数K =。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:化学式
CH3COOH
HCN
H2CO3
K
1.75×10–5
4.9×10–10
K1 = 4.4×10–7
K2 = 5.6×10–11
下列说法正确的是( )
A、稀释CH3COOH溶液的过程中,n(CH3COO–)逐渐减小 B、NaHCO3溶液中:c(H2CO3) < c() < c(HCO3−) C、25℃时,相同物质的量浓度的NaCN溶液的碱性强于CH3COONa溶液 D、向CH3COOH溶液或HCN溶液中加入Na2CO3溶液,均产生CO27. 部分常见含氯物质的分类与相应化合价关系如图所示。下列推断不合理的是 ( ) A、既可被氧化,也可被还原 B、的浓溶液可与的固体反应生成与 C、实验室可通过加热与的浓溶液制得 D、可存在的循环转化关系8. 实验室制备、纯化硝基苯需要用到下列装置,其中错误的是( )A、配置混酸
A、既可被氧化,也可被还原 B、的浓溶液可与的固体反应生成与 C、实验室可通过加热与的浓溶液制得 D、可存在的循环转化关系8. 实验室制备、纯化硝基苯需要用到下列装置,其中错误的是( )A、配置混酸 B、制备硝基苯
B、制备硝基苯 C、精制
C、精制 D、分离硝基苯
D、分离硝基苯 9. 宏观辨识与微观探析是化学学科核心素养之一、下列物质性质实验对应的离子方程式书写错误的是( )A、硅酸钠溶液和盐酸反应: B、硫酸铜溶液中加少量的铁粉: C、酸性碘化钾溶液中滴加适量双氧水: D、二氧化硫与酸性高锰酸钾溶液反应:10. 我国《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种新型“全氢电池”,能量效率可达。下列说法错误的是 ( )
9. 宏观辨识与微观探析是化学学科核心素养之一、下列物质性质实验对应的离子方程式书写错误的是( )A、硅酸钠溶液和盐酸反应: B、硫酸铜溶液中加少量的铁粉: C、酸性碘化钾溶液中滴加适量双氧水: D、二氧化硫与酸性高锰酸钾溶液反应:10. 我国《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种新型“全氢电池”,能量效率可达。下列说法错误的是 ( ) A、该装置将化学能转化为电能 B、离子交换膜不允许和通过 C、吸附层为负极,电极反应式为 D、电池总反应为11. 化合物ZYX4的结构如图所示,其中X、Y、Z是原子序数依次增大的短周期元素, X是周期表中原子半径最小的元素。下列叙述中错误的是 ( )
A、该装置将化学能转化为电能 B、离子交换膜不允许和通过 C、吸附层为负极,电极反应式为 D、电池总反应为11. 化合物ZYX4的结构如图所示,其中X、Y、Z是原子序数依次增大的短周期元素, X是周期表中原子半径最小的元素。下列叙述中错误的是 ( ) A、是短周期元素中金属性最强的元素 B、的最高价氧化物对应水化物呈弱酸性 C、与能形成使湿润的红色石蕊试纸变蓝的气体 D、化合物可能有强还原性12. 为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,所含溴原子的数目为 B、与足量的水反应生成 , 转移的电子数为 C、乙醇中含有的键的数目为 D、的溶液中含有的数目小于13. 化学是以实验为基础的科学。下列实验操作或做法能达到目的的是 ( )
A、是短周期元素中金属性最强的元素 B、的最高价氧化物对应水化物呈弱酸性 C、与能形成使湿润的红色石蕊试纸变蓝的气体 D、化合物可能有强还原性12. 为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,所含溴原子的数目为 B、与足量的水反应生成 , 转移的电子数为 C、乙醇中含有的键的数目为 D、的溶液中含有的数目小于13. 化学是以实验为基础的科学。下列实验操作或做法能达到目的的是 ( )选项
操作或做法
目的
A
在过氧化氢溶液中加入少量
加快的生成速率
B
用铂丝蘸取某溶液进行焰色反应,火焰呈黄色
证明该溶液溶质为钠盐
C
向稀盐酸中加入锌粒,将生成的气体通过浓硫酸
制取纯净的
D
用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝
证明该气体为
A、A B、B C、C D、D14. 一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法错误的是 ( )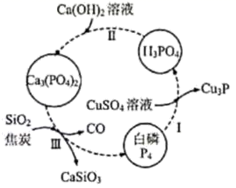 A、过程Ⅰ中,白磷既做氧化剂又做还原剂 B、过程Ⅱ中,发生复分解反应 C、过程Ⅲ中,反应的化学方程式为: D、理论上,通过本提纯工艺不会产生白磷损失15. 某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响。下列判断错误的是 ( )
A、过程Ⅰ中,白磷既做氧化剂又做还原剂 B、过程Ⅱ中,发生复分解反应 C、过程Ⅲ中,反应的化学方程式为: D、理论上,通过本提纯工艺不会产生白磷损失15. 某兴趣小组将下表中所给的混合溶液分别加入到6个盛有过量粒的反应瓶中,以研究硫酸铜的浓度对稀硫酸与锌反应生成氢气速率的影响。下列判断错误的是 ( )实验组别
混合溶液
30
饱和溶液/
0
0.5
2.5
5
20
10
0
A、 , , B、本实验利用了控制变量思想,变量为浓度 C、反应一段时间后,实验的金属表面可能呈现红色 D、该小组的实验结论是硫酸铜对稀硫酸与锌反应生成氢气有催化作用16. 室温下,用相同浓度的溶液,分别滴定浓度均为的三种酸、和溶液,滴定曲线如图所示。下列判断错误的是 ( )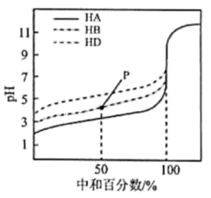 A、三种酸的电离常数关系: B、点时,溶液中: C、时,三种溶液中: D、当中和达时,溶液中:
A、三种酸的电离常数关系: B、点时,溶液中: C、时,三种溶液中: D、当中和达时,溶液中:二、实验题
-
17. CuCl2是常见的化学试剂,某学习小组利用废铜屑“湿法”制备CuCl2·2H2O。
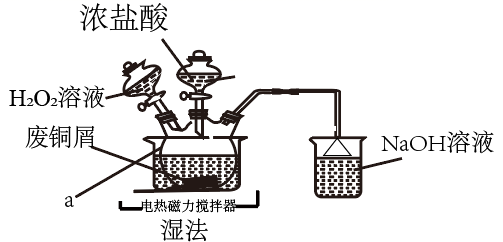
氯化铜在不同温度下结晶形成的结晶水合物
温度
以下
以上
结晶水合物
回答下列问题:
(1)、仪器的名称为 , 溶液的作用是。(2)、“湿法”制备的离子方程式为 , 实验中,的实际用量要大于理论用量,原因是。(3)、为得到纯净的晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入气体,加热蒸发浓缩, , 过滤,洗涤,低温干燥。其中,持续通入的作用是。(4)、用“间接碘量法”测定废铜屑的利用率。取所得试样溶于水配成 , 取出 , 向其中加入过量固体,充分反应,生成白色沉淀,滴入几滴淀粉溶液作指示剂,用标准溶液滴定,到达滴定终点时,消耗标准溶液。(涉及到的反应为: , )①滴定终点的判断:当滴入最后一滴标准液,溶液恰好(填颜色变化),且半分钟不再发生变化。
②废铜屑中铜的百分含量为。
(5)、查阅资料: , 等量黄色与蓝色混合呈绿色。设计实验证明溶液中存在上述平衡;取少量蓝色稀溶液于试管中,。三、综合题
-
18. 主要用作颜料、釉料及磁性材料,利用一种钴矿石(主要成分为 , 含少量、及铝、镁、钙等金属元素的氧化物)制取的工艺流程如图所示。

部分阳离子以氢氧化物形式沉淀时溶液
沉淀物
完全沉淀的
3.7
9.6
9.2
5.2
回答下列问题:
(1)、“溶浸”过程中,可以加快反应速率和提高原料利用率的方法是(写出一种即可),加入的作用是。(2)、“氧化”过程中金属离子与反应的离子方程式为 , 由此推测还原性:Fe2+Co2+(填“”或“”)。(3)、滤渣2的主要成分为(写化学式),检验铁元素的离子已被完全沉淀的实验操作及现象;取少量待测液于试管中,。(4)、已知某温度下 , 。该温度下,“沉淀除杂”时加入足量的溶液可将、沉淀除去,若所得滤液中 , 则滤液中为(保留2位有效数字)。(5)、在空气中充分煅烧,除得到产品外还产生了 , 则反应中与的化学计量数之比为。19. 我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。以、为原料合成涉及的主要反应如下:Ⅰ.
Ⅱ.
回答下列问题:
(1)、已知 , 请计算。(2)、在恒温恒容的容器中发生上述反应,下列说法正确的有____。A、气体平均摩尔质量保持不变,反应体系已达平衡 B、加入催化剂,可提高的平衡转化率 C、平衡后缩小体积增大体系压强,有利于提高产率 D、平衡后升高温度,反应Ⅱ的正反应速率增大、逆反应速率减小,平衡正移(3)、研究表明:其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性。使用该催化剂,将和在密闭容器中进行反应,的平衡转化率和甲醇的选择率(甲醇的选择率:转化的中生成甲醇的物质的量分数)随温度的变化趋势如图所示:
①温度为 , 经体系达到平衡,则的平均反应速率为 , 该温度下反应Ⅰ的平衡常数。
②随着温度的升高,的平衡转化率增加但甲醇的选择率降低,分析其原因。
(4)、研究表明,在电解质水溶液中,可以被电化学还原。两种不同催化剂、上电还原为的反应进程中(溶液中被还原为的反应也同时发生)相对能量变化如图。由此判断,电解质溶液中主要发生还原为反应的是(填或),理由是。 20. CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:(1)、Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为 , 其固体的晶体类型为。(2)、NH3、PH3、AsH3的沸点由高到低的顺序为(填化学式,下同),还原性由强到弱的顺序为 , 键角由大到小的顺序为。(3)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有mol,该螯合物中N的杂化方式有种。
20. CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:(1)、Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为 , 其固体的晶体类型为。(2)、NH3、PH3、AsH3的沸点由高到低的顺序为(填化学式,下同),还原性由强到弱的顺序为 , 键角由大到小的顺序为。(3)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有mol,该螯合物中N的杂化方式有种。 (4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
(4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。坐标
原子
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0.125

一个晶胞中有个Sn,找出距离Cd(0,0,0)最近的Sn(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有个。
21. 桥环化合物是指共用两个或两个以上碳原子的多环烃,广泛应用于药物合成。囧烷是结构类似我国汉字“囧”的一种桥环化合物,其合成路线如下: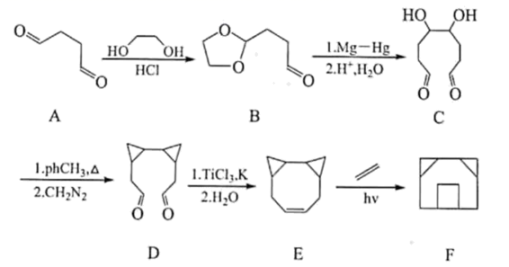 (1)、的名称是 , 中所含官能团名称为 , 的分子式为。(2)、、的反应类型分别是、。(3)、一定条件下,可以氧化为:
(1)、的名称是 , 中所含官能团名称为 , 的分子式为。(2)、、的反应类型分别是、。(3)、一定条件下,可以氧化为: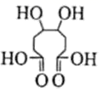 , 发生酯化反应可以形成分子内含有两个五元环的酯,该酯化反应的化学方程式为。 (4)、的同分异构体有很多种,写出同时满足下列条件的结构简式。
, 发生酯化反应可以形成分子内含有两个五元环的酯,该酯化反应的化学方程式为。 (4)、的同分异构体有很多种,写出同时满足下列条件的结构简式。①与溶液反应显紫色 ②该物质最多消耗
③核磁共振氢谱有4组峰,且峰面积比为
(5)、参照题中的合成路线并结合所学知识,以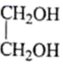 、
、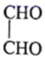 和为主要原料,设计
和为主要原料,设计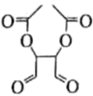 的合成路线。(其他无机试剂任选)
的合成路线。(其他无机试剂任选)
-