山东省东营市利津县(五四制)2021-2022学年九年级上学期期中化学试题
试卷更新日期:2021-12-08 类型:期中考试
一、单选题
-
1. 下列有关溶液的说法正确的是( )A、溶液是均一、稳定、无色的混合物 B、溶液中的溶质可以是固体、液体或气体一种或几种 C、饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液 D、洗涤剂能洗去衣服上的油污,原因是洗涤剂能溶解油污2. 对于30%的KNO3溶液,下列说法正确的是( )A、溶液中溶质和溶剂的质量比为3:10 B、每100g水中溶解30gKNO3 C、某种条件下,可转化为悬浊液 D、若再加30g硝酸钾,则变为60%KNO3溶液3. 在化学实验操作考查中,小阳同学抽到的考题是“配制50g质量分数为6%的氯化钠溶液”,小阳的实验操作与目的分析均正确的一组是( )
选项
实验操作
目的分析
A
称取氯化钠时,指针向右偏,调节游码至天平平衡
准确称量氯化钠质量
B
称取氯化钠时,将剩余的氯化钠放回原瓶
节约药品
C
量取水时,视线与量筒内凹液面最低处保持水平
准确读数
D
溶解氯化钠时,用玻璃棒搅拌
增大氯化钠的溶解度
A、A B、B C、C D、D4. 稀释浓硫酸并进行硫酸性质实验的下列操作,正确的是( )A、 稀释浓硫酸
B、
稀释浓硫酸
B、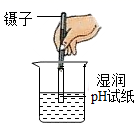 测稀硫酸的pH
C、
测稀硫酸的pH
C、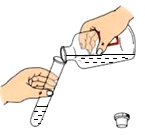 倾倒稀硫酸
D、
倾倒稀硫酸
D、 滴加稀硫酸
5. 某同学想用pH试纸测定一些物质的pH,下列做法能达到实验目的的是( )A、用干燥的pH试纸测定白醋的pH B、用干燥的pH试纸测定二氧化碳气体的pH C、用干燥的pH试纸测定98%的浓硫酸的pH D、用湿润的pH试纸测定0.4%的氢氧化钠溶液的pH6. 小明同学在复习阶段在笔记本上对化学知识进行了归纳整理,其中正确的个数是( )
滴加稀硫酸
5. 某同学想用pH试纸测定一些物质的pH,下列做法能达到实验目的的是( )A、用干燥的pH试纸测定白醋的pH B、用干燥的pH试纸测定二氧化碳气体的pH C、用干燥的pH试纸测定98%的浓硫酸的pH D、用湿润的pH试纸测定0.4%的氢氧化钠溶液的pH6. 小明同学在复习阶段在笔记本上对化学知识进行了归纳整理,其中正确的个数是( )①用广泛pH试纸测得某地下水的pH为5.2
②碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐
③用氯化钠固体配制6%的氯化钠溶液,量取水时,仰视量筒刻度使所配氯化钠溶液的质量分数偏低
④氢氧化铝能治疗胃酸过多,所以氢氧化钠也可以治疗胃酸过多
⑤能使无色酚酞溶液变红的一定是碱性溶液
⑥生成盐和水的反应一定是中和反应
⑦常温下,pH<7的溶液显酸性,因此pH<7的雨水一定都是酸雨
⑧浓盐酸和浓硫酸敞口放置一段时间,溶质质量分数都减小
A、2个 B、3个 C、4个 D、5个7. 按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便。下列各组物质中,符合“氧化物一酸一碱一盐”排列顺序的是( )A、HCl、Mg(OH)2、MgCl2、CO2 B、CO2、H2CO3、CaCO3、KOH C、H2O、HNO3、NH3▪H2O、Na2CO3 D、SO3、NaOH、Na2SO4、H2SO48. 向装有一定量盐酸的密闭隔热容器中,逐滴滴加氢氧化钠溶液,利用数字传感器测出反应时间与溶液温度的变化如图所示。下列说法正确的是( ) A、由该图像可知该反应先放热后吸热 B、a点所示溶液中,溶质只有NaCl C、b点表示盐酸和氢氧化钠溶液恰好完全反应 D、向70s时的溶液中滴加紫色石蕊溶液,溶液不变色9. 下列物质的性质与用途的对应关系错误的是( )
A、由该图像可知该反应先放热后吸热 B、a点所示溶液中,溶质只有NaCl C、b点表示盐酸和氢氧化钠溶液恰好完全反应 D、向70s时的溶液中滴加紫色石蕊溶液,溶液不变色9. 下列物质的性质与用途的对应关系错误的是( )选项
性质
用途
A
氢氧化钙呈碱性
改良酸性土壤
B
浓硫酸具有脱水性
干燥氧气
C
稀盐酸能与某些金属氧化物反应
除铁锈
D
氢氧化钠能与某些非金属氧化物反应
吸收二氧化硫
A、A B、B C、C D、D10. MgSO4的溶解度曲线如下图所示,欲使其60℃接近饱和的溶液变为饱和溶液,可采取的措施有( )
①增加溶质②蒸发溶剂③升高温度④降低温度
A、①②③ B、①②④ C、①② D、①②③④11. 为测定某石灰石样品中碳酸钙的质量分数,取一定质量的石灰石样品于烧杯中,将20g稀盐酸分4次加入样品中,充分反应后经过滤、干燥、称重,得实验数据如下:第一次
第二次
第三次
第四次
稀盐酸的用量/g
5.0
5.0
5.0
5.0
剩余固体的质量/g
1.5
1.0
0.5
0.3
已知石灰石中的杂质既不与盐酸反应,也不溶解于水。下列说法错误的是( )
A、第三次实验后碳酸钙无剩余 B、第三次实验后盐酸无剩余 C、实验中所取样品质量为2g D、样品中碳酸钙的质量分数是85%二、多选题
-
12. 可燃冰被科学家誉为“未来能源”、“21世纪能源”。“可燃冰”是一种天然气水合物,其中的主要化学成分是一种可燃气体一一—甲烷,所以它又被称为甲烷水合物。它的形成至少要满足三个条件,即温度、压力和原料。首先是温度不能太高,如果温度高于20℃,它就会受热分解从而“烟消云散”;其次,“可燃冰”在0℃时,只需30个标准大气压即可生成,并且压力越大,“可燃冰”就越不容易分解;最后,埋藏在海底的生物残体和有机腐殖质经细菌分解后产生甲烷气体,为“可燃冰”的形成提供了充足的原料。下列说法与文意相符的是( )A、“可燃冰”的形成并不容易 B、海底甲烷气体主要来自生物残体和有机腐殖质 C、“可燃冰”其实就是一种气体 D、在0℃且200米的海底可能会有“可燃冰”
三、填空题
-
13. 化学是与我们的生产和生活密切相关的学科。请将你选择的下列物质的化学式填在相应的空格内:
a.浓硫酸b.稀盐酸c.酒精d.氯化钠e.火碱f.熟石灰g.水h.生石灰
(1)、医用酒精中酒精占75%,其溶剂是;(2)、可用于除铁锈的是;(3)、生理盐水中的溶质是;(4)、可用于干燥二氧化碳气体的是;(5)、可用于改良酸性土壤的是;(6)、可用于厨房清洗油烟机的是;(7)、可作食品干燥剂的是;(8)、可用于检验二氧化碳的是。14. 如图是a、b、c三种固体物质(均不含结晶水)的溶解度曲线图。请根据图示回答下列问题: (1)、t℃时,溶解度由大到小是。(2)、P点表示。(3)、欲将c物质的饱和溶液变为不饱和溶液,可采用的方法是(填“降低”或“升高”)温度。(4)、20℃时,向30g物质a中加入50g水,充分溶解并恢复到原温度,所得溶液的质量为g。(5)、当b中混有少量a时,可用的方法提纯b。(6)、20℃时,用a、b、c三种固体配制等质量的饱和溶液,所需水的质量由大到小的顺序是。(7)、将t℃的a、b、c三种物质的饱和溶液降温至20℃,所得溶液中溶质的质量分数大小关系由大到小为。(8)、下列说法正确的是_____。A、P点可以表示在20℃时,a、c溶液的质量分数相等 B、P点可以表示20℃时b的不饱和溶液 C、c物质有可能是气体 D、将t℃时a、b的饱和溶液同时降温到20℃,析出晶体的质量是a>b
(1)、t℃时,溶解度由大到小是。(2)、P点表示。(3)、欲将c物质的饱和溶液变为不饱和溶液,可采用的方法是(填“降低”或“升高”)温度。(4)、20℃时,向30g物质a中加入50g水,充分溶解并恢复到原温度,所得溶液的质量为g。(5)、当b中混有少量a时,可用的方法提纯b。(6)、20℃时,用a、b、c三种固体配制等质量的饱和溶液,所需水的质量由大到小的顺序是。(7)、将t℃的a、b、c三种物质的饱和溶液降温至20℃,所得溶液中溶质的质量分数大小关系由大到小为。(8)、下列说法正确的是_____。A、P点可以表示在20℃时,a、c溶液的质量分数相等 B、P点可以表示20℃时b的不饱和溶液 C、c物质有可能是气体 D、将t℃时a、b的饱和溶液同时降温到20℃,析出晶体的质量是a>b四、综合题
-
15. “魔法世界,魅力化学”。在元旦的新年晚会上,同学们表演了多个魔术节目,很多魔术中运用了化学知识,请尝试对以下魔术进行揭秘。(1)、小明表演了一个小魔术:“矿泉水”变成“牛奶”、“雪碧”和“红酒”。

①“矿泉水”实际是石灰水,加入液体A后出现白色浑浊,形似牛奶,该过程发生反应的化学方程式为。
②“牛奶”中加入B,有大量气泡产生,变成雪碧,则B物质是。
③C是一种紫色的溶液,滴入“雪碧”中变为红色,则雪碧的组成显性(酸或碱)。
(2)、化学反应是一个变色的世界。图中B是铁锈的主要成分,BCD分属于不同类别的物质,蓝色溶液可用于配制农药波尔多液。
请回答:
①溶液X是。(填“酸”“碱”、“盐”)
②写出物质B与无色溶液X反应的化学方程式:。
③物质C的名称是 , 写出该反应的化学方程式。
16. 某化学实验小组欲探究盐酸、氢氧化钙的化学性质,取8支试管分别用A﹣H编号后,做如下实验. (1)、实验中观察到有气泡出现的试管是 , 有沉淀生成的试管是 .(2)、写出实验中无明显现象产生的试管中发生的化学方程式(3)、实验后某试管中为红色溶液,当向其中加入过量的后,溶液变为蓝色.由此推断,该试管中最初盛有的物质是 .(4)、实验后某试管的底部有白色固体,过滤后向滤液中滴加盐酸,一段时间后有气泡冒出,则该滤液中的溶质是17. 镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。如图是工业上提镁的流程,海水中镁元素的主要存在形式是MgCl2和MgSO4。
(1)、实验中观察到有气泡出现的试管是 , 有沉淀生成的试管是 .(2)、写出实验中无明显现象产生的试管中发生的化学方程式(3)、实验后某试管中为红色溶液,当向其中加入过量的后,溶液变为蓝色.由此推断,该试管中最初盛有的物质是 .(4)、实验后某试管的底部有白色固体,过滤后向滤液中滴加盐酸,一段时间后有气泡冒出,则该滤液中的溶质是17. 镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。如图是工业上提镁的流程,海水中镁元素的主要存在形式是MgCl2和MgSO4。 (1)、有项目研究团队研究问题:在海水提镁的过程中如何实现对镁元素的富集?团队成员提出观点如下。
(1)、有项目研究团队研究问题:在海水提镁的过程中如何实现对镁元素的富集?团队成员提出观点如下。观点A:直接往海水中加入沉淀剂。
观点B:高温加热蒸发海水后,再加入沉淀剂。
观点C:向晒盐后的苦卤水中加入沉淀剂。
通过分析比较,你认为观点(填“A”、“B”或“C”)最合理,简述理由:。
(2)、①“反应池”→…“中和”过程的主要作用为:使MgCl2转化为Mg(OH)2沉淀;Mg(OH)2再与盐酸反应转化为MgCl2 , 目的是。②反应池中,石灰乳应过量的目的是。
③“中和”时,Mg(OH)2与盐酸发生反应的化学方程式是。
(3)、在上述流程中,可循环使用的物质是。(4)、上述流程中涉及的主要反应类型属于分解反应的是_____(填字母)。A、煅烧贝壳(CaCO3)制取生石灰 B、电解熔融MgCl2制镁和Cl2 C、Cl2和H2反应生产氯化氢 D、用生石灰生产石灰乳五、计算题
-
18. 某市售过氧乙酸(化学式:C2H4O3),其标签上的部分文字说明如图。请回答:
 (1)、一瓶这种溶液中含过氧乙酸溶质质量为。(2)、0.5%的过氧乙酸溶液可以杀死细菌和新冠病毒。某医院需配制0.5%的过氧乙酸2kg,需要这种过氧乙酸的质量为多少?(请写出计算过程)19. 某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学测定该炉具清洁剂中氢氧化钠的含量。取100g炉具清洁剂倒入烧杯中,逐次加入质量分数为9.8%的稀硫酸,测出溶液的pH随加入稀硫酸的质量变化关系如图所示。完成下列问题:
(1)、一瓶这种溶液中含过氧乙酸溶质质量为。(2)、0.5%的过氧乙酸溶液可以杀死细菌和新冠病毒。某医院需配制0.5%的过氧乙酸2kg,需要这种过氧乙酸的质量为多少?(请写出计算过程)19. 某品牌炉具清洁剂的有效成分是氢氧化钠,化学兴趣小组的同学测定该炉具清洁剂中氢氧化钠的含量。取100g炉具清洁剂倒入烧杯中,逐次加入质量分数为9.8%的稀硫酸,测出溶液的pH随加入稀硫酸的质量变化关系如图所示。完成下列问题: (1)、当p=1时,溶液中所含的溶质是(填化学式)。(2)、当恰好中和时,消耗的稀硫酸的质量为。(3)、计算该炉具清洁剂中氢氧化钠的质量分数(写出计算过程)。
(1)、当p=1时,溶液中所含的溶质是(填化学式)。(2)、当恰好中和时,消耗的稀硫酸的质量为。(3)、计算该炉具清洁剂中氢氧化钠的质量分数(写出计算过程)。
-