黑龙江省2021-2022学年度上学期五校期中联考高二化学试卷
试卷更新日期:2021-12-07 类型:期中考试
一、选择题(本题包括15小题,每小题3分,共45分)
-
1. 为进一步提高合成氨的生产效率,下列最具开发价值的研究方向是( )A、研制高温下活性较大的催化剂 B、寻求氮气的新来源 C、研制低温下活性较大的催化剂 D、研制耐高温和高压的新材料建造合成塔2. 已知反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )A、升高温度,K增大 B、减小压强,n(CO2)增加 C、更换高效催化剂,α(CO)增大 D、充入一定量的氮气,n(H2)不变3. 下列措施对增大反应速率明显有效的是( )A、Al在氧气中燃烧生成Al2O3 , 将铝片改成铝粉 B、Fe与稀硫酸反应制取H2时,改用浓硫酸 C、在K2SO4与BaCl2两溶液反应时,增大压强 D、Na与水反应时增大水的用量4. 对于可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
 A、4v正(O2)=5v逆(NO)时,达到化学平衡状态 B、若单位时间内生成x mol NO的同时,消耗x mol NH3 , 则反应达到化学平衡状态 C、达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大 D、化学反应速率的关系为2v正(NH3)=3v正(H2O)5. 研究发现液态有机物是比较理想的储氢材料。甲苯储氢反应
A、4v正(O2)=5v逆(NO)时,达到化学平衡状态 B、若单位时间内生成x mol NO的同时,消耗x mol NH3 , 则反应达到化学平衡状态 C、达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大 D、化学反应速率的关系为2v正(NH3)=3v正(H2O)5. 研究发现液态有机物是比较理想的储氢材料。甲苯储氢反应 的能量变化如图所示:
的能量变化如图所示:

下列推断不正确的是( )
A、甲苯储氢反应的原子利用率为100% B、甲苯储氢反应是放热反应 C、该反应的正反应活化能大于逆反应活化能 D、加入催化剂,不会改变反应热6. 据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH CH3CHO,已知ΔH<0。据此你认为下列说法中正确的是( )A、该星球表面温度很高 B、该星球表面温度很低 C、低温下稳定性:CH2=CHOH>CH3CHO D、该反应中CH2=CHOH化学键断裂吸收的能量大于CH3CHO化学键形成放出的能量7. 下列对化学反应预测正确的是( )选项
化学反应方程式
已知条件
预测
A
M(s)=X(g)+Y(s)
ΔH>0
它是非自发反应
B
W(s)+xG(g)=2Q(g)
ΔH<0,自发反应
x可能等于1、2、3
C
4X(g+5Y(g)=4W(g)+6G(g)
能自发反应
ΔH一定小于0
D
4M(s)+N(g)+2W(l)=4Q(s)
常温下,自发进行
ΔH>0
A、A B、B C、C D、D8. 根据Ca(OH)2/CaO体系的能量循环图:
下列说法正确的是( )
A、ΔH5>0 B、ΔH1+ΔH2=0 C、ΔH3=ΔH4+ΔH5 D、ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=09. 一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1 , 则下列判断正确的是( )A、c1∶c2=3∶1 B、平衡时,Y和Z的生成速率之比为2∶3 C、X、Y的转化率不相等 D、c1的取值范围为0<c1<0.14 mol·L-110. 常压下羰基化法精炼镍的原理为Ni(s)+4CO(g) Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
A、增加c(CO),平衡向正向移动,反应的平衡常数增大 B、第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选50 ℃ C、第二阶段,Ni(CO)4分解率较低 D、该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)11. 已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),该反应是一个可逆反应,正反应是放热反应。若反应物的起始物质的量相同,下列关于该反应的示意图不正确的是( )A、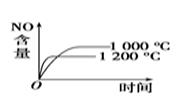 B、
B、 C、
C、 D、
D、 12. 某温度下某气体反应达到化学平衡,平衡常数 ,恒容时,若温度适当降低,F的浓度增加。下列说法中正确的是( )A、增大c(A)、c(B),K增大 B、降低温度,正反应速率增大 C、该反应的焓变为负值 D、该反应的化学方程式为2E(g)+F(g) A(g)+2B(g)13. 图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ所示。下列有关说法正确的是( )
12. 某温度下某气体反应达到化学平衡,平衡常数 ,恒容时,若温度适当降低,F的浓度增加。下列说法中正确的是( )A、增大c(A)、c(B),K增大 B、降低温度,正反应速率增大 C、该反应的焓变为负值 D、该反应的化学方程式为2E(g)+F(g) A(g)+2B(g)13. 图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ所示。下列有关说法正确的是( ) A、该反应的焓变ΔH=+234 kJ·mol-1 B、若X表示温度,则Y表示的可能是CO2的物质的量浓度 C、若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 D、若X表示反应时间,则Y表示的可能是混合气体的密度14. H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
A、该反应的焓变ΔH=+234 kJ·mol-1 B、若X表示温度,则Y表示的可能是CO2的物质的量浓度 C、若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 D、若X表示反应时间,则Y表示的可能是混合气体的密度14. H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )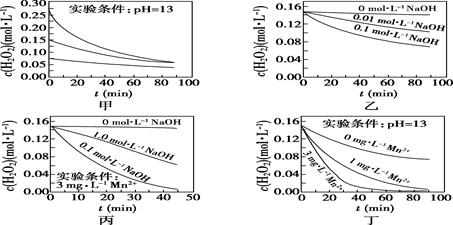 A、图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 B、图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 C、图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 D、图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大15. 某温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法错误的是( )
A、图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 B、图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 C、图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 D、图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大15. 某温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法错误的是( )物质
X
Y
Z
W
初始浓度/mol·L-1
0.5
0.6
0
0
平衡浓度/mol·L-1
0.1
0.1
0.4
0.6
A、反应达到平衡时,X的转化率为80% B、该反应的平衡常数表达式为 C、增大压强其平衡常数不变,但使平衡向生成Z的方向移动 D、改变温度可以改变该反应的平衡常数二、非选择题(本题包括5小题,共55分)
-
16. 某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液进行中和热的测定。
 (1)、Ⅰ.配制0.50 mol·L-1 H2SO4溶液
(1)、Ⅰ.配制0.50 mol·L-1 H2SO4溶液若配制250 mL H2SO4溶液,则需用量筒量取密度为1.84 g·cm-3、质量分数为98%的浓硫酸mL。
(2)、Ⅱ.测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示:仪器A的名称为。
(3)、写出表示该反应中和热的热化学方程式(中和热为57.3 kJ·mol-1):。(4)、取50 mL NaOH溶液和30 mL H2SO4溶液进行实验,实验数据如下表。实验
次数
起始温度t1/℃
终止温度t2/℃
温度差(t2-t1)/℃
H2SO4
NaOH
平均值
1
26.6
26.6
26.6
29.1
2
27.0
27.4
27.2
31.2
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
①温度差的平均值为℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 H2SO4溶液的密度都是1 g·cm-3 , 中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则测得的中和热ΔH=(取小数点后一位)。
③上述结果与-57.3 kJ·mol-1有偏差,产生此偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有H2SO4溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
17. 甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
温度
250 ℃
300 ℃
350 ℃
KⅠ
2.0
0.27
0.012
(1)、在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)=0.4 mol·L-1 , 计算可得此段时间的反应速率(用H2表示)为mol·L-1·min-1。(2)、由表中数据判断ΔH1(填“>”“<”或“=”)0;反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=(用ΔH1和ΔH2表示)。(3)、若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是(填字母)。a.充入CO,使体系总压强增大b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大d.使用高效催化剂
(4)、写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡(填“正向”“逆向”或“不”)移动,平衡常数KⅡ(填“变大”“变小”或“不变”)。(5)、比较这两种合成甲醇的方法,原子利用率较高的是反应(填“Ⅰ”或“Ⅱ”)。18. 雾霾严重影响人们的生活,雾霾的形成与汽车排放的 NOx等有毒气体有关。(1)、可以通过活性炭处理汽车尾气,原理为C(s)+2NO(g) N2(g)+CO2(g) ΔH<0。下列情况能说明该反应达到平衡状态的是________。
 A、2v正(NO)=v逆(CO2) B、在恒温、恒容的容器中,混合气体的压强保持不变 C、在绝热、恒容的容器中,反应的平衡常数不再变化 D、在恒温、恒压的容器中,混合气体的密度保持不变(2)、臭氧是理想的烟气脱硝试剂,原理为2NO2(g)+O3(g) N2O5(g)+O2(g) ΔH<0。
A、2v正(NO)=v逆(CO2) B、在恒温、恒容的容器中,混合气体的压强保持不变 C、在绝热、恒容的容器中,反应的平衡常数不再变化 D、在恒温、恒压的容器中,混合气体的密度保持不变(2)、臭氧是理想的烟气脱硝试剂,原理为2NO2(g)+O3(g) N2O5(g)+O2(g) ΔH<0。若在容积为10 L的密闭容器中进行该反应,起始时充入0.4 mol NO2、0.2 mol O3 , 反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①实验a从开始至平衡时的反应速率v(O3)=;实验c中NO2的平衡转化率为。
②与实验a相比,其他两组实验改变的条件分别是b , c。
③M点的逆反应速率 v(逆)(填“>”“<”或“=”)N点的正反应速率v(正)。
19. 工业上合成氨的原理为N2(g)+3H2(g) 2NH3(g) ΔH。(1)、已知H—H键的键能为436 kJ·mol-1 , N—H键的键能为391 kJ·mol-1 , N≡N键的键能是945.6 kJ·mol-1 , 则上述反应的ΔH=。(2)、若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(NH3)=3.5 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(H2)=4.5 mol·L-1·min-1;丁:v(NH3)=0.075 mol·L-1·s-1。若其他条件相同,温度不同,则温度由高到低的顺序是(填序号)。(3)、在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol,容器压强为8 MPa。则平衡常数Kp=(用平衡分压代替浓度计算,分压=总压×物质的量分数)。(4)、在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中各物质的浓度与反应时间t的关系如图所示。
①图中表示c(N2)t的曲线是。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度均为3 mol·L-1 , 则此时v正v逆(填“>”“<”或“=”)。
20. 氧和氮是大气的主要成分,氮的化合物在工业上均有重要的应用。(1)、根据下列反应写出由热化学循环在较低温度下由水分解制备氢气的热化学方程式:。H2SO4(aq)=SO2(g)+H2O(l)+O2(g)ΔH1=+327 kJ·mol-1
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq)ΔH2=-151 kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110 kJ·mol-1
(2)、在恒容密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),下列说法可以证明反应已达到平衡状态的是(填序号)。①单位时间内生成n mol N2的同时生成2n mol NH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是(填字母)。
A.及时移出氨B.适当增大压强C.循环利用和不断补充氮气
D.减小压强E.降低温度
(3)、电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g),副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g)。平衡混合气中N2与N2O含量与温度的关系如图,请解释在400~600 K时,平衡混合气中这两种气体的含量随温度的变化而改变的原因是。
 (4)、肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2 L的恒容密闭容器中充入2 mol N2H4 , 发生反应N2H4(g) N2(g)+2H2(g),(用x表示)与时间的关系如图所示,则该温度下,此反应的平衡常数K=。
(4)、肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。向2 L的恒容密闭容器中充入2 mol N2H4 , 发生反应N2H4(g) N2(g)+2H2(g),(用x表示)与时间的关系如图所示,则该温度下,此反应的平衡常数K=。