山东省泰安市东平县2021-2022学年九年级上学期期中化学试题
试卷更新日期:2021-12-01 类型:期中考试
一、单选题
-
1. 厨房中的下列物质:①食盐、②面粉、③植物油、④蔗糖、⑤食醋、⑥白酒,加入水中充分搅拌能得到溶液的一组是 ( )A、①③④⑤ B、②③④ C、①④⑤⑥ D、③④⑤⑥2. 将不饱和溶液转变为饱和溶液,最可靠的方法是( )A、升高温度 B、降低温度 C、增加溶剂 D、加入溶质3. 下列方法不宜用来淡化海水的是( )A、反渗透法 B、用滤纸过滤 C、闪蒸法 D、蒸馏法4. 下列洗涤方法中利用了乳化原理的是( )A、用洗洁精洗去餐具上的油污 B、用汽油洗去手上的油污 C、用酒精洗去试管中的碘 D、用稀盐酸清洗装过澄清石灰水的试剂瓶5. 下列利用海洋资源的做法不可取的是( )A、海水引入盐田进行晒盐 B、利用潮汐发电 C、合理开发利用海底矿物 D、工业废水直接排入海水中稀释6. 化学是一门以实验为基础的学科,下图所示的实验操作正确的是( )A、
 测定pH
B、
测定pH
B、 闻气体气味中
C、
闻气体气味中
C、 蒸发结晶
D、
蒸发结晶
D、 稀释浓硫酸
7. 下列物质露置于空气中,一段时间后,质量增加且只与空气中的水蒸气有关的是( )A、浓硫酸 B、澄清石灰水 C、浓盐酸 D、氢氧化钠8. 下列关于溶液的说法正确的是( )A、溶液都是无色的 B、溶液加水稀释前后溶质的质量不变 C、只有固体和液体可以作为溶质 D、均一、稳定的液体一定是溶液9. 下列有关固体溶解度的说法正确的是( )A、氯化钠的溶解度为36克 B、固体物质的溶解度都随温度的升高而增大 C、在一定温度下,搅拌不能改变硝酸钾的溶解度 D、20℃时,30克硝酸钾能溶解在100克水里,所以20℃时硝酸钾的溶解度是30克10. 生活中常见的柠檬汁、番茄汁等物质中都含有酸类物质,它们具有相似的化学性质,这是由于( )A、溶于水时都能电离出氢离子 B、溶液中都含有酸分子 C、组成中都含有氢元素 D、溶于水时都生成了盐酸11. 对“溶质的质量分数为20%的NaCl溶液”的含义,解释正确的是( )A、在该溶液中,溶质和溶剂的质量比为1:5 B、100克水中含有20克NaCl C、在该溶液中,溶质与溶液的质量比为1:6 D、50克该溶液中含有NaCl为10克12. 下列有关溶液酸碱性的说法错误的是( )A、pH=7的溶液呈中性 B、呈碱性的溶液一定是碱溶液 C、pH<7溶液一定呈酸性 D、酸溶液的pH越小酸性越强13. 如图所示,装置气密性良好,若想使∪形管中a端液面下降,b端液面上升,不能达到目的的选项是( )
稀释浓硫酸
7. 下列物质露置于空气中,一段时间后,质量增加且只与空气中的水蒸气有关的是( )A、浓硫酸 B、澄清石灰水 C、浓盐酸 D、氢氧化钠8. 下列关于溶液的说法正确的是( )A、溶液都是无色的 B、溶液加水稀释前后溶质的质量不变 C、只有固体和液体可以作为溶质 D、均一、稳定的液体一定是溶液9. 下列有关固体溶解度的说法正确的是( )A、氯化钠的溶解度为36克 B、固体物质的溶解度都随温度的升高而增大 C、在一定温度下,搅拌不能改变硝酸钾的溶解度 D、20℃时,30克硝酸钾能溶解在100克水里,所以20℃时硝酸钾的溶解度是30克10. 生活中常见的柠檬汁、番茄汁等物质中都含有酸类物质,它们具有相似的化学性质,这是由于( )A、溶于水时都能电离出氢离子 B、溶液中都含有酸分子 C、组成中都含有氢元素 D、溶于水时都生成了盐酸11. 对“溶质的质量分数为20%的NaCl溶液”的含义,解释正确的是( )A、在该溶液中,溶质和溶剂的质量比为1:5 B、100克水中含有20克NaCl C、在该溶液中,溶质与溶液的质量比为1:6 D、50克该溶液中含有NaCl为10克12. 下列有关溶液酸碱性的说法错误的是( )A、pH=7的溶液呈中性 B、呈碱性的溶液一定是碱溶液 C、pH<7溶液一定呈酸性 D、酸溶液的pH越小酸性越强13. 如图所示,装置气密性良好,若想使∪形管中a端液面下降,b端液面上升,不能达到目的的选项是( )选项
A
B
C
D
X
水
水
稀盐酸
水
Y
氢氧化钠固体
生石灰
镁
硝酸铵
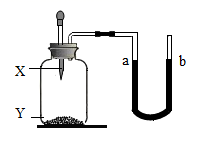 A、A B、B C、C D、D14. 下列溶液的pH最小的是( )A、使酚酞试液显红色的溶液 B、使石蕊试液显紫色的溶液 C、使石蕊试液显蓝色的溶液 D、使石蕊试液显红色的溶液15. 下列物质的名称、俗名与化学式完全对应的是( )A、氯化钠 苛性钠 NaCl B、碳酸氢钠 烧碱 NaHCO3 C、氧化钙 生石灰 CaO D、氢氧化钠 纯碱 NaOH16. 下列对实验意外事故的处理错误的是( )A、若不慎将腐蚀性药液溅入眼睛,要先用手揉眼睛,再立即用水冲洗 B、若不慎将烧碱溶液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 C、若不慎将燃着的酒精灯碰倒,洒出的酒精在桌上燃烧,应立刻用湿抹布扑盖 D、若不慎将浓硫酸沾到皮肤上应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液17. pH能定量描述溶液酸碱性的强弱。同学们对pH的含义有如下猜测,其中正确的是( )A、pH表示的是溶液中所含酸或碱的质量分数 B、pH与溶液中所含H+和OH-没有任何关系 C、pH与溶液中所含H+的数量成正比 D、pH大小与一定溶液中所含H+或OH-的数量多少有关18. 小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是( )
A、A B、B C、C D、D14. 下列溶液的pH最小的是( )A、使酚酞试液显红色的溶液 B、使石蕊试液显紫色的溶液 C、使石蕊试液显蓝色的溶液 D、使石蕊试液显红色的溶液15. 下列物质的名称、俗名与化学式完全对应的是( )A、氯化钠 苛性钠 NaCl B、碳酸氢钠 烧碱 NaHCO3 C、氧化钙 生石灰 CaO D、氢氧化钠 纯碱 NaOH16. 下列对实验意外事故的处理错误的是( )A、若不慎将腐蚀性药液溅入眼睛,要先用手揉眼睛,再立即用水冲洗 B、若不慎将烧碱溶液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 C、若不慎将燃着的酒精灯碰倒,洒出的酒精在桌上燃烧,应立刻用湿抹布扑盖 D、若不慎将浓硫酸沾到皮肤上应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液17. pH能定量描述溶液酸碱性的强弱。同学们对pH的含义有如下猜测,其中正确的是( )A、pH表示的是溶液中所含酸或碱的质量分数 B、pH与溶液中所含H+和OH-没有任何关系 C、pH与溶液中所含H+的数量成正比 D、pH大小与一定溶液中所含H+或OH-的数量多少有关18. 小深同学用思维导图梳理了Na2CO3的相关知识,其中描述错误的是( )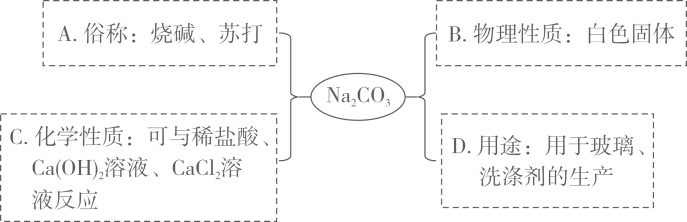 A、A B、B C、C D、D19. 现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示,下列判断正确的是( )
A、A B、B C、C D、D19. 现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示,下列判断正确的是( ) A、①中所得溶液一定是不饱和溶液 B、②③中所得溶液溶质的质量分数相等 C、若②中溶液升温到30℃,溶液的质量一定不变 D、若③中溶液恒温蒸发,溶质的质量分数一定变大20. 下列物质的分类,错误的一组是( )A、NaOH、Ca(OH)2、Fe(OH)2 都属于碱 B、HNO3、H2CO3、H2SO4 都属于酸 C、H2O、MgO、 CH3COOH 都属于氧化物 D、NaCl、Na2CO3、NaHCO3 都属于盐21. 通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。下面是小兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是( )A、打开盛有浓盐酸的试剂瓶瓶盖,瓶口有白烟产生 B、向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色 C、向氢氧化钠溶液中通入二氧化碳气体,产生白色沉淀 D、向氯化铁溶液中加入适量氢氧化钠溶液,产生红褐色沉淀22. 如图是室温下稀盐酸与氢氧化钾溶液反应过程中pH变化的曲线图。下列说法错误的是( )
A、①中所得溶液一定是不饱和溶液 B、②③中所得溶液溶质的质量分数相等 C、若②中溶液升温到30℃,溶液的质量一定不变 D、若③中溶液恒温蒸发,溶质的质量分数一定变大20. 下列物质的分类,错误的一组是( )A、NaOH、Ca(OH)2、Fe(OH)2 都属于碱 B、HNO3、H2CO3、H2SO4 都属于酸 C、H2O、MgO、 CH3COOH 都属于氧化物 D、NaCl、Na2CO3、NaHCO3 都属于盐21. 通过实验以及对实验现象的观察、记录和分析,可以发现和验证化学原理。下面是小兰同学在完成酸、碱的性质实验时记录的部分实验现象,其中正确的是( )A、打开盛有浓盐酸的试剂瓶瓶盖,瓶口有白烟产生 B、向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色 C、向氢氧化钠溶液中通入二氧化碳气体,产生白色沉淀 D、向氯化铁溶液中加入适量氢氧化钠溶液,产生红褐色沉淀22. 如图是室温下稀盐酸与氢氧化钾溶液反应过程中pH变化的曲线图。下列说法错误的是( ) A、图中X是稀盐酸 B、c点时,溶液中的K+个数大于Cl-个数 C、b点表示两溶液恰好完全反应 D、滴加方式是将稀盐酸滴入氢氧化钾溶液中23. 下列有关主题知识的归纳完全正确的一组是( )
A、图中X是稀盐酸 B、c点时,溶液中的K+个数大于Cl-个数 C、b点表示两溶液恰好完全反应 D、滴加方式是将稀盐酸滴入氢氧化钾溶液中23. 下列有关主题知识的归纳完全正确的一组是( )A:物质用途
B:元素之最
明矾:用于消毒杀菌
液氧:用于火箭中的燃料
海水中含量最多的元素:钠元素
空气中含量最多的元素:氮元素
C:物质鉴别
D:物质构成
水和酒精:闻气味或点燃
氮气和二氧化碳:通入澄清石灰水
水:由氢、氧原子构成
氯化钠:由钠离子、氯离子构成
A、A B、B C、C D、D24. 如图所示,甲、乙试管中分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一定质量的氢氧化钠固体后,下列分析正确的是( )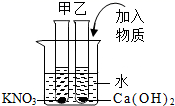 A、甲试管溶液中的溶质质量减少 B、甲试管中未溶解的固体质量增加 C、乙试管溶液中溶质质量增加 D、乙试管中未溶解的固体的质量增加25. 甲乙两个工厂排放的废水澄清透明,分别含有三种不同的离子,共有K+、Ba2+、Cu2+、OH-、 、 六种离子,其中甲厂废水呈碱性,则乙厂的废水中含有的离子是( )A、Ba2+、Cu2+、 B、K+、Ba2+、 C、K+、 、 D、Ba2+、Cu2+、K+
A、甲试管溶液中的溶质质量减少 B、甲试管中未溶解的固体质量增加 C、乙试管溶液中溶质质量增加 D、乙试管中未溶解的固体的质量增加25. 甲乙两个工厂排放的废水澄清透明,分别含有三种不同的离子,共有K+、Ba2+、Cu2+、OH-、 、 六种离子,其中甲厂废水呈碱性,则乙厂的废水中含有的离子是( )A、Ba2+、Cu2+、 B、K+、Ba2+、 C、K+、 、 D、Ba2+、Cu2+、K+二、综合题
-
26. 溶液对动植物的生理活动和人类的生产、科研活动具有重要意义。室温下,某同学欲配制50g质量分数为10%的氯化钠溶液,请回答下列问题:

 (1)、计算:需要氯化钠固体的质量是g。(2)、称量:①用如图所示的序号表示正确配制该溶液的操作顺序为。
(1)、计算:需要氯化钠固体的质量是g。(2)、称量:①用如图所示的序号表示正确配制该溶液的操作顺序为。②用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是(从下列中选用:10mL、50mL、100mL)。
③用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应。
A.增加适量氯化钠固体 B.减少适量氯化钠固体
C.调节游码 D.添加砝码
(3)、溶解:将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是。(4)、反思:经检测,所配制氯化钠溶液的溶质质量分数偏小,其原因可能是 。 (填序号)①用量筒量取水时,俯视读数 ②试剂、砝码的左右位置颠倒且使用游码
③用量筒量取水时,仰视读数 ④用于溶解的烧杯中有少量的蒸馏水
⑤转移溶液时有部分体溅出
27. 某化学兴趣小组开展的氢氧化钠性质系列探究活动如图1所示,回答下列问题: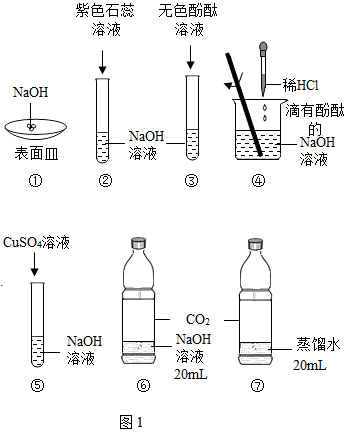 (1)、放置一会后,实验①观察到固体氢氧化钠表面变。(2)、实验②观察到紫色石蕊试液变成色。由此得出:碱溶液能使指示剂变色。(3)、实验④:
(1)、放置一会后,实验①观察到固体氢氧化钠表面变。(2)、实验②观察到紫色石蕊试液变成色。由此得出:碱溶液能使指示剂变色。(3)、实验④:Ⅰ.当滴加稀盐酸至溶液呈中性时,溶液显色;继续滴加稀盐酸并用玻璃棒不断搅拌,此时溶液中的溶质除酚酞外还有(填化学式)。
Ⅱ.如图2是氢氧化钠与盐酸反应的微观模拟示意图:

从微观的角度分析,中和反应的实质是。
(4)、实验⑤观察到的现象是 , 说明碱溶液能与某些盐反应。该反应的化学方程式为。(5)、实验⑥、⑦为用软矿泉水瓶所做的对比实验,装的软矿泉水瓶变瘪更明显,原因是。(用化学方程式表示)28. 室温下,同学们做了如图所示的探究影响物质溶解性的因素的实验,其中①试管和②试管的对比实验,发现②试管中固体可溶,①试管中固体几乎不溶。该对比实验说明了影响物质溶解性的因素是 , 同学们又补充了③试管所示实验,他们想探究的影响因素是。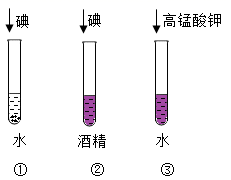
三、综合题
-
29. 如图是a、b、c三种固体物质的溶解度曲线,请回答下列问题:
 (1)、℃时,a、c两物质的溶解度相等,气体的溶解度随温度的变化规与(填“a”、“b”或“c”)相似(2)、若使a、c的饱和溶液同时析出晶体,方法是。(3)、请选择:在t2℃时,a、b、c三种饱和溶液降温至t1℃时溶质的质量分数由大到小的顺序是A、a>b>c B、b>a=c C、b>a>c(4)、在t2℃时,a、b、c三种饱和溶液降温至t1℃,析出晶体最多的是。(填“a”、“b”或“无法确定”)(5)、当a中混有少量的b时,提纯方法是。30. 构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
(1)、℃时,a、c两物质的溶解度相等,气体的溶解度随温度的变化规与(填“a”、“b”或“c”)相似(2)、若使a、c的饱和溶液同时析出晶体,方法是。(3)、请选择:在t2℃时,a、b、c三种饱和溶液降温至t1℃时溶质的质量分数由大到小的顺序是A、a>b>c B、b>a=c C、b>a>c(4)、在t2℃时,a、b、c三种饱和溶液降温至t1℃,析出晶体最多的是。(填“a”、“b”或“无法确定”)(5)、当a中混有少量的b时,提纯方法是。30. 构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题: (1)、如用湿润的pH试纸测定盐酸的pH,则结果会(填“偏大”、“偏小”、或“无影响”);(2)、图中①的现象是。(3)、图中性质④属反应(填基本反应类型)。(4)、图中⑤的性质在工业上可用于盐酸除铁锈,反应的化学方程式为。31. 在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示:
(1)、如用湿润的pH试纸测定盐酸的pH,则结果会(填“偏大”、“偏小”、或“无影响”);(2)、图中①的现象是。(3)、图中性质④属反应(填基本反应类型)。(4)、图中⑤的性质在工业上可用于盐酸除铁锈,反应的化学方程式为。31. 在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示: (1)、该温度下,实验①所得溶液是溶液(填“饱和”或“不饱和”)。(2)、该温度下,KCl的溶解度为。(3)、实验③所得溶液中溶质的质量分数约是(填选项序号)。A、40% B、37.5% C、28.6%(4)、现有溶质质量分数为10%的KCl的溶液200g,若配制成溶质质量分数为4%的KCl的溶液,问需要加水的质量是g。32. 我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大。
(1)、该温度下,实验①所得溶液是溶液(填“饱和”或“不饱和”)。(2)、该温度下,KCl的溶解度为。(3)、实验③所得溶液中溶质的质量分数约是(填选项序号)。A、40% B、37.5% C、28.6%(4)、现有溶质质量分数为10%的KCl的溶液200g,若配制成溶质质量分数为4%的KCl的溶液,问需要加水的质量是g。32. 我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大。 (1)、(海水淡化)采用如图1所示的膜分离法淡化海水,水分子可以通过淡化膜进入左侧的淡水池,从而得到淡水,下列说法中正确的是(选字母序号)。A、膜分离法也是一种分离混合物的方法 B、膜分离法的原理与滤纸过滤原理类似 C、加压后右侧海水中溶质的质量增大(2)、(粗盐提纯)除去难溶性杂质后的食盐水中还含有Mg2+、Ca2+和 ,为了得到较纯的氯化钠,进行如下流程的实验操作,
(1)、(海水淡化)采用如图1所示的膜分离法淡化海水,水分子可以通过淡化膜进入左侧的淡水池,从而得到淡水,下列说法中正确的是(选字母序号)。A、膜分离法也是一种分离混合物的方法 B、膜分离法的原理与滤纸过滤原理类似 C、加压后右侧海水中溶质的质量增大(2)、(粗盐提纯)除去难溶性杂质后的食盐水中还含有Mg2+、Ca2+和 ,为了得到较纯的氯化钠,进行如下流程的实验操作,
请填空:①加入过量的NaOH溶液;
②;
③;
④过滤;⑤加入适量稀盐酸;⑥蒸发。
在利用粗盐制备精盐过程的第⑤步操作中,加入适量稀盐酸的目的是。
(3)、(海水制镁)部分途径如图2,为了使海水中含量较低的镁元素富集,工业生产中通常向海水或卤水中加入(写化学式)使海水中的氯化镁转化为沉淀,此过程富集镁元素的同时也达到了的目的;Ⅳ处反应的化学方程式为。(4)、(海水制碱)氨碱法制纯碱是将饱和氨盐水在加压并不断通入二氧化碳的条件下使碳酸氢钠结晶析出,此过程发生反应的化学方程式是。(5)、(反思与评价)浩瀚的海洋将为我们全人类贡献丰富的资源。你还能从化学学科角度再说出一种你所知道的海洋资源吗?。四、计算题
-
33. 长期使用的热水锅炉会产生水垢。水垢主要成分是碳酸钙和氢氧化镁。某兴趣小组为了测定水垢中CaCO3的含量,将6g水垢粉碎放在烧杯中,然后向其中加入40g某浓度的稀盐酸,使之充分反应(水垢中除碳酸钙和氢氧化镁外都不与稀盐酸反应)。实验数据记录如下:
反应时间/min
0
1
2
3
4
5
6
7
8
烧杯内所盛物
质的总质量/g
46.0
45.2
44.8
45.1
44.1
43.9
43.8
43.8
43.8
试计算:
(1)、表中有一数据是不合理的,该数据的测得时间是第min;(2)、水垢中CaCO3的质量分数(计算结果精确至0.1%)。