辽宁省丹东市凤城市2021-2022学年第一学期高三化学期中检测试题
试卷更新日期:2021-11-30 类型:期中考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中, 只有一项符合题目要求。
-
1. 化学材料的使用对人类生活质量的提高和科技的发展有重要作用,下列说法正确的是( )A、生铁的含碳量为0.03%~2% B、“天和”核心舱电推进系统中的霍尔推力器腔体,使用的氮化硼陶瓷基复合材料属于无机非金属材料 C、T-碳是一种新型三维碳结构晶体,与C60互为同位素 D、“北斗三号”导航卫星使用的太阳能电池材料-砷化镓属于金属材料2. 分类法是化学学习的重要方法,下列说法正确的是( )
①冰水混合物属于纯净物,高分子化合物属于混合物
②CaCl2、NaOH、HCl、HT四种物质都是化合物
③0℃,101kPa,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L
④既能与酸反应又能与碱反应的氧化物属于两性氧化物
⑤AlCl3属于共价化合物,故AlCl3是非电解质;胆矾、苛性钠、冰醋酸、氧化钾均是电解质
⑥向新制氯水中加入碳酸钙粉末,能提高溶液中HClO的浓度
⑦1molBrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子的物质的量为1mol
⑧碘的升华、NaOH潮解、胶体渗析、氯化钠溶液导电、煤的干馏均属于物理变化
A、①④⑦⑧ B、 ③④⑤⑥⑧ C、②⑤⑥⑦. D、①③⑥3. 硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)说法正确的是( ) A、火山口附近的单质硫燃烧时可直接生成SO3 B、硫循环中硫的化合物均为无机物 C、硫酸盐在含硫杆菌及好氧/厌氧菌作用下被还原为R1-S-R2 D、烧煤时加石灰石,可减少酸雨及温室气体的排放4. 关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是( )A、K2H3IO6中I元素的化合价为+7价 B、HI在反应中只表现还原性 C、常温下,生成25.4g I2时,转移0.2mol电子 D、氧化产物与还原产物的物质的量之比为1:75. 下列说法不正确的是( )A、钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠 B、明矾 既可用作净水剂,也可用作消毒剂 C、青铜是我国使用最早的合金,钢是用量最大、用途最广的合金 D、铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属6. 二氧化硫可以与硫化氢发生归中反应:SO2+2H2S=2H2O+3S;硫单质有多种组成形式,如
A、火山口附近的单质硫燃烧时可直接生成SO3 B、硫循环中硫的化合物均为无机物 C、硫酸盐在含硫杆菌及好氧/厌氧菌作用下被还原为R1-S-R2 D、烧煤时加石灰石,可减少酸雨及温室气体的排放4. 关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是( )A、K2H3IO6中I元素的化合价为+7价 B、HI在反应中只表现还原性 C、常温下,生成25.4g I2时,转移0.2mol电子 D、氧化产物与还原产物的物质的量之比为1:75. 下列说法不正确的是( )A、钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠 B、明矾 既可用作净水剂,也可用作消毒剂 C、青铜是我国使用最早的合金,钢是用量最大、用途最广的合金 D、铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属6. 二氧化硫可以与硫化氢发生归中反应:SO2+2H2S=2H2O+3S;硫单质有多种组成形式,如 。下列有关说法中正确的是( ) A、还原性SO2>H2S B、O-H键的键能大于S-H键的键能,所以沸点:H2O>H2S C、S4、S6、S8形成的晶体均为共价晶体 D、SO2、H2S与H2O分子的空间构型均为V形7. 工业上制备下列物质的生产流程合理的是( )A、N2(g)NO(g)HNO3(aq) B、石英砂 粗硅 纯硅 C、饱和食盐水 漂白粉 D、
。下列有关说法中正确的是( ) A、还原性SO2>H2S B、O-H键的键能大于S-H键的键能,所以沸点:H2O>H2S C、S4、S6、S8形成的晶体均为共价晶体 D、SO2、H2S与H2O分子的空间构型均为V形7. 工业上制备下列物质的生产流程合理的是( )A、N2(g)NO(g)HNO3(aq) B、石英砂 粗硅 纯硅 C、饱和食盐水 漂白粉 D、 8. 实验室中下列做法和解释正确的是( )A、用煤油保存金属锂 B、配制一定物质的量浓度的溶液时,容量瓶未润洗,使所配溶液浓度偏低 C、用铁坩埚加热熔融NaOH固体 D、用pH试纸测饱和FeCl3溶液的pH值9. 能正确表示下列反应的离子方程式的是( )A、向BaCl2溶液中通入少量SO2气体:Ba2+ + SO2 + H2O= BaSO4↓ + 2H+ B、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
8. 实验室中下列做法和解释正确的是( )A、用煤油保存金属锂 B、配制一定物质的量浓度的溶液时,容量瓶未润洗,使所配溶液浓度偏低 C、用铁坩埚加热熔融NaOH固体 D、用pH试纸测饱和FeCl3溶液的pH值9. 能正确表示下列反应的离子方程式的是( )A、向BaCl2溶液中通入少量SO2气体:Ba2+ + SO2 + H2O= BaSO4↓ + 2H+ B、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4- + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
C、Fe2+溶液中滴入过量溴水:2Fe2+ + 2I- + 2Br2 = 2Fe3+ + I2 + 4Br - D、饱和碳酸钠溶液通入足量二氧化碳2Na+ + CO32- + CO2 +H2O = 2NaHCO3↓10. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、过量的铜与含0.2molHNO3的浓硝酸反应,转移电子的数目大于0.1NA B、100g质量分数46%的乙醇溶液中含有H-O键数目为NA C、标准状况下,11.2L的HF中所含分子数为0.5NA D、常温常压下,2molNO和1molO2的混合气体中,原子总数小于6NA11. 用下列装置进行相应实验,能达到实验目的的是( )



A.“随开随用、随关随停”制CO2
B.收集氨气的试管口处放置湿棉花,防止氨气与空气形成对流
C.用浓H2SO4干燥HCl气体
D.观察Fe(OH)2的生成
A、A B、B C、C D、D12. 短周期元素R、X、Y、Z、M原子序数依次递增,最外层电子数:3Z+M=X+Y,其中元素R、X、Y、M形成的化合物(结构式)具有如图所示转化关系。下列说法正确的是( )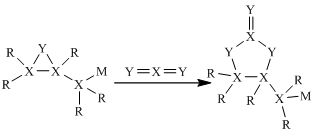 A、原子半径:M>Z>Y B、简单气态氢化物的沸点:Y>X C、X的最高价氧化物对应水化物为强酸 D、Z分别与R、X、Y、M形成的化合物中均只含离子键13. 常温下pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( )
A、原子半径:M>Z>Y B、简单气态氢化物的沸点:Y>X C、X的最高价氧化物对应水化物为强酸 D、Z分别与R、X、Y、M形成的化合物中均只含离子键13. 常温下pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如图所示:下列有关说法正确的是( )
 A、该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl
A、该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl 四种离子
B、实验消耗Cu14.4g,则生成气体丁的体积为3.36L
C、可用焰色试验确定原溶液中是否含有Na+ , 若含有Na+灼烧时火焰呈黄色,是因为激发态的电子跃迁至基态,若未见黄色火焰则无Na+
D、一定没有Fe3+ , 但是无法确定是否含有I-
14. 某实验小组探究氨气与氯气的反应,装置如图所示,在常温常压下将氨气收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K。如图连接好装置,将氨气压入反应管,充分反应后打开K,下列说法不正确的是( )
四种离子
B、实验消耗Cu14.4g,则生成气体丁的体积为3.36L
C、可用焰色试验确定原溶液中是否含有Na+ , 若含有Na+灼烧时火焰呈黄色,是因为激发态的电子跃迁至基态,若未见黄色火焰则无Na+
D、一定没有Fe3+ , 但是无法确定是否含有I-
14. 某实验小组探究氨气与氯气的反应,装置如图所示,在常温常压下将氨气收集在薄膜保鲜袋(无弹性)中,氯气收集在反应管中,关闭K。如图连接好装置,将氨气压入反应管,充分反应后打开K,下列说法不正确的是( )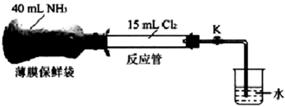 A、该反应原理可应用于检验输送氯气的管道是否泄漏 B、反应开始后,薄膜保鲜袋逐渐被吸入反应管中 C、打开K后,烧杯内的水会倒吸入反应管 D、反应过程中,反应管内气体颜色逐渐变浅,有白烟生成15. 下列有关测定中和反应反应热实验的说法正确的是( )A、用铜丝代替玻璃搅拌器,测得的△H偏小 B、强酸的稀溶液与强碱的稀溶液反应生成1mol H2O的△H均为-57.3kJ/mol C、已知冰的熔化热为6.0 kJ·mol-1 , 冰中氢键键能为20.0 kJ·mol-1 , 假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰中的氢键,则最多只能破坏1 mol冰中15%的氢键 D、若H2的燃烧热为a kJ·mol-1 , 则燃烧热的热化学方程式
A、该反应原理可应用于检验输送氯气的管道是否泄漏 B、反应开始后,薄膜保鲜袋逐渐被吸入反应管中 C、打开K后,烧杯内的水会倒吸入反应管 D、反应过程中,反应管内气体颜色逐渐变浅,有白烟生成15. 下列有关测定中和反应反应热实验的说法正确的是( )A、用铜丝代替玻璃搅拌器,测得的△H偏小 B、强酸的稀溶液与强碱的稀溶液反应生成1mol H2O的△H均为-57.3kJ/mol C、已知冰的熔化热为6.0 kJ·mol-1 , 冰中氢键键能为20.0 kJ·mol-1 , 假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰中的氢键,则最多只能破坏1 mol冰中15%的氢键 D、若H2的燃烧热为a kJ·mol-1 , 则燃烧热的热化学方程式H2(g)+Cl2(g)=2HCl(g) △H = -a kJ·mol-1
二、非选择题(本题共4小题,,共55分)
-
16. 人类的生活离不开化学反应,在关注反应物质变化的同时也要关注能量变化。(1)、Ⅰ.金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,氧气充足时燃烧生成二氧化碳,反应中放出的热量如图所示。

在通常状况下,(填“金刚石”或“石墨”)更稳定;石墨的燃烧热ΔH为
(2)、若12 g金刚石在24 g氧气中燃烧,生成气体36 g,则该过程放出的热量为。(3)、已知:N2、O2分子中化学键的键能分别是946 mol·L-1、497 mol·L-1 , N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1 , 综合上述有关信息请写出CO和NO反应生成两种无毒气体的热化学方程式:(4)、Ⅱ.Cl、C、Si在工业生产、生活中有重要应用用液氯消毒自来水会产生微量有机氯代物,危害人体健康,可使用二氧化氯(ClO2)代替液氯工业上以黄铁矿(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯。已知黄铁矿中的硫元素( 价)被氧化成SO42- , 制备二氧化氯的离子方程式为。
(5)、下列关于C、Si元素及化合物的说法中正确的是A、碳纳米材料包括:富勒烯、碳纳米管、石墨烯、炭黑 B、云母、沙土、宝石的主要成分为二氧化硅 C、工业制水泥、玻璃的主要原料中都有碳酸钙 D、实验室中氢氟酸能用玻璃瓶盛装但不能用玻璃塞 E、氮化硅熔点高,硬度大,电绝缘性好可用于制作坩埚、耐高温轴承、制作切削刀具17. 锆是冶金工业的“维生素”,它与氧族元素(O、S、Se、Te)形成的化合物在材料工业中应用广泛。其中碲化锆(ZrTe2)和硒化锆(ZrSe2)均为新型材料,氧化锆(ZrO2)具有特殊的热电性,氧化锆常用作陶瓷绝缘材料和陶瓷遮光剂。(1)、氧族元素各基态原子第一电离能随原子序数增大依次减小的原因为。(2)、Zr(ClO4)4是一种常见的锆盐,ClO4—的空间构型为 , 其中Cl原子的杂化方式为。(3)、如图为硒化锆的分子结构(图甲)和氧化锆的晶胞结构(图乙)。
①硒化锆的沸点远低于氧化锆,原因为 , 硒化锆和氧化锆的配位数分别为、。
②已知阿伏加德罗常数的值为NA , 据图乙中数据计算氧化锆的密度为g‧cm-3(用含NA和a的代数式表示,列式即可)
18. 次氯酸钠(NaClO)可用作消毒剂和医药工业中制氯胺。某实验小组同学在实验室制备次氯酸钠。回答下列问题:次氯酸钠的制备。装备如图所示(夹持装置略去)。

已知:用30%~35%的NaOH水溶液在低于10℃时吸收Cl2可制得NaClO。
(1)、按气流方向,各装置从左到右的连接顺序为a→(填接口处小写字母)(2)、盛放浓盐酸的仪器名称为;试剂X为。(3)、装置A中发生反应的离子方程式为。(4)、D装置的作用。(5)、实验过程中正确的操作顺序为(填序号,序号不重复使用)。a.按要求连接装置,检查装置气密性,盛装相应试剂
b.拆卸装置
c.打开K,鼓入一段时间空气
d.确保K关闭后,打开分液漏斗旋塞,滴加浓盐酸
(6)、上述操作c的目的是 , 拆卸装之前需观察到的现象为19. 实验室以活性炭为催化剂,用 CoCl2•6H2O 制取三氯化六氨合钴(Ⅲ)总反应2CoCl2+10NH3+2NH4Cl+H2O2 2[Co(NH3)6]Cl3+2H2O.制备流程如图:回答下列问题: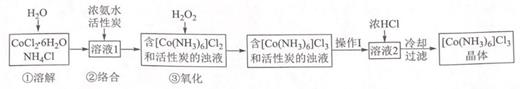 (1)、步骤①“溶解”需加热并使用研细的 CoCl2•6H2O,目的是(2)、步骤②“络合”需降温至 10℃进行,原因是(3)、步骤③“氧化”在 60℃进行。“操作Ⅰ”是已知:[Co(NH3)6]Cl3 在冷水中溶解度较小,在热水中溶解度较大。(4)、[Co(NH3)6]Cl3溶液中不存在的微粒间的作用力是A、离子键 B、共价键 C、金属键 D、配位键 E、分子间作用力 F、氢键(5)、用图装置测定产品中 NH3 的含量(已省略加热和夹持装置):
(1)、步骤①“溶解”需加热并使用研细的 CoCl2•6H2O,目的是(2)、步骤②“络合”需降温至 10℃进行,原因是(3)、步骤③“氧化”在 60℃进行。“操作Ⅰ”是已知:[Co(NH3)6]Cl3 在冷水中溶解度较小,在热水中溶解度较大。(4)、[Co(NH3)6]Cl3溶液中不存在的微粒间的作用力是A、离子键 B、共价键 C、金属键 D、配位键 E、分子间作用力 F、氢键(5)、用图装置测定产品中 NH3 的含量(已省略加热和夹持装置):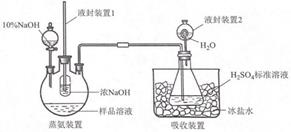
①蒸氨:取 m g 样品进行测定。添加药品后,加热三颈烧瓶,蒸出的 NH3 通入含有V1mLc1 mol•L﹣1H2SO4 标准溶液的锥形瓶中。
液封装置1的作用是
②滴定:将液封装置2中的水倒入锥形瓶后,滴定过剩的H2SO4 , 消耗V2mLC2mol•L﹣1的 NaOH 的标准液产品中 NH3 的质量分数为若未将液封装置 2 中的水倒入锥形瓶,测得 NH3 的质量分数可能(填“偏高”或“偏低”)。