广东省八校2021-2022学年高一上学期期中调研考试化学试题
试卷更新日期:2021-11-30 类型:期中考试
一、单选题
-
1. 氯化磷酸三钠 具有良好的洗涤、去污和消毒杀菌功能。下列关于氯化磷酸三钠分类正确的是( )A、混合物 B、氧化物 C、化合物 D、碱2. 下列不属于分散系的是( )A、纯碱 B、雾 C、食盐水 D、豆浆3. 下列物质的体积约为22.4 L的是( )A、标准状况下,1 mol H2O B、20 ℃、101 kPa时,36.5 g HCl C、常温常压下,17 g NH3 D、标准状况下,1 mol O24. 下列生活中的化学现象与氧化还原知识有关的是( )A、用食醋可以洗水垢 B、菜刀洗过后如果没擦干,放置一段时间就会出现斑点 C、蔗糖放在水中片刻后消失了 D、稀盐酸洒在大理石台面上产生大量气泡5. 下列叙述中,正确的是( )A、NaNO3固体不导电,所以NaNO3不是电解质 B、铜丝、石墨均能导电,所以它们都是电解质 C、SO2溶于水能导电,所以SO2是电解质 D、熔融的KCl能导电,所以KCl是电解质6. 下列有关钠及其化合物的叙述中,正确的是( )
①金属钠着火时用泡沫灭火器灭火
②二氧化碳通过 粉末,反应后固体物质增重
③切开的金属钠暴露在空气中,光亮表面逐渐变暗:
④ 用作呼吸面具的供氧剂
A、①③ B、②③④ C、②③ D、②④7. 下列变化过程中不涉及氧化还原反应的是( )A、氯化铁溶液中滴入氨水,溶液中出现红褐色沉淀 B、向 溶液中滴加KSCN溶液,不变色,滴加氯水后溶液显红色 C、向水中加入绿豆大小的金属钠,有无色气体生成 D、向包有 粉末的脱脂棉上滴几滴蒸馏水,脱脂棉燃烧8. 一定量金属钠及其在空气中的燃烧产物A分别加入到足量水中,生成的两种气体在一定条件下恰好完全反应,则与水反应的金属钠与被氧化成A的金属钠的质量比为( )A、1︰1 B、2︰1 C、23︰78 D、46︰789. 下列电离方程式错误的是( )A、Na2CO3=2Na++ B、Na2SO4=2Na++ C、H2SO4=2H++ D、KClO3=K++Cl-+3O2-10. 为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须( )A、除去铁锈 B、用盐酸清洗 C、彻底干燥 D、加点铁粉11. 下列离子方程式书写正确的是( )A、向 溶液中滴加 溶液至中性: B、向澄清石灰水中加入过量 溶液: C、铜片加入 溶液中: D、氧化亚铁悬浊液中加入稀盐酸:12. 下列实验结论与实验操作及现象相符的一组是( )选项
实验操作及现象
实验结论
A
分别向碳酸钠和碳酸氢钠固体中加入稀盐酸
有气泡产生的是碳酸氢钠固体
B
向紫色石蕊溶液中加入新制氯水,溶液先变红,随后褪色
新制氯水中含有氯气分子
C
向淀粉﹣KI溶液中通入氯气,溶液变成蓝色
氧化性:Cl2>I2
D
向某溶液中加入AgNO3溶液,有白色沉淀生成
该溶液中一定含有Cl-
A、A B、B C、C D、D13. 、 、 、 等已被发现,下列有关说法错误的是( )A、 的摩尔质量为 B、 、 、 均属于新发现的化合物 C、等物质的量的 与 中所含的分子数相等 D、等质量的 与 中所含的原子数相等14. 如图转化过程中错误的是( ) A、① B、② C、③ D、④15. 下列各组离子,在指定条件下能够大量共存的是( )A、饱和氯水:Cu2+、NO 、Na+、SO B、AlCl3溶液:Na+、CO 、SO 、NO C、(NH4)2Fe(SO4)2溶液:Na+、H+、Cl-、NO D、FeCl3溶液:Na+、SO 、SCN-、I-16. 侯德榜先生是我国现代化学工业的开拓者和奠基者,他于1943年发明的侯氏制碱法工艺流程如图所示:
A、① B、② C、③ D、④15. 下列各组离子,在指定条件下能够大量共存的是( )A、饱和氯水:Cu2+、NO 、Na+、SO B、AlCl3溶液:Na+、CO 、SO 、NO C、(NH4)2Fe(SO4)2溶液:Na+、H+、Cl-、NO D、FeCl3溶液:Na+、SO 、SCN-、I-16. 侯德榜先生是我国现代化学工业的开拓者和奠基者,他于1943年发明的侯氏制碱法工艺流程如图所示:
下列说法错误的是( )
A、该工艺中循环利用的物质为CO2和NH3 B、该工艺主产品是纯碱,副产品为NH4Cl C、“过滤”后的母液中,n(Na)小于n(Cl) D、该工艺中涉及化合反应、复分解反应和分解反应17. 工业上冶炼锡的第一步反应原理为 。下列说法中错误的是( )A、该反应中 被还原 B、a的值为3 C、反应后有两种氧化产物 D、每生成1个 转移的电子数为818. 用单位体积溶液里所含溶质的质量来表示溶液的组成,称为质量—体积浓度,单位为 。现有一种 时的 饱和溶液,密度为 ,质量—体积浓度为 。下列说法错误的是( )A、该溶液中溶质的质量分数为 B、该溶液中溶质的物质的量浓度为 C、 时,硫酸铜的溶解度为 D、 时,把 溶解于 水中恰好得到饱和溶液19. 将1.12 g铁粉加入25mL2mol⋅L-1氯化铁溶液中充分反应(忽略溶液体积变化),下列分析正确的是( )A、铁粉有剩余 B、Cl-浓度减小 C、向溶液中滴入无色KSCN溶液,溶液不变红 D、反应液质量增加1.12 g20. 设NA表示阿伏加德罗常数,下列说法正确的是( )A、1molCl2与足量Fe反应,转移的电子数为3NA B、1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 C、在标准状况下,22.4 LH2SO4所含的氧原子数目为4NA D、Na2O2与CO2反应生成11.2 L O2(标准状况),反应中转移的电子数为2NA二、综合题
-
21. “84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
84消毒液
(有效成分)NaClO
(规格)1000 mL
(质量分数)25%
(密度)1.20g/cm3
回答下列问题:
(1)、该“84消毒液”NaClO物质的量浓度约为(保留1位小数)。(2)、工业上用Cl2与浓氢氧化钠溶液反应制取“84消毒液”,请写出反应的化学方程式:。(3)、该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL该种“84消毒液”。下列说法错误的是_______(填字母)。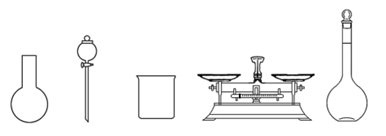 A、如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器 B、使用前要检查容量瓶是否漏液 C、容量瓶上标有容积、温度和浓度 D、需要称量NaClO固体的质量为149.0 g E、容量瓶用蒸馏水洗净后,须烘干后再使用(4)、一瓶上述“84消毒液”理论上能吸收空气中L的CO2 (标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)(5)、“84消毒液”与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因: , 某消毒小组人员用18mol·L-1的浓硫酸配制500mL3.6mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为mL。(6)、在配制过程中,下列操作中能使所配溶液的浓度偏高的有(填序号)。
A、如图所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器 B、使用前要检查容量瓶是否漏液 C、容量瓶上标有容积、温度和浓度 D、需要称量NaClO固体的质量为149.0 g E、容量瓶用蒸馏水洗净后,须烘干后再使用(4)、一瓶上述“84消毒液”理论上能吸收空气中L的CO2 (标准状况下)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)(5)、“84消毒液”与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因: , 某消毒小组人员用18mol·L-1的浓硫酸配制500mL3.6mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力,需取用浓硫酸的体积为mL。(6)、在配制过程中,下列操作中能使所配溶液的浓度偏高的有(填序号)。①用量筒量取98%的硫酸时俯视
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水
22. 实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题: (1)、A中盛有浓盐酸,B中盛有MnO2 , 写出反应的离子方程式:。(2)、E中为红色干布条,F中为红色湿布条,可观察到的现象是。对比E和F中现象的差异可得出的结论及解释是。(3)、试管C和D中试剂各为。(4)、装置G处发生反应的离子方程式为。(5)、用离子方程式表示试剂X的作用:。(6)、家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
(1)、A中盛有浓盐酸,B中盛有MnO2 , 写出反应的离子方程式:。(2)、E中为红色干布条,F中为红色湿布条,可观察到的现象是。对比E和F中现象的差异可得出的结论及解释是。(3)、试管C和D中试剂各为。(4)、装置G处发生反应的离子方程式为。(5)、用离子方程式表示试剂X的作用:。(6)、家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如下图。注意事项:
1.本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。
2.密封保存,请勿与洁厕灵同时使用。
3.保质期为一年
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:。