陕西省咸阳市泾阳县2021-2022学年高三上学期期中考试化学试题
试卷更新日期:2021-11-30 类型:期中考试
一、单选题
-
1. 2020年11月5日至10日第三届中国国际进口博览会展馆间,数字化产品迎面扑来,产品中用到了半导体材料,下列元素可作为半导体材料的是( )A、铁 B、硅 C、碘 D、铝2. 正确回收和利用物质能节约资源、保护环境。下列处理垃圾的方法正确的是( )A、回收废油脂制取食用油 B、从阳极泥中回收金、银等金属 C、回收医用塑料制取玩具 D、工业废水直接灌溉农田3. 下列变化不可能通过一步实验直接完成的是( )A、Al(OH)3 → Al2O3 B、Al2O3 → Al(OH)3 C、Al → AlO D、Al3+ → Al(OH)34. 《天工开物》中记载:凡铜供世用,出山与出炉只有赤铜。以炉甘石或倭铅参合,转色为黄铜,以砒霜等药制炼为白铜,矾、硝等药制炼为青铜。其中涉及的物质中熔点最高的是( )A、青铜 B、黄铜 C、赤铜 D、白铜5. 下列叙述I、Ⅱ正确且有因果关系的是( )
选项
陈述I
陈述Ⅱ
A
金属钠具有强还原性
金属钠可制作高压钠灯
B
是两性氧化物
可用作耐火材料
C
是碱性氧化物
可作红色油漆和涂料
D
明矾溶于水生成 胶体
明矾可作净水剂
A、A B、B C、C D、D6. 下列应用不涉及物质氧化性或还原性的是( )A、用Na2SiO3溶液制备木材防火剂 B、用漂白液杀菌、消毒 C、用葡萄糖制镜或保温瓶胆 D、用浸泡过高锰酸钾溶液的硅藻土保鲜水果7. 下列有关金属及其化合物的应用不合理的是( )A、五彩缤纷的焰火是金属元素的焰色反应所致 B、铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业 C、盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良 D、无水CoCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水8. 在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法中错误的是( ) A、该过程能说明钠的熔点比着火点低 B、上述反应是放热反应 C、上述反应中无水CuSO4表现了还原性 D、加热且无水条件下,Na可以与CuSO4反应并生成Cu9. 为了防止枪支生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: 。下列有关的叙述错误的是( )A、 的氧化性大于 的氧化性 B、反应中转移电子2mol,则生成还原产物0.5mol C、枪支“发蓝”实质上是使铁表面钝化导致难以生锈 D、上述反应中,单质铁被氧化,而NaNO2作为氧化剂10. 下列有关实验操作、现象和结论都正确的是( )
A、该过程能说明钠的熔点比着火点低 B、上述反应是放热反应 C、上述反应中无水CuSO4表现了还原性 D、加热且无水条件下,Na可以与CuSO4反应并生成Cu9. 为了防止枪支生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为: 。下列有关的叙述错误的是( )A、 的氧化性大于 的氧化性 B、反应中转移电子2mol,则生成还原产物0.5mol C、枪支“发蓝”实质上是使铁表面钝化导致难以生锈 D、上述反应中,单质铁被氧化,而NaNO2作为氧化剂10. 下列有关实验操作、现象和结论都正确的是( )选项
实验操作
现象
结论
A
过量的Fe粉中加入稀HNO3 , 充分反应后,滴入KSCN溶液
溶液呈红色
稀HNO3将Fe氧化为Fe3+
B
向溶液中加入少量酸性高锰酸钾溶液
紫色褪去
可证明溶液中不含Fe3+ , 可能含有Fe2+
C
Fe放入冷的浓硫酸中
无现象
铁不与浓硫酸反应
D
向硫酸亚铁溶液中加入氯水,再加入KSCN溶液
溶液变为红色
不能说明硫酸亚铁溶液中存在Fe3+
A、A B、B C、C D、D11. 利用如图装置进行Cl2制备及其化学性质的探究。下列说法错误的是( ) A、拉动a或b的活塞,可检查装置气密性 B、c中反应的氧化产物与还原产物的质量比为6:1 C、c中产生Cl2后,d褪色的原因是次氯酸具有漂白性 D、性质实验结束后,加入b中溶液除去多余的Cl2 , 溶液由红色变为无色12. 下列实验操作或相关说法合理的是( )
A、拉动a或b的活塞,可检查装置气密性 B、c中反应的氧化产物与还原产物的质量比为6:1 C、c中产生Cl2后,d褪色的原因是次氯酸具有漂白性 D、性质实验结束后,加入b中溶液除去多余的Cl2 , 溶液由红色变为无色12. 下列实验操作或相关说法合理的是( )A
B
C
D




混合浓硫酸和乙醇
充分振荡后下层为无色
蒸干 溶液制取无水
制备 胶体
A、A B、B C、C D、D13. 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。 下列关于海洋氮循环的说法正确的是 ( ) A、海洋中的氮循环起始于氮的氧化 B、海洋中的氮循环属于固氮作用的是③ C、海洋中的反硝化作用一定有氧气的参与 D、向海洋排放含NO3—的废水会影响海洋中NH4+的含量14. 某溶液中含H+、SO42-、NO3-三种离子,其中H+、SO42-的物质的量浓度分别为7.0 mol·L-1和2.0 mol·L-1。取该溶液20 mL,加入3.2 g铜粉,加热使它们充分反应,产生的气体在标准状况下的体积约为( )A、0.75 L B、0.336 L C、1.5 L D、0.448 L15. 根据装置和表内的物质(省略夹持净化以及尾气处理装置,图1中虚线框内的装置是图2),能完成相应实验目的的是( )
A、海洋中的氮循环起始于氮的氧化 B、海洋中的氮循环属于固氮作用的是③ C、海洋中的反硝化作用一定有氧气的参与 D、向海洋排放含NO3—的废水会影响海洋中NH4+的含量14. 某溶液中含H+、SO42-、NO3-三种离子,其中H+、SO42-的物质的量浓度分别为7.0 mol·L-1和2.0 mol·L-1。取该溶液20 mL,加入3.2 g铜粉,加热使它们充分反应,产生的气体在标准状况下的体积约为( )A、0.75 L B、0.336 L C、1.5 L D、0.448 L15. 根据装置和表内的物质(省略夹持净化以及尾气处理装置,图1中虚线框内的装置是图2),能完成相应实验目的的是( )
选项
a中的物质
b中的物质
实验目的、试剂和操作
实验目的
c中的物质
进气方向
A
浓氨水
碱石灰
收集氨气
饱和NH4Cl溶液
M→N
B
浓盐酸
MnO2
检验Cl2的氧化性
Na2S溶液
M→N
C
稀硝酸
Na2SO3
检验SO2的漂白性
品红溶液
N→M
D
稀硝酸
Cu
收集NO
水
N→M
A、A B、B C、C D、D16. 研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生光化学烟雾,其中部分反应历程如图所示。下列说法错误的是( ) A、整个过程中O3作催化剂和氧化剂 B、反应Ⅲ的方程式为 CH2=CHCH3 +2O3→HCHO+CH3CHO+2O2 C、光化学烟雾中含甲醛、乙醛等有机物 D、反应Ⅰ、反应Ⅲ均属于氧化还原反应
A、整个过程中O3作催化剂和氧化剂 B、反应Ⅲ的方程式为 CH2=CHCH3 +2O3→HCHO+CH3CHO+2O2 C、光化学烟雾中含甲醛、乙醛等有机物 D、反应Ⅰ、反应Ⅲ均属于氧化还原反应二、填空题
-
17. 钠及其化合物在自然界广泛存在,并有重要用途。(1)、写出过氧化钠中阴离子的电子式:。(2)、把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后排出气体,固体残留物中一定含有的物质是(填化学式)。(3)、熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1mol FeSO4参加反应转移4mol电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式:。(4)、将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。实验小组对该白色物质进行如下探究:
(提出假设)假设1:白色物质是Na2O;
假设2:白色物质是Na2CO3;
假设3:白色物质是Na2O和Na2CO3的混合物。
该小组对燃烧后的白色产物进行如下探究:
实验操作
实验现象
结论
方案一
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞溶液
溶液变成红色
白色物质为Na2O
方案二
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CuCl2溶液
出现白色沉淀
②静置片刻,取上层清液于试管中,滴加无色酚酞溶液
无明显现象
(思考与交流)
①通过方案1和方案2的实验,上述三个假设中,成立。钠在二氧化碳中燃烧的化学方程式为。
②有同学认为白色物质可能是氢氧化钠,你是否同意他的观点,简述理由:。
18. 疫情期间,某项目化学学习小组开展了对84消毒液使用安全性的研究。查找资料可知:①84消毒液有效成分为NaClO。含氯消毒剂中HCO的消毒效果远高于ClO- , 而ClO-的稳定性要高于HClO。
②HClO的K=2.0×10-8;H2CO3的K1=4.3×10-7 , K2=5.6×10-11。
请回答下列问题:
(1)、在84消毒液中滴加几滴酚酞试液,可观察到的现象是。(2)、通常购买的84消毒液pH在12左右,目的是增强消毒液的稳定性,试从平衡的角度分析原因。(3)、84消毒液必须避光密封保存,目的是防止与空气中的二氧化碳反应而变质,试写出该反应的离子方程式:。(4)、为了研究消毒效果,同学们测定了84消毒液中Cl2、HClO和ClO-三种微粒的物质的量分数随pH变化的关系,如图所示。
根据图示同学们认为在使用84消毒液时应调节pH在4~6范围内,试说明原因。
(5)、84消毒液还可作为水处理剂除去水中的杂质离子。例如过量次氯酸钠可使酸性废水中 完全转化为N2 , 请写出相应的离子反应方程式:。若处理废水产生了0.448LN2(标准状况),则需消耗有效氯为5%的84消毒液的质量为g。(“有效氯”指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,常以百分数表示)三、综合题
-
19. 随着现代工业发展,SO2烟气排放量急剧增加。将SO2还原为硫磺是目前烟气脱硫研究的热点。根据SO2的反应状态,将SO2还原法分为气相还原法和液相还原法。(1)、Ⅰ.气相还原法-固体还原剂直接还原法
固体还原剂直接还原法是指在一定温度下(200℃~300℃)将SO2烟气通过固体还原剂,使SO2中的氧原子转移到固体还原剂上,从而实现SO2的还原,其流程如图:

再生塔中生成的物质(填化学式)可在流程中循环使用。
(2)、脱硫塔中发生反应的化学方程式为。(3)、脱硫过程中,当产生48g单质S2时,转移电子的物质的量为mol。(4)、Ⅱ.液相还原法-液相催化歧化制硫法Petrusevski等人用 作为催化剂,在常温下,将NaHSO3进行液相催化回收硫磺的工艺如图:

仪器中,“操作”时不需要用到的是_______(填字母)。
A、 B、
B、 C、
C、 D、
D、 (5)、 催化NaHSO3的反应过程为:第一步:(用离子方程式表示),第二步: 。(6)、液相催化歧化制硫法具有反应条件温和、运行费用低等优点,然而其缺点是硫磺的回收率不会高于%(保留1位小数)。20. 锰及其化合物在生产生活中有许多用途。在实验室中模拟工业利用软锰矿(主要成分为MnO2 , 含少量SiO2、Fe2O3和Al2O3等)制备金属锰等物质,设计流程如下:
(5)、 催化NaHSO3的反应过程为:第一步:(用离子方程式表示),第二步: 。(6)、液相催化歧化制硫法具有反应条件温和、运行费用低等优点,然而其缺点是硫磺的回收率不会高于%(保留1位小数)。20. 锰及其化合物在生产生活中有许多用途。在实验室中模拟工业利用软锰矿(主要成分为MnO2 , 含少量SiO2、Fe2O3和Al2O3等)制备金属锰等物质,设计流程如下:
已知:Mn2+有较强的还原性,在空气中能被氧气氧化,碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如下表。
物质
Mn(OH)2
Fe(OH)2
Fe(OH)3
Al(OH)3
Ksp
10-13
10‑17
10-39
10-33
(1)、“酸浸”前需将软锰矿粉碎的目的是;酸浸过程MnO2发生反应的离子方程式为。(2)、向滤液I中需先加A物质,再加B物质,若加入的物质均为非金属化合物的溶液,则A为 , B为。滤渣I的成分是。(3)、“酸浸”需适宜的酸浓度、液固比、酸浸温度等,其中浸取率随酸浸时间的变化如图所示:
当浸取时间超过4h时,锰浸取率反而减小,其原因是。
(4)、加入B调节溶液pH,则PH的理论最小值为。(已知:当某种离子浓度小于1×10-5 mol/L时,可认为其沉淀完全。结果保留两位小数)(5)、“沉锰”过程中加入氨水的目的是(从化学平衡移动的角度解释)。(6)、写出由MnCO3和金属铝为原料制备金属锰的过程中所涉及的化学方程式:、。21. 长期缺碘和碘摄入过量都会对健康造成危害,目前加碘食盐中碘元素绝大部分以IO3-存在,少量以I-存在。现使用Na2S2O3对某碘盐样品中碘元素的含量进行测定。(1)、Ⅰ.I-的定性检测取少量碘盐样品于试管中,加水溶解,滴加硫酸酸化,再滴加数滴5%NaNO2和淀粉的混合溶液,若溶液变为色,则存在I- , 同时有无色气体产生(该气体遇空气变成红棕色)。试写出该反应的离子方程式为。
(2)、Ⅱ.硫代硫酸钠的制备工业制备硫代硫酸钠的反应原理为 ,某化学兴趣小组用上述原理实验室制备硫代硫酸钠如图:
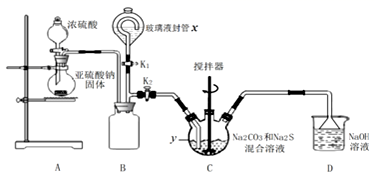
先关闭K3打开K2 , 打开分液漏斗,缓缓滴入浓硫酸,控制好反应速率。
y仪器名称 , 此时B装置的作用是。
(3)、反应开始后,C中先有淡黄色浑浊,后又变为澄清,此浑浊物为(填化学式)。装置D的作用是。(4)、实验结束后,关闭K2打开K1 , 玻璃液封管x中所盛液体最好为。(填序号)A NaOH溶液 B.浓硫酸 C 饱和NaHSO3溶液
(5)、Ⅲ.碘含量的测定已知:①称取10.00g样品,置于250mL锥形瓶中,加水100mL溶解,加2mL磷酸,摇匀。
②滴加饱和溴水至溶液呈现浅黄色,边滴加边摇,至黄色不褪去为止(约1mL)。
③加热煮沸,除去过量的溴,再继续煮沸5min,立即冷却,加入足量15%碘化钾溶液,摇匀。
④加入少量淀粉溶液作指示剂,再用0.0002mol/L的Na2S2O3标准溶液滴定至终点。
⑤重复两次,平均消耗Na2S2O3溶液9.00mL
相关反应为: , ,
请根据上述数据计算该碘盐含碘量为mg·kg-1。