安徽省江淮十校2021-2022学年高三上学期11月第二次联考化学试题.
试卷更新日期:2021-11-30 类型:月考试卷
一、单选题
-
1. 北宋科学家沈括所著的《梦溪笔谈》一书中总结了我国古代的许多科技成就,堪称“中国科学史的里程碑”。下列关于书中记载的相关说法正确的是( )A、“以磁石磨针锋,则锐处常指南”(《杂志一》)中磁石的主要材料为FeO B、“用胶泥刻字,薄如钱唇”(《技艺》)中的胶泥主要成分为 、 、CaO,均属于金属氧化物 C、“古方言云母粗服,则著人肝肺不可去”(《药议》)中云母的主要成分为铝硅酸盐 D、“古人以剂钢为刃,柔铁为茎千,不尔则多断折”(《沈卢、鱼肠》)中“剂钢”指的是铁的合金,其硬度比纯铁的大,熔点比纯铁的高2. 化学与生活、环境密切相关,下列有关说法正确的是( )A、麒麟9905G手机芯片主要成分是二氧化硅,一种新型无机非金属材料 B、PM2.5是指悬浮在空气中的粒子直径小于或等于2.5微米的可吸入颗粒物 C、传统烟花在制作时常添加含有铂、铁、钠、锶、钡等金属元素的发光剂,使其燃放时呈现美丽的颜色 D、新装修的室内常用活性炭来进行空气的净化杀菌,属于物理变化3. 2020年12月17日,嫦娥五号探测器携带着珍贵的月球“土特产”——月壤成功返回,研究表明月壤包含微细的矿物颗粒、岩石碎屑和玻璃质微粒等,主要由氧、硅、铝、铁、镁钙、钠、钾、钛等元素构成。下列相关化学用语正确的是( )A、 和 是氧的两种不同的同素异形体 B、 核外有m个电子、n个中子,X原子符号为 C、钾原子的原子结构示意图为:
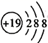 D、一种月壤辉长岩成分为 ,用氧化物的形式表示其组成为
4. 设 为阿伏加德罗常数的值。下列说法正确的是( )A、6.2g 和6.4g 中,中子数均为3.2 B、标准状况下,22.4mL 中含有的碳原子数为 C、2L0.5mol/L 溶液充分水解后,所得 胶粒的数目为 D、将氯气通入 溶液中,当有3 被氧化时,消耗标准状况下氯气33.6L5. 下列物质性质及用途说法错误的是( )A、氯化钙具有吸水性,所以常用作港口消雾剂 B、Al2O3和MgO熔点高,常被用作耐高温材料 C、铁铬、锰及其化合物为黑色金属材料,常被用于生产制造业 D、无水CoCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水6. “类推”这种思维方法在化学学习与研究中有时会产生不符合题意结论,因此类推的结论最终要经过实践的检验才能确定符合题意与否。下列几种类推说法叙述正确的是( )A、金属钠可以和盐酸反应产生氢气,金属铝也可以和盐酸反应产生氢气 B、 可溶于水形成碳酸,是碳酸的酸酐, 也可溶于水形成硅酸,是硅酸的酸酐 C、 可与 溶液反应生成 , 也可与 溶液反应生成 D、FeS和稀盐酸反应生成硫化氢,CuS也可以和稀盐酸反应生成硫化氢7. 能符合题意表示下列反应的离子方程式是( )A、向 溶液中加入过量 : B、向一定量 溶液中通入等量 : C、 溶于HI溶液: D、 溶于过量的NaOH溶液并加热:8. 甲是中学化学中常见单质,乙、丙为化合物。它们有如图所示转化关系(部分产物及反应条件已省略)。下列判断正确的是( )
D、一种月壤辉长岩成分为 ,用氧化物的形式表示其组成为
4. 设 为阿伏加德罗常数的值。下列说法正确的是( )A、6.2g 和6.4g 中,中子数均为3.2 B、标准状况下,22.4mL 中含有的碳原子数为 C、2L0.5mol/L 溶液充分水解后,所得 胶粒的数目为 D、将氯气通入 溶液中,当有3 被氧化时,消耗标准状况下氯气33.6L5. 下列物质性质及用途说法错误的是( )A、氯化钙具有吸水性,所以常用作港口消雾剂 B、Al2O3和MgO熔点高,常被用作耐高温材料 C、铁铬、锰及其化合物为黑色金属材料,常被用于生产制造业 D、无水CoCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水6. “类推”这种思维方法在化学学习与研究中有时会产生不符合题意结论,因此类推的结论最终要经过实践的检验才能确定符合题意与否。下列几种类推说法叙述正确的是( )A、金属钠可以和盐酸反应产生氢气,金属铝也可以和盐酸反应产生氢气 B、 可溶于水形成碳酸,是碳酸的酸酐, 也可溶于水形成硅酸,是硅酸的酸酐 C、 可与 溶液反应生成 , 也可与 溶液反应生成 D、FeS和稀盐酸反应生成硫化氢,CuS也可以和稀盐酸反应生成硫化氢7. 能符合题意表示下列反应的离子方程式是( )A、向 溶液中加入过量 : B、向一定量 溶液中通入等量 : C、 溶于HI溶液: D、 溶于过量的NaOH溶液并加热:8. 甲是中学化学中常见单质,乙、丙为化合物。它们有如图所示转化关系(部分产物及反应条件已省略)。下列判断正确的是( ) A、乙、丙一定是显中性的两种盐 B、甲有可能是一种金属单质 C、①、②两个反应一定是氧化还原反应 D、组成甲的元素的氧化物的水化物为强酸9. 用 晶体制取无水 的实验装置如图所示,下列说法错误的是( )
A、乙、丙一定是显中性的两种盐 B、甲有可能是一种金属单质 C、①、②两个反应一定是氧化还原反应 D、组成甲的元素的氧化物的水化物为强酸9. 用 晶体制取无水 的实验装置如图所示,下列说法错误的是( ) A、通入HCl可以抑制 的水解 B、先点燃酒精灯预热再打开分液漏斗活塞 C、硬质玻璃管内部右侧可能会出现白雾 D、d中上层为NaOH溶液,下层为10. 下列各组离子在指定环境中一定能大量共存的是( )A、使pH试纸显深红色的溶液中: 、 、 、 B、与铝粉反应放出氢气的无色溶液中: 、 、 、 C、pH=1的溶液中: 、 、 、 D、使红色石蕊试纸变蓝的溶液中: 、 、 、11. 科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法错误的是( )
A、通入HCl可以抑制 的水解 B、先点燃酒精灯预热再打开分液漏斗活塞 C、硬质玻璃管内部右侧可能会出现白雾 D、d中上层为NaOH溶液,下层为10. 下列各组离子在指定环境中一定能大量共存的是( )A、使pH试纸显深红色的溶液中: 、 、 、 B、与铝粉反应放出氢气的无色溶液中: 、 、 、 C、pH=1的溶液中: 、 、 、 D、使红色石蕊试纸变蓝的溶液中: 、 、 、11. 科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如图所示。下列说法错误的是( ) A、过程I得到的 是中间产物 B、过程II生成的W为LiOH C、反应III中能量转化的方式是化学能转变为电能 D、整个过程中锂的总量保持不变12. 用25mL0.1mol/L亚硫酸钠溶液还原含 mol 的溶液,过量的亚硫酸钠用0.1mol/L酸性高锰酸钾溶液氧化(其中高锰酸钾被还原为 ),共消耗高锰酸钾2mL,则元素X在还原产物中的化合价是( )A、+2 B、+3 C、+4 D、+513. 某实验小组实验室模拟硫酸盐加剧雾霾形成的原因:以空气或氮气为载体将按一定比例混合的 和 通入到盛有不同吸收液的集气瓶中测定生成的 含量,并将数据记录及分析如下:
A、过程I得到的 是中间产物 B、过程II生成的W为LiOH C、反应III中能量转化的方式是化学能转变为电能 D、整个过程中锂的总量保持不变12. 用25mL0.1mol/L亚硫酸钠溶液还原含 mol 的溶液,过量的亚硫酸钠用0.1mol/L酸性高锰酸钾溶液氧化(其中高锰酸钾被还原为 ),共消耗高锰酸钾2mL,则元素X在还原产物中的化合价是( )A、+2 B、+3 C、+4 D、+513. 某实验小组实验室模拟硫酸盐加剧雾霾形成的原因:以空气或氮气为载体将按一定比例混合的 和 通入到盛有不同吸收液的集气瓶中测定生成的 含量,并将数据记录及分析如下:集气瓶
载体
吸收液
含量
数据分析
1
氮气
蒸馏水
①
②≈④>①≈③
若开始不通 ,则最终检测不到
2
氮气
3%氨水
②
3
空气
蒸馏水
③
4
空气
3%氨水
④
下列说法错误的是( )
A、减少雾霾的有效途径是降低硫和氮的氧化物的排放 B、空气中的氧气对雾霾的形成无影响 C、可向反应后的集气瓶中加过量的 溶液,过滤、洗涤、干燥称量生成 的质量,得出 含量 D、集气瓶2中可能发生反应:14. 已知X、Y、Z、W、R是三个短周期的主族元素。Y和W同主族,Z被誉为“国防金属”,W的最外层电子数是其内层电子总数的一半,Z与R原子序数之和为29.则下列说法正确的是( )A、X与Y、Z、W。R均可形成共价化合物 B、Y与R形成的化合物水解后产生有刺激性气味的气体 C、简单离子半径:R>Z>Y D、Z与R形成的化合物溶于水后不存在15. 下列关于物质检验或除杂实验中,所采取的方法及其原理均正确的是( )选项
实验目的
实验方法
实验原理
A
除去 中的NaCl
蒸发浓缩冷却结晶
NaCl的溶解度随温度变化改变较大
B
除去 中的NO
将混合气体通过盛有水的洗气瓶
可与水反应
C
检验 和 中的
向混合溶液中滴加酸性高锰酸钾
可被高锰酸钾氧化
D
检验氯气已收集满
将湿润的淀粉-碘化钾试纸置于集气瓶口
氯气可将碘化钾氧化生成碘使试纸变蓝
A、A B、B C、C D、D16. 焦亚硫酸钠(Na2S2O3)为白色或黄色结晶粉末或小结晶,带有强烈的SO2气味,与强酸接触则放出SO2。研究表明,焦亚硫酸钠处理含铬(VI)废水较其他方法效果好,处理费用低。其工艺流程如下图所示,下列说法错误的是( ) A、反应池中发生反应的离子方程式为:3S2O +2Cr2O +10H+=6SO +4Cr3++5H2O B、在实际工业中pH过低,则需要的焦亚硫酸钠的量比理论值小 C、硫酸加入的量不宜过大,否则会消耗过多的石灰乳造成浪费 D、Cr(OH)3淤泥中还含有CaSO4、Ca(OH)2等物质
A、反应池中发生反应的离子方程式为:3S2O +2Cr2O +10H+=6SO +4Cr3++5H2O B、在实际工业中pH过低,则需要的焦亚硫酸钠的量比理论值小 C、硫酸加入的量不宜过大,否则会消耗过多的石灰乳造成浪费 D、Cr(OH)3淤泥中还含有CaSO4、Ca(OH)2等物质二、综合题
-
17. X、Y、Z、W、R为原子序数依次增大的前20号主族元素,且分属于四个周期。Y的最外层电子数是电子层数的3倍,Z、W为同周期相邻元素,Y、W可形成如图所示的离子,R原子核外无未成对电子。回答下列问题:
 (1)、Z在周期表中的位置是 , 第七周期与Z同族元素的原子序数为。(2)、Z、W、R离子半径由大到小顺序为(用化学式表示)。(3)、用电子式表示X与R组成的物质的形成过程。(4)、Y、W的简单氢化物沸点较高的是(填化学式),判断依据是。(5)、写出图中离子与稀硫酸反应的离子方程式。18. 元素的价一类二维图是我们学习元素及其化合物相关知识的重要模型和工具,也是发展证据推理与模型认知这一化学学科核心素养的重要途径。如图为铁和氯两种元素的价-类二维图,其中箭头表示部分物质间的转化关系。
(1)、Z在周期表中的位置是 , 第七周期与Z同族元素的原子序数为。(2)、Z、W、R离子半径由大到小顺序为(用化学式表示)。(3)、用电子式表示X与R组成的物质的形成过程。(4)、Y、W的简单氢化物沸点较高的是(填化学式),判断依据是。(5)、写出图中离子与稀硫酸反应的离子方程式。18. 元素的价一类二维图是我们学习元素及其化合物相关知识的重要模型和工具,也是发展证据推理与模型认知这一化学学科核心素养的重要途径。如图为铁和氯两种元素的价-类二维图,其中箭头表示部分物质间的转化关系。 (1)、价-类二维图中①、②处应分别填、。(2)、从物质分类角度分析,实验室常用的制取③的化学方程式为;物质的量均为1mol的③和④充分反应转移电子数为。(3)、从化合价角度看, 具有(填字母序号),并由此写出 与NaOH反应生成等物质的量的氧化产物与还原产物的离子方程式:。
(1)、价-类二维图中①、②处应分别填、。(2)、从物质分类角度分析,实验室常用的制取③的化学方程式为;物质的量均为1mol的③和④充分反应转移电子数为。(3)、从化合价角度看, 具有(填字母序号),并由此写出 与NaOH反应生成等物质的量的氧化产物与还原产物的离子方程式:。A.氧化性 B.还原性 C.既有氧化性、又有还原性
(4)、聚合碱式氯化铝铁[ ]即PAFC是一种新型的无机高分子絮凝剂。配料主要成分: 、 、FeO、 等,制取PAFC的实验流程如下,“聚合”过程的离子方程式为:。 19. 磺酰氯( )可用作杀虫剂、医药品表面活性剂等,通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也可分解。某化学兴趣小组以活性炭为催化剂,利用 和 模拟磺酰氯的制备并进行产品含量的测定,所用装置如图所示(其余夹持装置已省略)。
19. 磺酰氯( )可用作杀虫剂、医药品表面活性剂等,通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也可分解。某化学兴趣小组以活性炭为催化剂,利用 和 模拟磺酰氯的制备并进行产品含量的测定,所用装置如图所示(其余夹持装置已省略)。 (1)、I. 的制备
(1)、I. 的制备仪器a的名称为 , 若想得到干燥纯净的 和 ,则制备过程中B、E中依次盛放的药品是、。
(2)、实验开始时,需向冷凝管中通入冷却水,冷却水应从((填“上”或“下”)口进入冷凝管,写出磺酰氯在潮湿空气中“发烟”的化学方程式:。(3)、干燥管G中应选用 , 其作用是 , 。(4)、II. 含量的测定称量ag 粗品(假定杂质不参加反应),加水充分反应后,再向其中加入足量的氢氧化钡溶液,经过滤、洗涤、干燥后,称量生成的沉淀质量为bg。则该粗品中 的质量分数为%(用含a、b的代数式表示)。
20. 某实验小组利用菱锰矿(主要成分为 ,还有少量Fe、Al等元素)制备高纯度碳酸锰的工艺流程如下:
相关金属离子形成氢氧化物沉淀的pH如下:
金属离子
开始沉淀的pH
1.5
6.3
3.8
8.8
沉淀完全的pH
2.8
8.3
5.2
10.8
回答下列问题:
(1)、“焙烧”时通常将菱锰矿和氯化铵混合研磨,其作用是。(2)、“浸出”过程中,分离浸出液和浸出渣操作中不需要用到的仪器有___________(填字母序号)。A、烧杯 B、表面皿 C、玻璃棒 D、分液漏斗 E、漏斗(3)、“净化除杂”时需分批向浸出液中加入 ,其作用是。(4)、“碳化结晶”过程中发生的离子反应方程式为: , 不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是。(5)、“过滤”后,证明碳酸锰产品已经洗涤干净的操作是。(6)、整个流程中能够循环利用的固体物质是。21. 烟道气(主要含空气、粉尘、水蒸气、 等)中的 是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:(1)、I.采样:
采样步骤:①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
A中装有无碱玻璃棉,其作用是。
(2)、C中填充的干燥剂是___________(填字母序号)。A、碱石灰 B、无水 C、(3)、采样步骤②加热烟道气的目的是。(4)、II.NOx含量的测定将VL气样通入适量酸化的 溶液中,使NOx完全被氧化为硝酸根离子,加水稀释至100.00mL。量取20.00mL该溶液,加入V1mLc1mol/L过量的 标准溶液( ),充分反应后,用c2mol/ 标准溶液滴定剩余的 ,终点时平均消耗V2mL。
NO被 氧化为 的离子方程式是。
(5)、若气样中NOx按 计算,则 的含量为(6)、判断下列情况对NOx含量测定结果的影响(填“偏高”“偏低”或“无影响”),若缺少采样步骤③,会使测试结果;若 标准溶液部分变质,会使测定结果。