广东省深圳市龙岗区2021-2022学年高三上学期期中质量监测化学试题
试卷更新日期:2021-11-30 类型:期中考试
一、单选题
-
1. “碳中和”是指 的排放总量和减少总量相当。下列措施中能最直接有效地促进“碳中和”的是( )A、将煤进行气化或液化 B、以 为原料合成淀粉 C、汽油中添加乙醇 D、开采可燃冰作为新能源2. 中华传统文化中蕴含许多化学知识,下列诗句与涉及的化学知识不相符的是( )
选项
诗句
化学知识
A
绿蚁新醅酒,红泥小火炉
“红泥”是因其含
B
火树银花合,星桥铁锁开
“火树银花”属于化学变化
C
嫘祖栽桑蚕吐丝,抽丝织作绣神奇
“丝”是有机高分子材料
D
落红不是无情物,化作春泥更护花
体现了自然界中的碳、氮循环
A、A B、B C、C D、D3. 下列物质分类正确的是( )A、稀豆浆、淀粉溶液均为胶体 B、 、 均为酸性氧化物 C、冰醋酸、干冰均为电解质 D、玻璃、水晶均为无机硅酸盐材料4. 化学与生活密切相关。下列说法错误的是( )A、使用肥皂水可鉴别软水和硬水 B、用灼烧的方法可鉴别棉织物和羊毛织物 C、纯碱可用于去除餐具的油污 D、活性炭可用于去除冰箱异味和杀菌5. 氯乙酸乙烯酯( )可用于制造高耐热性薄膜,其一种合成方法如图:
下列有关说法错误的是( )
A、该反应为取代反应 B、乙可发生加成反应生成乙酸乙酯 C、丙含有四种不同的官能团 D、丁的名称为乙酸或醋酸6. 室温下,下列各组离子在指定溶液中一定能大量共存的是( )A、 溶液: 、 、 、 B、新制的饱和氯水: 、 、 、 C、与 粉反应放出 的溶液: 、 、 、 D、 溶液: 、 、 、7. 下列有关仪器的使用方法或实验操作正确的是( )A、洗净的容量瓶可放进烘箱中烘干 B、滴定接近终点时,滴定管尖嘴可接触锥形瓶内壁 C、测定溶液的 时,需先用蒸馏水润湿 试纸 D、焰色反应时,需先用 溶液洗涤铂丝并灼烧8. 是一种三元弱酸。关于常温下 的 溶液,下列说法正确的是( )A、该溶液中 B、加水稀释过程中,溶液中 保持不变 C、随温度升高, 增大,该溶液中 增大、 减小, 增大 D、加入 溶液至中性时,溶液中9. 一种 电池的电极材料分别为金属镁和吸附氧气的活性炭,电解液为 浓溶液。下列说法正确的是( )A、金属镁电极发生还原反应 B、活性炭加快了 在负极上的反应速率 C、电池总反应式为: D、电子的移动方向由活性炭电极经外电路到金属镁电极10. 部分含硫物质中的硫元素的价态及该物质的类别关系如图所示。下列说法错误的是( ) A、 微溶于酒精,易溶于 B、向 的溶液中通入 ,可产生淡黄色沉淀 C、滴加 溶液,即可鉴别 、 两种溶液 D、在一定条件下,可实现 的转化11. 用 表示阿伏加德罗常数的值。下列叙述正确的是( )A、 碳酸钠溶液中,阴离子总数为 B、 和 的混合固体中含有的离子数为 C、 与足量稀 溶液反应,转移的电子数为 D、标准状况下, 甲醇中含有的共价键数为12. 实验室采用硫铁矿焙烧取硫后的烧渣(主要成分为 、 、 ,不考虑其他杂质)制取七水合硫酸亚铁( ),其流程如图所示:
A、 微溶于酒精,易溶于 B、向 的溶液中通入 ,可产生淡黄色沉淀 C、滴加 溶液,即可鉴别 、 两种溶液 D、在一定条件下,可实现 的转化11. 用 表示阿伏加德罗常数的值。下列叙述正确的是( )A、 碳酸钠溶液中,阴离子总数为 B、 和 的混合固体中含有的离子数为 C、 与足量稀 溶液反应,转移的电子数为 D、标准状况下, 甲醇中含有的共价键数为12. 实验室采用硫铁矿焙烧取硫后的烧渣(主要成分为 、 、 ,不考虑其他杂质)制取七水合硫酸亚铁( ),其流程如图所示:
已知: , , ,
下列说法正确的是( )
A、检验溶液Ⅰ中是否含有 ,可用 溶液 B、加试剂 和加 溶液控制 ,两步顺序可以互换 C、操作①、②用到的玻璃仪器为烧杯、玻璃棒、分液漏斗 D、操作③为将溶液2加热至有大量晶体析出时,停止加热,利用余热蒸干13. 短周期元素 、 、 、 的原子序数依次增大, 、 、 原子的最外层电子数之和为11, 与 同族, 最外层电子数等于 次外层电子数, 的单质晶体是应用最广泛的半导体材料。下列叙述错误的是( )A、非金属性: B、简单氢化物的沸点: C、化合物 中含有共价键 D、 的单质可与 的氧化物发生置换反应14. 下列反应的离子方程式正确的是( )A、 溶于浓硝酸: B、 溶液中加入稀硫酸: C、向 溶液中通入过量 : D、 溶于氢碘酸:15. 某HCOOH燃料电池的工作原理如图所示,其中,两电极区间用允许K+、H+通过的半透膜隔开。下列说法错误的是( ) A、负极反应为HCOO-+2OH--2e-=HCO +H2O B、电池工作时,需补充的物质A为H2SO4 C、理论上,当有2mol HCOO-参加反应时,消耗1molFe3+ D、该电池放电的本质是将HCOOH与O2反应的化学能转化为电能16. 一定温度下,在 物质 的溶液中,发生反应: ,测算出物质 的浓度随时间变化关系如图所示。
A、负极反应为HCOO-+2OH--2e-=HCO +H2O B、电池工作时,需补充的物质A为H2SO4 C、理论上,当有2mol HCOO-参加反应时,消耗1molFe3+ D、该电池放电的本质是将HCOOH与O2反应的化学能转化为电能16. 一定温度下,在 物质 的溶液中,发生反应: ,测算出物质 的浓度随时间变化关系如图所示。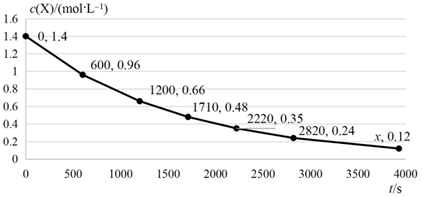
下列说法正确的是( )
A、 , 的平均速率为 B、反应至 时, C、反应过程中, D、可推测出图中x为3930二、综合题
-
17. 是一种重要的无机化合物,可作为食盐中的补碘剂。利用“ 氧化法”制备 工艺流程如图所示:

已知:“酸化反应”所得产物有 、 和 。
回答下列问题:
(1)、 在元素周期表中的位置是; 的电子式为; 中两种离子的半径大小关系为。(2)、将“酸化反应”的化学方程式补充完整。(3)、“逐 ”采用的方法是。(4)、“滤液”中的溶质主要是。(5)、“调 ”时,加入的试剂为溶液。(6)、“ 氧化法”的明显不足之处有(任写一条)。18. 我国广东、广西等省的钨锡矿床中含有黝锡矿(主要成分为 ,还含有 、 等)。一种以黝锡矿为原料提取锡的工艺流程如图所示:
已知:“滤液”中含有的主要离子为 、 、 等。
回答下列问题:
(1)、“焙烧”过程中主要发生的反应为 。① 中 元素的化合价为。
②在反应物中加入 粉的最主要目的是(填标号)。
A.提供能量 B.防止 被氧化 C.防止结块
③加入的 的量应为黝锡矿量的2.1倍,结合图示说明其原因。
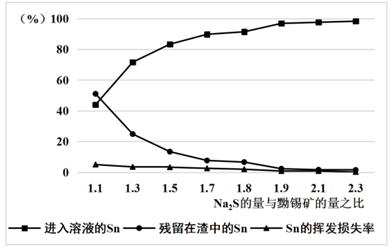 (2)、“滤渣”中可回收的金属是(填元素符号)。(3)、若黝锡矿中含有 元素,则“净化”时需加入 ,将 转化为单质 除去,发生反应的离子方程式为 ,该过程可看作经历以下两步反应:
(2)、“滤渣”中可回收的金属是(填元素符号)。(3)、若黝锡矿中含有 元素,则“净化”时需加入 ,将 转化为单质 除去,发生反应的离子方程式为 ,该过程可看作经历以下两步反应:第一步:
第二步:
(4)、“电沉积”时,采用惰性电极作阳极,纯锡作阴极, 溶液和“净化”后溶液(主要含 、 等)分别为两极区的电解液,选用阳离子交换膜。①“净化”后溶液应作(填“阳极区”或“阴极区”)电解液。
②“电沉积”过程中,阳极区溶液的 (填“增大”或“减小”或“不变”)。
③“电沉积”结束后,阴极区溶液的主要溶质为(填化学式)。
19. 氮化钙( )是一种重要的化学试剂,某小组拟用单质钙与氮气反应制备氮化钙,并测定产品纯度。已知:①氮化钙易与水反应,生成 和 ;
②焦性没食子酸溶液用于吸收少量 。
(1)、Ⅰ. 氮化钙的制备
装置 为 的发生装置, 中反应的化学方程式为。
(2)、选用上图中的装置制备氮化钙,其连接顺序为:A→→E (注:装置可重复选用)。(3)、装置 的作用是。(4)、实验开始时,应先点燃(填标号)处酒精灯,目的是。(5)、Ⅱ. 产品纯度的测定用如图所示装置测定产品纯度。实验时,关闭 ,打开分液漏斗活塞,加入 浓溶液,至不再产生 ,再打开 ,通入 一段时间,测定 装置反应前后增重 。

形管中的试剂是 , 通入 的目的是。
(6)、产品纯度为。20. 固体矿物X由三种元素组成。某学习小组为了探究它的组成和性质,进行了如图所示实验:
回答下列问题:
(1)、已知气体A能使品红溶液褪色,则反应①的离子方程式为。(2)、溶液F中溶质的化学式为 , 为检验该溶液中的金属阳离子,可向溶液 中滴加溶液,预计观察的现象为。(3)、固体B是由两种金属氧化物-CuO和(填化学式)组成的混合物,其中CuO与另一金属氧化物的物质的量之比为。(4)、X在足量空气中充分灼烧的化学方程式为。