浙江省S9联盟2021-2022学年高二上学期期中联考化学试题
试卷更新日期:2021-11-30 类型:期中考试
一、单选题
-
1. 下列物质属于强电解质的是( )A、CH3COOH B、H2SO4溶液 C、Na2SO4固体 D、C2H5OH(乙醇)2. 下列因素不可能影响化学平衡移动的是( )A、温度 B、催化剂 C、反应物的浓度 D、压强3. 下列图示表示灼烧操作的是( )A、
 B、
B、 C、
C、 D、
D、 4. 下列化学用语的表述错误的是( )A、重铬酸钾的化学式:K2Cr2O7 B、NH3分子的球棍模型:
4. 下列化学用语的表述错误的是( )A、重铬酸钾的化学式:K2Cr2O7 B、NH3分子的球棍模型: C、铝原子的结构示意图:
C、铝原子的结构示意图:  D、N2的电子式:
D、N2的电子式:  5. 下列反应属于吸热反应的是( )A、 与NH4Cl的反应 B、乙醇燃烧 C、铝粉与氧化铁粉末反应 D、NaOH与HCl反应6. 下列电离方程式错误的是( )A、H2CO3 2H++CO B、2H2O H3O++OH- C、NaHCO3=Na++HCO D、CH3COOH CH3COO-+H+7. 利用如图所示装置进行中和热测定实验,下列说法错误的是( )
5. 下列反应属于吸热反应的是( )A、 与NH4Cl的反应 B、乙醇燃烧 C、铝粉与氧化铁粉末反应 D、NaOH与HCl反应6. 下列电离方程式错误的是( )A、H2CO3 2H++CO B、2H2O H3O++OH- C、NaHCO3=Na++HCO D、CH3COOH CH3COO-+H+7. 利用如图所示装置进行中和热测定实验,下列说法错误的是( ) A、向盛装酸溶液的烧杯中加碱溶液时要小心缓慢 B、烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失 C、使用环形玻璃搅拌棒既可以搅拌又可以避免损坏温度计 D、测定酸溶液后的温度计要用蒸馏水清洗、干燥后再测碱溶液的温度8. 化学与科学技术的发展密切相关,技术的进步为化学的研究奠定了基础。下列说法错误的是( )A、就化工生产与技术的发展而言,催化剂往往成为技术改造和更新的关键 B、酸碱中和滴定时只能用石蕊试液作终点指示剂,没有其他更好的办法 C、利用飞秒激光脉冲技术使化学动力学研究进入分子动态学的领域 D、利用比色分析的分光光度计可以帮助测定某些化学反应的反应速率9. 如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列错误的是( )
A、向盛装酸溶液的烧杯中加碱溶液时要小心缓慢 B、烧杯间填满碎泡沫塑料是为了减少实验过程中的热量损失 C、使用环形玻璃搅拌棒既可以搅拌又可以避免损坏温度计 D、测定酸溶液后的温度计要用蒸馏水清洗、干燥后再测碱溶液的温度8. 化学与科学技术的发展密切相关,技术的进步为化学的研究奠定了基础。下列说法错误的是( )A、就化工生产与技术的发展而言,催化剂往往成为技术改造和更新的关键 B、酸碱中和滴定时只能用石蕊试液作终点指示剂,没有其他更好的办法 C、利用飞秒激光脉冲技术使化学动力学研究进入分子动态学的领域 D、利用比色分析的分光光度计可以帮助测定某些化学反应的反应速率9. 如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列错误的是( ) A、过程Ⅰ中断裂极性键C-Cl键 B、过程Ⅱ可表示为O3+ Cl =ClO + O2 C、过程Ⅲ中O + O = O2是吸热过程 D、上述过程说明氟利昂中氯原子是破坏O3的催化剂10. 甲烷消除NO2的污染原理为:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在一定温度下,向恒容密闭容器中充入一定量的CH4和NO2进行上述反应。下列表述能用来判断该反应达到化学平衡状态的是( )A、v正(CH4)=2v逆(NO2) B、容器中混合气体的平均密度不再变化 C、容器中混合气体总压强不再发生变化 D、单位时间内,消耗1molCH4同时生成1molCO211. 相同温度和压强下,关于物质熵的大小比较,合理的是( )A、1molCH4(g)<1molH2(g) B、1molH2O(g)<2molH2O(g) C、1molH2O(s)>1molH2O(l) D、1mol干冰>1molCO2(g)12. 合成气转变为甲醇的反应为:CO(g)+2H2(g) CH3OH(g) ΔH=-90.8kJ·mol−1。一定条件下,将1mol CO和3mol H2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )A、0~5min,反应放出的热量为27.24kJ B、第5min时,H2的反应速率为0.06mol·L−1min−1 C、其他条件不变,增大CO浓度可以增加体系中活化分子百分数 D、反应到5min时,生成0.6mol CH3OH13. NA为阿伏加德罗常数的值。下列说法错误的是( )A、标准状况下,2.24L氧气中含有原子的数目为0.2NA B、1L0.1mol/LNa2SO4溶液中,含有Na+的数目为0.2NA C、常温常压下,18g水中含有氢氧键的数目为NA D、0.1molCl2与足量的Fe反应,转移电子的数目为0.2NA14. 实验测得:101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ的热量;1molCH4完全燃烧生成液态水和CO2 , 放出890.3kJ的热量。下列热化学方程式的书写正确的是( )
A、过程Ⅰ中断裂极性键C-Cl键 B、过程Ⅱ可表示为O3+ Cl =ClO + O2 C、过程Ⅲ中O + O = O2是吸热过程 D、上述过程说明氟利昂中氯原子是破坏O3的催化剂10. 甲烷消除NO2的污染原理为:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在一定温度下,向恒容密闭容器中充入一定量的CH4和NO2进行上述反应。下列表述能用来判断该反应达到化学平衡状态的是( )A、v正(CH4)=2v逆(NO2) B、容器中混合气体的平均密度不再变化 C、容器中混合气体总压强不再发生变化 D、单位时间内,消耗1molCH4同时生成1molCO211. 相同温度和压强下,关于物质熵的大小比较,合理的是( )A、1molCH4(g)<1molH2(g) B、1molH2O(g)<2molH2O(g) C、1molH2O(s)>1molH2O(l) D、1mol干冰>1molCO2(g)12. 合成气转变为甲醇的反应为:CO(g)+2H2(g) CH3OH(g) ΔH=-90.8kJ·mol−1。一定条件下,将1mol CO和3mol H2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )A、0~5min,反应放出的热量为27.24kJ B、第5min时,H2的反应速率为0.06mol·L−1min−1 C、其他条件不变,增大CO浓度可以增加体系中活化分子百分数 D、反应到5min时,生成0.6mol CH3OH13. NA为阿伏加德罗常数的值。下列说法错误的是( )A、标准状况下,2.24L氧气中含有原子的数目为0.2NA B、1L0.1mol/LNa2SO4溶液中,含有Na+的数目为0.2NA C、常温常压下,18g水中含有氢氧键的数目为NA D、0.1molCl2与足量的Fe反应,转移电子的数目为0.2NA14. 实验测得:101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ的热量;1molCH4完全燃烧生成液态水和CO2 , 放出890.3kJ的热量。下列热化学方程式的书写正确的是( )①
②
③
④
A、②④ B、④ C、②③④ D、①②③④15. 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,下列说法正确的是( )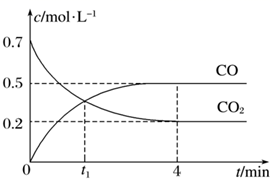 A、t1min时,正、逆反应速率的大小关系为v正=v逆 B、4min内,CO2的转化率为71.4% C、CO的反应速率v(CO)=0.125mol·L-1·s-1 D、保持容器压强不变,充入He,化学反应速率不变16. 下列说法错误的是( )A、HBr分子中存在极性共价键 B、KOH晶体中既有离子键又有共价键 C、NaCl晶体溶于水时有离子键的断裂 D、NH3分子中每个原子最外电子层都具有8电子稳定结构17. 中科院大连化物所的材料化学研究团队在催化合成氨的研究过程中,开发了过渡金属-氢化锂复合催化剂,实现了氨的低温催化合成。下列说法正确的是( )A、优良的催化剂能使正、逆反应速率显著增大,能提高氨气的平衡产率 B、催化剂主要的功能是降低了反应所需的活化能,改变了反应的焓变 C、合成气中含有的杂质可能影响过渡金属-氢化锂复合催化剂的催化效果,引起催化剂中毒 D、合成氨时,使用过渡金属-氢化锂复合催化剂不能起到节能的效果18. 在氨水中,存在着电离平衡:NH3·H2O NH +OH−。下列说法正确的是( )A、温度不变时,加水稀释,电离平衡常数Kb增大 B、加入NaOH溶液,平衡一定向逆反应方向移动 C、加入NH4Cl固体,平衡向逆反应方向移动,c(NH )减小 D、加入冰醋酸,平衡向正反应方向移动19. 下列说法错误的是( )A、实验未用完的钠可放回原试剂瓶 B、可通过盛有浓硫酸的洗气瓶除去氨中的水蒸气 C、容量瓶在使用前需检查是否完好,瓶口处是否漏水 D、轻微烫伤或烧伤时,可先用洁净的冷水处理,降低局部温度20. 一定温度下,在100mLN2O5/CCl4溶液中发生分解反应:2N2O5 4NO2+O2。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表,下列说法正确的是( )
A、t1min时,正、逆反应速率的大小关系为v正=v逆 B、4min内,CO2的转化率为71.4% C、CO的反应速率v(CO)=0.125mol·L-1·s-1 D、保持容器压强不变,充入He,化学反应速率不变16. 下列说法错误的是( )A、HBr分子中存在极性共价键 B、KOH晶体中既有离子键又有共价键 C、NaCl晶体溶于水时有离子键的断裂 D、NH3分子中每个原子最外电子层都具有8电子稳定结构17. 中科院大连化物所的材料化学研究团队在催化合成氨的研究过程中,开发了过渡金属-氢化锂复合催化剂,实现了氨的低温催化合成。下列说法正确的是( )A、优良的催化剂能使正、逆反应速率显著增大,能提高氨气的平衡产率 B、催化剂主要的功能是降低了反应所需的活化能,改变了反应的焓变 C、合成气中含有的杂质可能影响过渡金属-氢化锂复合催化剂的催化效果,引起催化剂中毒 D、合成氨时,使用过渡金属-氢化锂复合催化剂不能起到节能的效果18. 在氨水中,存在着电离平衡:NH3·H2O NH +OH−。下列说法正确的是( )A、温度不变时,加水稀释,电离平衡常数Kb增大 B、加入NaOH溶液,平衡一定向逆反应方向移动 C、加入NH4Cl固体,平衡向逆反应方向移动,c(NH )减小 D、加入冰醋酸,平衡向正反应方向移动19. 下列说法错误的是( )A、实验未用完的钠可放回原试剂瓶 B、可通过盛有浓硫酸的洗气瓶除去氨中的水蒸气 C、容量瓶在使用前需检查是否完好,瓶口处是否漏水 D、轻微烫伤或烧伤时,可先用洁净的冷水处理,降低局部温度20. 一定温度下,在100mLN2O5/CCl4溶液中发生分解反应:2N2O5 4NO2+O2。在不同时刻测量放出的O2体积,换算成N2O5浓度如下表,下列说法正确的是( )t/s
0
600
1200
1710
2220
2820
x
c(N2O5)/(mol·L-1)
1.40
0.96
0.66
0.48
0.35
0.24
0.12
A、600~1200s,生成NO2的平均速率为5.0×10-4mol·L-1·s-1 B、反应2220s时,放出的O2体积为11.8L(标准状况) C、反应达到平衡时,v正(N2O5)=2v逆(NO2) D、由600s、1710s、2820s推测上表中的x为393021. 醋酸铅因有甜味而被称为“铅糖”,有毒但能入药,又知(CH3COO)2Pb可溶于水,硝酸铅溶液与醋酸钠溶液反应的离子方程式为:Pb2++2CH3COO-=(CH3COO)2Pb。下列有关说法错误的是( )A、0.1 mol·L-1的“铅糖”溶液中c(Pb2+)<0.1 mol·L-1 B、“铅糖”是强电解质 C、“铅糖”是共价化合物 D、“铅糖”溶液的导电性可能很弱22. 在一定体积的密闭容器中,进行反应:2X(g)+Y(s) Z(g)+W(g) DH=akJ·mol-1 , 若其化学平衡常数K和温度t的关系如表。下列叙述正确的是( )t/℃
700
800
900
1000
1200
K
0.6
1.0
1.3
1.8
2.7
A、a<0 B、该反应的化学平衡常数表达式为:K= C、若在4L容器中通X和Y各1mol,在800℃下反应,某时刻测得X的物质的量为 mol,说明该反应已达平衡 D、在1000℃时,反应Z(g)+W(g) 2X(g)+Y(s)的平衡常数为1.823. 一定温度下,将一定质量的冰醋酸加水稀释的过程中,溶液的导电能力变化如图所示,下列说法中正确的是( ) A、a,b,c三点CH3COOH的电离平衡常数:c<a<b B、a,b,c三点醋酸的电离程度:c<a<b C、用湿润的pH试纸测量a处溶液的pH,测量结果偏小 D、a,b,c三点溶液用1mol·L-1的氢氧化钠溶液中和,消耗氢氧化钠溶液的体积:c<a<b24. 图示中是用0.1000 mol·L-1NaOH溶液滴定10.00 mL未知浓度硫酸溶液(酚酞作指示剂)的滴定曲线,下列说法正确的是( )
A、a,b,c三点CH3COOH的电离平衡常数:c<a<b B、a,b,c三点醋酸的电离程度:c<a<b C、用湿润的pH试纸测量a处溶液的pH,测量结果偏小 D、a,b,c三点溶液用1mol·L-1的氢氧化钠溶液中和,消耗氢氧化钠溶液的体积:c<a<b24. 图示中是用0.1000 mol·L-1NaOH溶液滴定10.00 mL未知浓度硫酸溶液(酚酞作指示剂)的滴定曲线,下列说法正确的是( ) A、水电离出的氢离子浓度:a>b B、硫酸溶液的物质的量浓度为0.1000 mol·L-1 C、指示剂变色时,说明硫酸与NaOH恰好完全反应 D、当滴加NaOH溶液为10.00 mL时,该混合液的pH=1.025. 下列方案设计、现象和结论都正确的是( )
A、水电离出的氢离子浓度:a>b B、硫酸溶液的物质的量浓度为0.1000 mol·L-1 C、指示剂变色时,说明硫酸与NaOH恰好完全反应 D、当滴加NaOH溶液为10.00 mL时,该混合液的pH=1.025. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象和结论
A
检验淀粉是否已经发生水解
将淀粉和稀硫酸混合加热,再加入少量新制的Cu(OH)2 , 加热,没有砖红色沉淀产生
淀粉未发生水解
B
探究KI与FeCl3反应的限度
取5mL0.1mol·L-1KI溶液于试管中,加入1mL0.1mol·L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液
若溶液变血红色,则KI与FeCl3的反应有一定限度
C
探究Na2SO3固体样品是否变质
取少量待测样品溶于蒸馏水,加入足量稀硫酸,再加入足量BaCl2溶液
若有白色沉淀产生,
则样品已经变质
D
检验气体Y
用湿润的淀粉碘化钾试纸检验气体Y,
试纸变蓝色,Y一定是Cl2
A、A B、B C、C D、D二、填空题
-
26. 按要求填空(1)、Cr2O 的颜色是。(2)、已知:16.0g甲烷气体完全燃烧生成液态水放出的热量为890.3kJ(298K、1.01×105Pa时测定)。写出该条件下,甲烷燃烧的热化学方程式。27. 25℃时,三种酸的电离平衡常数如下:
化学式
HClO
电离平衡常数
,
回答下列问题:
(1)、一般情况下,当温度升高时,Ka填“增大”、“减小”或“不变”。(2)、下列四种离子结合质子能力由大到小的顺序是填序号;a.CO b.ClO- c.CH3COO- d.HCO
(3)、下列反应不能发生的是填序号a.CO +2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO +2HClO=2ClO-+CO2↑+H2O
d.2ClO-+CO2+H2O=CO +2HClO
(4)、用蒸馏水稀释0.10mol/L的醋酸,下列各式表示的数值随水量的增加而增大的是填序号;a. b. c.
28. 在保温杯式量热计中(见图)。将100mL、0.500mol·L-1CH3COOH溶液与100mL、0.55mol·L-1NaOH溶液混合,体温度从298.2K升高到301.2K,CH3COONa溶液比热容c=4.2J·g-1·K-1 , 溶液的密度为1g·cm-3.(已知:反应放出的热量Q=cm△t) (1)、通过计算,写出CH3COOH中和反应热方程式。(2)、实验中NaOH溶液过量的目的是。(3)、CH3COOH中和热的文献值为-56.1kJ·mol-1 , 你认为(1)中测得的热量偏小的可能原因是。(4)、你认为CH3COOH与NaOH中和反应的ΔH1和HCl与NaOH中和反应的ΔH2相比,(填“ΔH1”“ΔH2”或“一样”)大,原因是。
(1)、通过计算,写出CH3COOH中和反应热方程式。(2)、实验中NaOH溶液过量的目的是。(3)、CH3COOH中和热的文献值为-56.1kJ·mol-1 , 你认为(1)中测得的热量偏小的可能原因是。(4)、你认为CH3COOH与NaOH中和反应的ΔH1和HCl与NaOH中和反应的ΔH2相比,(填“ΔH1”“ΔH2”或“一样”)大,原因是。三、综合题
-
29. 化合物A由1~20号元素中的三种元素组成;用固体E进行焰色实验,其火焰为砖红色;气体B能使润湿的红色石蕊试纸变蓝;气体D能使澄清石灰水变浑浊,固体E是一种氧化物。回答下列问题:
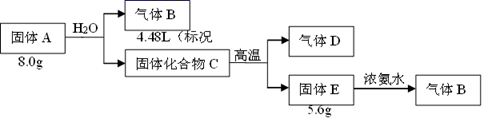 (1)、组成A的元素是(填元素符号),A的化学式是。(2)、固体A与足量稀盐酸反应的化学方程式。30. 高锰酸钾是一种重要的氧化剂,某化学实验小组制备高锰酸钾并测其纯度的步骤如图,请回答相关问题:
(1)、组成A的元素是(填元素符号),A的化学式是。(2)、固体A与足量稀盐酸反应的化学方程式。30. 高锰酸钾是一种重要的氧化剂,某化学实验小组制备高锰酸钾并测其纯度的步骤如图,请回答相关问题: (1)、I.高锰酸钾的制备
(1)、I.高锰酸钾的制备将KClO3和KOH固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入MnO2粉末,不断搅拌,呈颗粒状后,再加强热10min得墨绿色产物(K2MnO4为墨绿色固体),冷却。
①制K2MnO4反应的化学方程式为。
②本实验中使用的坩埚及搅拌棒的材质可以是。
A.石英 B.刚玉(氧化铝) C.铁(表面有致密的氧化膜)
(2)、取出墨绿色产物研细,每次用10mL4%的热KOH溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是。(3)、K2MnO4在水溶液中会发生歧化反应:3K2MnO4+2H2O 2KMnO4+MnO2↓+4KOH,通入CO2气体可促进反应趋于完全。向(2)制得的墨绿色溶液中通入适量CO2气体,过滤。滤液中的溶质除KMnO4外,还主要含有杂质。(4)、II.高锰酸钾纯度的测定称取mgKMnO4粗品,加入煮沸并冷却后的稀硫酸配成V0mL溶液。量取V1mLc1mol/L的草酸(H2C2O4)溶液于锥形瓶中,用所配KMnO4溶液进行滴定。重复滴定两次,平均消耗KMnO4溶液的体积为V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
①滴定开始时,溶液颜色褪去较慢,随后加快,原因是。
②滴定终点的标志是。
③KMnO4纯度(质量分数)的计算式为。
31. 苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下: (g)
(g)  (g)+H2(g) (1)、该反应在条件下能自发进行;既能提高该反应的速率又能提高乙苯的平衡转化率的单一措施是。(2)、当原料气中乙苯和水蒸气的物质的量之分别为1mol和4mol,反应在恒容容器中进行,测得容器总压P(总)和乙苯转化率α随时间变化结果如图所示。已知:A物质的分压为P(A)= 。则平衡时水的分压P(H2O)=kPa
(g)+H2(g) (1)、该反应在条件下能自发进行;既能提高该反应的速率又能提高乙苯的平衡转化率的单一措施是。(2)、当原料气中乙苯和水蒸气的物质的量之分别为1mol和4mol,反应在恒容容器中进行,测得容器总压P(总)和乙苯转化率α随时间变化结果如图所示。已知:A物质的分压为P(A)= 。则平衡时水的分压P(H2O)=kPa (3)、在相同的温度和催化剂的情况下,amol乙苯在VL的恒容容器中发生反应。苯乙烯的浓度随时间的变化示意图见下。若其它条件不变,amol乙苯在 L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图。
(3)、在相同的温度和催化剂的情况下,amol乙苯在VL的恒容容器中发生反应。苯乙烯的浓度随时间的变化示意图见下。若其它条件不变,amol乙苯在 L的容器中发生该反应,在图中重新画出苯乙烯的浓度随时间的变化示意图。