浙江省“七彩阳光”新高考研究联盟2021-2022学年高二上学期期中联考化学试题
试卷更新日期:2021-11-30 类型:期中考试
一、单选题
-
1. 2021年世界环境日主题为生态系统恢复,而我国的主题是人与自然和谐共生,下列措施不符合该主题的是( )A、燃煤烟气脱硫 B、大力发展和使用化石能源 C、利用中和反应处理酸性或碱性废水 D、在汽车尾气系统中装置催化转化器2. 下列物质的水溶液因水解而呈酸性的是( )A、NaHSO3 B、CH3COOH C、NH4Cl D、NaHCO33. 下列属于弱电解质的是( )A、酒精 B、冰醋酸 C、氨水 D、4. 下列说法正确的是( )A、自发反应在任何条件下都能实现 B、所有的自发反应都是放热的 C、升高温度,活化分子百分数增大,化学反应速率一定增大 D、一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率5. 对下列图示描述错误的是:( )
 A、图1为 在水中电离示意图 B、图2为HCl在水中电离示意图 C、图3为HI分解反应中分子碰撞时能量不足示意图 D、图4为HI分解反应中分子发生有效碰撞时示意图6. 下列溶液一定呈中性的是 ( )A、pH=7的溶液 B、c(H+)= 的溶液 C、由强酸、强碱等物质的量反应得到的溶液 D、非电解质溶于水得到的溶液7. 下列说法正确的是( )A、强碱滴定弱酸应选用甲基橙为指示剂 B、闪光光解技术的时间分辨率达到 s,主要用于化学平衡问题的研究 C、用比色法可以测定化学反应速率 D、化学反应的反应热均可通过实验直接测定8. 运用相关化学知识进行判断,下列结论一定错误的是( )A、溶洞及矿物的形成,变化极慢,是一些在自然条件下活化能较高的反应 B、某反应的化学平衡常数K越大,它的正向反应进行的程度越大,反应物的转化率越大 C、化学反应的历程一般为:普通反应物分子 活化分子 产物分子 D、基元反应发生的先决条件是反应物的分子必须发生碰撞9. 下列方程式书写正确的是( )A、 在水溶液中的电离方程式: B、H2SO3的电离方程式: C、 的水解方程式: D、CuSO4的水解方程式:10. 已知:
A、图1为 在水中电离示意图 B、图2为HCl在水中电离示意图 C、图3为HI分解反应中分子碰撞时能量不足示意图 D、图4为HI分解反应中分子发生有效碰撞时示意图6. 下列溶液一定呈中性的是 ( )A、pH=7的溶液 B、c(H+)= 的溶液 C、由强酸、强碱等物质的量反应得到的溶液 D、非电解质溶于水得到的溶液7. 下列说法正确的是( )A、强碱滴定弱酸应选用甲基橙为指示剂 B、闪光光解技术的时间分辨率达到 s,主要用于化学平衡问题的研究 C、用比色法可以测定化学反应速率 D、化学反应的反应热均可通过实验直接测定8. 运用相关化学知识进行判断,下列结论一定错误的是( )A、溶洞及矿物的形成,变化极慢,是一些在自然条件下活化能较高的反应 B、某反应的化学平衡常数K越大,它的正向反应进行的程度越大,反应物的转化率越大 C、化学反应的历程一般为:普通反应物分子 活化分子 产物分子 D、基元反应发生的先决条件是反应物的分子必须发生碰撞9. 下列方程式书写正确的是( )A、 在水溶液中的电离方程式: B、H2SO3的电离方程式: C、 的水解方程式: D、CuSO4的水解方程式:10. 已知:根据以上热化学方程式,判断下列说法正确的是( )
A、1molCO完全燃烧,放出热量为283J B、 C、CO与 反应放出509kJ热量时,电子转移数一定是 D、CO的燃烧热为-283kJ11. 一定温度下,在某一恒容的密闭容器中发生反应:X(s)+3Y(g)⇌3Z(g)。有关该反应的下列情况,不能说明该反应达到平衡状态的是( )A、X的质量不再变化 B、容器中的压强不再发生变化 C、混合气的平均相对分子质量不变 D、容器内混合气的密度不变12. 下列实验事实不能证明醋酸是弱电解质的是( )A、相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等 B、常温下,测得0.1 mol/L醋酸溶液的pH=4 C、常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 D、在相同条件下,相同浓度醋酸溶液的导电性比盐酸的弱13. 下列操作规范且能达到实验目的的是( ) A、图1:测定醋酸浓度 B、图2:酸滴定碱 C、图3:稀释浓硫酸 D、图4:除去碱式滴定管乳胶管中的气泡14. 常温下,下列各组离子定能在指定溶液中大量共存的是( )A、 的溶液: B、 的溶液: C、澄清透明的无色溶液: D、和 反应放出 的溶液:15. 下列有关化学反应速率说法正确的是( )A、在一恒温恒容的密闭容器中,发生 的催化氧化反应,充入He,压强增大,反应速率不变 B、0.1mol/L的 溶液与0.3mol/L的KSCN溶液等体积混合,加入适量的氯化钠溶液,不影响化学反应速率 C、合成 的反应是一个分子总数减小反应,增大压强,正反应速率加快,逆反应速率减慢,平衡正向移动 D、用铁片和稀硫酸反应制取氢气时,增大硫酸的浓度一定可以加快产生氢气的速率16. 下列关于图像的描述错误的是( )
A、图1:测定醋酸浓度 B、图2:酸滴定碱 C、图3:稀释浓硫酸 D、图4:除去碱式滴定管乳胶管中的气泡14. 常温下,下列各组离子定能在指定溶液中大量共存的是( )A、 的溶液: B、 的溶液: C、澄清透明的无色溶液: D、和 反应放出 的溶液:15. 下列有关化学反应速率说法正确的是( )A、在一恒温恒容的密闭容器中,发生 的催化氧化反应,充入He,压强增大,反应速率不变 B、0.1mol/L的 溶液与0.3mol/L的KSCN溶液等体积混合,加入适量的氯化钠溶液,不影响化学反应速率 C、合成 的反应是一个分子总数减小反应,增大压强,正反应速率加快,逆反应速率减慢,平衡正向移动 D、用铁片和稀硫酸反应制取氢气时,增大硫酸的浓度一定可以加快产生氢气的速率16. 下列关于图像的描述错误的是( ) A、由图1可知HB是一种弱酸 B、由图2可知,若 , 温度下的平衡常数分别为 , ,则 C、图3可以表示 催化分解的能量变化情况 D、由图4可判断:该化学反应正反应的17. NO催化O3分解的反应机理如下:
A、由图1可知HB是一种弱酸 B、由图2可知,若 , 温度下的平衡常数分别为 , ,则 C、图3可以表示 催化分解的能量变化情况 D、由图4可判断:该化学反应正反应的17. NO催化O3分解的反应机理如下:第一步:
第二步:
第三步:___________
总反应:
其能量与反应历程的关系如图所示。下列叙述的错误的是( )
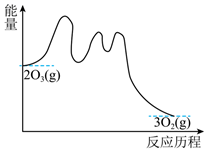 A、第一步基元反应是该反应的决速步骤 B、第二步反应断裂的化学键只有共价键 C、第三反应的反应机理为: D、催化剂NO改变了总反应的反应历程和焓变18. 已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2放热。关于下列ΔH的判断正确的是( )
A、第一步基元反应是该反应的决速步骤 B、第二步反应断裂的化学键只有共价键 C、第三反应的反应机理为: D、催化剂NO改变了总反应的反应历程和焓变18. 已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2放热。关于下列ΔH的判断正确的是( )①CO (aq)+H+(aq)⇌HCO (aq) ΔH1
②HCO (aq)+H+(aq)⇌H2CO3(aq) ΔH2
③H2CO3(aq)⇌H2O(l)+CO2(g) ΔH3
A、ΔH1<0;ΔH2>0 B、ΔH2+ΔH3>0 C、ΔH1+ΔH2+ΔH3>0 D、ΔH1>ΔH319. 某科研人员提出HCHO与 在羟基磷灰石(HAP)表面催化氧化生成 、 的历程示意图如下(图中只画出了HAP的部分结构)。下列说法正确的是( ) A、催化剂HAP没有参与反应 B、HCHO在反应过程中,C-H键部分断裂 C、 分子中的氧原子全部来自 D、该反应可表示为:20. 室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:① ;② 。反应①的速率可表示为 ,反应②的速率可表示为 ( 、 为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法正确的是( )
A、催化剂HAP没有参与反应 B、HCHO在反应过程中,C-H键部分断裂 C、 分子中的氧原子全部来自 D、该反应可表示为:20. 室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:① ;② 。反应①的速率可表示为 ,反应②的速率可表示为 ( 、 为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图。下列说法正确的是( ) A、0~30min时间段内,Y的平均反应速率为 B、反应开始后,当体系中Y和Z的浓度之比保持不变,说明该反应达到了平衡 C、如果反应能进行到底,反应结束时62.5%的M转化为Z D、反应①的活化能比反应②的活化能小21. 电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是( )A、Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 B、常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) C、物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 D、常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1 , 则此溶液可能是盐酸22. 在水质检验中,测定水的硬度时,用到氨和氯化铵( )缓冲溶液,控制溶液在pH=9.1左右。则关于该缓冲溶液的说法正确的是( )A、在该缓冲溶液中,可能有 B、在该缓冲溶液中,一定有 C、在有效缓冲范围内,将缓冲溶液加水稀释时,pH基本不变 D、在该缓冲溶液中,水的电离可能受到促进也可能受到抑制23. 25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1HR溶液,溶液的AG值[AG=lg ]随NaOH溶液体积变化如图所示。
A、0~30min时间段内,Y的平均反应速率为 B、反应开始后,当体系中Y和Z的浓度之比保持不变,说明该反应达到了平衡 C、如果反应能进行到底,反应结束时62.5%的M转化为Z D、反应①的活化能比反应②的活化能小21. 电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是( )A、Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 B、常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) C、物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 D、常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1 , 则此溶液可能是盐酸22. 在水质检验中,测定水的硬度时,用到氨和氯化铵( )缓冲溶液,控制溶液在pH=9.1左右。则关于该缓冲溶液的说法正确的是( )A、在该缓冲溶液中,可能有 B、在该缓冲溶液中,一定有 C、在有效缓冲范围内,将缓冲溶液加水稀释时,pH基本不变 D、在该缓冲溶液中,水的电离可能受到促进也可能受到抑制23. 25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1HR溶液,溶液的AG值[AG=lg ]随NaOH溶液体积变化如图所示。
下列说法中正确的是( )
A、a点所示溶液的pH=3.75,HR是弱酸 B、b点所示的溶液中c(R-)+2c(OH-)=c(HR)+2c(H+) C、c点加入NaOH溶液为20mL D、d点所示的溶液中c(R-)>c(Na+)24. 已知: 易溶于水,难溶于酒精。溶液中存在平衡:I. 和II.铜离子的水解平衡。下列说法错误的是( )A、 在水溶液中的电离方程式为: B、加热 溶液,上述平衡Ⅰ正向移动,可使 浓度增大 C、加热浓缩 溶液,再冷却结晶,可获得纯净的 晶体 D、 可通过 溶液与过量氨水作用得到,其水溶液呈碱性25. 下列方案设计、现象和结论都正确的是( )方案设计
现象
结论
A
用pH试纸测定NaCl与NaF溶液的pH
前者小于后者
F元素的非金属性强于Cl
B
压缩装有HI、I2、H2混合气体(已达平衡)的容器
颜色加深
平衡向生成I2的方向移动
C
用pH试纸测量饱和新制氯水的pH
pH试纸变为红色
饱和新制氯水呈酸性
D
向酸性KMnO4和H2C2O4的混合液中加入一小块MnSO4
生成气体(CO2)的速率加快,溶液迅速褪色
MnSO4是该反应的催化剂
A、A B、B C、C D、D二、综合题
-
26. 根据信息回答下列问题:(1)、酸碱质子理论认为:凡是能给出质子( )的任何物质都是酸,凡是能接受质子( )的任何物质都是碱。则 、 、HCl、 中属于碱的是 , 用一个离子方程式说明它们结合质子能力的相对强弱。(2)、某小组同学探究饱和NaClO和 溶液混合反应的实验。打开活塞向烧瓶中的NaClO溶液中加入饱和 溶液,产生大量的白色胶状沉淀。出现上述现象的原因是(请用反应的离子方程式表示)。(3)、部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HClO
电离平衡常数/25℃
①在相同条件下,试比较 、 和 的酸性从强到弱顺序为。
②将少量 气体通入NaClO溶液中,写出该反应离子方程式。
(4)、根据键能数据计算 的反应热 。化学键
C-H
C-F
H-F
F-F
键能/( )
414
489
565
155
27. 回答下列问题:(1)、用50mL0.50 的盐酸与50mL0.55 的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
①若将杯盖改为薄铁板,求得的反应热 将(填“偏大”、“偏小”或“无影响”)。
②实验时玻璃搅拌器的运动方向是。
a.上下运动b.左右运动c.顺时针运动d.逆时针运动
③若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:。
(2)、已知: 、 ,常温下,0.1 NaHA溶液的pH=2,则0.1 溶液中 的大小范围是;NaHA溶液中各离子浓度由大到小关系为。(3)、一定条件下,在水溶液中所含离子 、 、 、 、 各1mol,其相对能量的大小如图所示(各离子在图中用氯元素的相应化合价表示),则反应 的 。 28. 二氧化碳催化加氢制甲醇,不仅有利于减少温室气体二氧化碳,而且还可以获得大量的重要有机化工原料甲醇。回答下列问题:(1)、二氧化碳加氢制甲醇的总反应可表示为: ,该反应一般认为通过如下步骤来实现:
28. 二氧化碳催化加氢制甲醇,不仅有利于减少温室气体二氧化碳,而且还可以获得大量的重要有机化工原料甲醇。回答下列问题:(1)、二氧化碳加氢制甲醇的总反应可表示为: ,该反应一般认为通过如下步骤来实现:i.
ii.
①则总反应的 kJ/mol;该反应应选择高效催化剂(填“高温”或“低温”)。
②上述总反应在容积不变的密闭容器进行,在 时达到平衡,当其他条件不变时,改变某一条件,关于下列图像的描述,说法错误的是。

A.图甲表示 时升高温度对反应速率的影响
B.图乙表示 时加压或催化剂对反应速率的影响
C.图丙表示 时分离出甲醇对反应速率的影响
D.图丙表示 时增加水蒸气的物质的量对反应速率的影响
(2)、若 ℃时将6mol 和8mol 充入2L密闭容器中发生上述合成总反应,初始压强为 kPa,测得 的物质的量随时间变化如下图1中状态Ⅰ。图中数据A(1,6)代表在1min时 的物质的量是6mol。① ℃时,该反应的平衡常数 (对于气相反应,用某组分B的平衡压强 代替物质的量浓度 也可表示平衡常数,记作 ,如 ,p为平衡总压强, 为平衡体系中B的物质的量分数)。

②其他条件不变,仅改变某一条件后,测得 的物质的量随时间变化如图状态II、状态III所示。则状态III改变的条件可能是。
③上述反应(状态I)达到平衡后,保持其他条件不变,在 时刻迅速将容器体积压缩至1L,请在图2中画出 时刻后 的变化趋势图。
(3)、合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在t=250℃下的 图和在 Pa下的 图如图3所示,请回答下列问题:
①图中对应等压过程的曲线是 , 判断理由是。
②当 时, 平衡转化率α=(保留一位小数)。
29. 食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL。用标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如图所示,回答下列问题: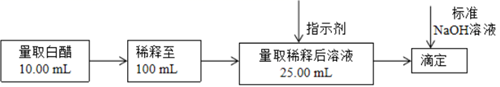 (1)、某同学用酸碱中和滴定法测定市售食用白醋醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中 ,则此时溶液中的pH=。(已知室温下醋酸的 )(2)、根据该同学的计算结果,应该选作指示剂(填“酚酞”、“甲基橙”或“石蕊”)(3)、该滴定达到终点时的现象是。(4)、某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为mL。
(1)、某同学用酸碱中和滴定法测定市售食用白醋醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中 ,则此时溶液中的pH=。(已知室温下醋酸的 )(2)、根据该同学的计算结果,应该选作指示剂(填“酚酞”、“甲基橙”或“石蕊”)(3)、该滴定达到终点时的现象是。(4)、某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用NaOH溶液的体积为mL。 (5)、用标准的0.06000mol/LNaOH溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:
(5)、用标准的0.06000mol/LNaOH溶液滴定上述稀释后的醋酸溶液,滴定结果如下表所示:滴定次数
待测溶液的体积/mL
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00mL
0.02
25.01
2
25.00mL
0.70
25.71
3
25.00mL
0.50
24.2
则该白醋(填“符合”或“不符合”)国家标准。
(6)、下列操作中,可能使所测白醋中醋酸的浓度数值偏低的是___________(填编号)。A、碱式滴定管未用标准NaOH溶液润洗就直接注入标准NaOH溶液 B、滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥 C、滴定过程中振摇时有液滴溅出 D、读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数 E、碱式滴定管在滴定前有气泡,滴定后气泡消失