黑龙江省齐齐哈尔市五校2021-2022学年高二上学期期中联考化学试题
试卷更新日期:2021-11-30 类型:期中考试
一、单选题
-
1. 2021年4月29日,“天和”核心舱成功发射,标志着中国空间站在轨组装建造全面展开。针对以下配置说法错误的是( )A、柔性三结砷化镓太阳能电池阵:砷化镓属于半导体,相对于硅电池,光电转化率更高 B、核心舱变轨动力依靠电推发动机:相对于化学燃料更加经济与环保 C、生活舱内配备环境控制与生命保障系统:航天员主要通过Na2O获取呼吸用氧 D、可再生水循环系统:从尿液分离出纯净水,可以采用多次蒸馏的方法2. NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,体积均为1.12L的HCl和HF中所含分子数都为0.05NA B、2.0gD216O和14ND3的混合物中含有的电子数为NA C、标准状况下,22.4LNO与11.2LO2混合后所得气体含分子数为NA D、23gC2H6O分子中含有碳氢键的数目一定为3NA3. 下列图中的实验方案,能达到实验目的的是( )
 A、图I测定中和热 B、图II探究不同催化剂对H2O2分解速率的影响 C、图III验证浓硫酸具有脱水性和强氧化性 D、图IV制取乙酸乙酯4. 下列有关物质的分类正确的是( )A、淀粉、蛋白质和油脂都属于天然高分子化合物 B、NO2、CO、CO2均为酸性氧化物 C、酒精、醋酸都属于电解质 D、液氨、冰水均为纯净物5. 下列反应既属于氧化还原反应,又属于放热反应的是( )
A、图I测定中和热 B、图II探究不同催化剂对H2O2分解速率的影响 C、图III验证浓硫酸具有脱水性和强氧化性 D、图IV制取乙酸乙酯4. 下列有关物质的分类正确的是( )A、淀粉、蛋白质和油脂都属于天然高分子化合物 B、NO2、CO、CO2均为酸性氧化物 C、酒精、醋酸都属于电解质 D、液氨、冰水均为纯净物5. 下列反应既属于氧化还原反应,又属于放热反应的是( )①锌粒与稀H2SO4反应制取H2②氢气在氧气中燃烧③碳酸钙高温分解成氧化钙和二氧化碳④氢氧化钾和硫酸中和⑤Ba(OH)2•8H2O与NH4Cl反应⑥氢气还原氧化铜⑦葡萄糖在人体内氧化分解⑧制取水煤气的反应
A、①②⑦ B、①②④⑦ C、③⑤⑥⑧ D、①②⑥⑦⑧6. 反应A(g) +3B(g) 2C(g) +3D(g) 在四种不同情况下的反应速率如下,则反应速率由快到慢的顺序为( )①v(A)=0.01mol·L-1·s-1 ②v(B)=0.06mol·L-1·s-1
③v(C)=2.4mol·L-1·min-1 ④v(D)=3.5mol·L-1·min-1
A、②>③>④>① B、④>②=③>① C、②=③>④>① D、④>①>②>③7. 某课题组研究煤燃烧过程中氮氧化物与砷反应的微观机理,得到如下数据和图象。已知:反应速率为反应物浓度和速率常数 的函数, 为活化能。对于所研究的三个反应,下列说法错误的是( )反应
78.45
2.58
155.85
 A、相同条件下的氧化性: B、相同条件下,As与NO的反应速率最慢 C、升高温度能增大As与 反应的活化能 D、其他条件不变,改变温度不能显著改变As与 的反应速率8. 某化学反应△H<0、△S>0,则关于此反应下列说法正确的是( )A、仅在高温下自发进行 B、仅在低温下自发进行 C、在任何温度下都能自发进行 D、在任何温度下都不能自发进行9. 工业生产氨气的适宜条件中不包括( )A、用浓硫酸吸收产物 B、用铁触媒作催化剂 C、温度为400~500 ℃ D、压强为10~30 MPa10. 一定条件下,可逆反应aA(g) bB(g)+cC(g)达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( )
A、相同条件下的氧化性: B、相同条件下,As与NO的反应速率最慢 C、升高温度能增大As与 反应的活化能 D、其他条件不变,改变温度不能显著改变As与 的反应速率8. 某化学反应△H<0、△S>0,则关于此反应下列说法正确的是( )A、仅在高温下自发进行 B、仅在低温下自发进行 C、在任何温度下都能自发进行 D、在任何温度下都不能自发进行9. 工业生产氨气的适宜条件中不包括( )A、用浓硫酸吸收产物 B、用铁触媒作催化剂 C、温度为400~500 ℃ D、压强为10~30 MPa10. 一定条件下,可逆反应aA(g) bB(g)+cC(g)达到平衡状态后,A的转化率α(A)与温度(T)、压强(p)的关系如图所示。下列判断正确的是( ) A、a< b+c B、该反应的平衡常数随温度的升高而增大 C、若T1﹤T2 , 则正反应为吸热反应 D、该反应用于工业生产时,采用的压强越大越好11. 已知HCN溶液中存在电离平衡HCN H++CN- , 平衡常数为Ka。现对HCN溶液做如下处理,其中叙述正确的是( )A、加入NaOH溶液,平衡正向移动,c(H+)减小,c(CN-)增大 B、加水稀释,平衡正向移动,Ka增大 C、增大HCN的浓度,平衡正向移动,Ka不变 D、加入NaCN固体,平衡逆向移动,Ka减小12. 在一定温度下,将气体X和气体Y各0.16 mol充入10 L的密闭容器中,发生反应: ,一段时间后反应达到平衡,测得有关数据如表所示:
A、a< b+c B、该反应的平衡常数随温度的升高而增大 C、若T1﹤T2 , 则正反应为吸热反应 D、该反应用于工业生产时,采用的压强越大越好11. 已知HCN溶液中存在电离平衡HCN H++CN- , 平衡常数为Ka。现对HCN溶液做如下处理,其中叙述正确的是( )A、加入NaOH溶液,平衡正向移动,c(H+)减小,c(CN-)增大 B、加水稀释,平衡正向移动,Ka增大 C、增大HCN的浓度,平衡正向移动,Ka不变 D、加入NaCN固体,平衡逆向移动,Ka减小12. 在一定温度下,将气体X和气体Y各0.16 mol充入10 L的密闭容器中,发生反应: ,一段时间后反应达到平衡,测得有关数据如表所示:2
4
7
9
0.12
0.11
0.10
0.10
下列说法正确的是( )
A、反应前2 min的平均速率 B、其他条件不变,降低温度,反应达到新平衡前 C、其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol气体Y,达到平衡时, D、其他条件不变,向平衡体系中再充入0.16 mol气体X,达到新平衡时,气体Y的转化率增大13. 下列实验事实能说明HNO2是弱电解质的是( )A、HNO2溶液中存在HNO2分子,溶液呈酸性 B、HNO2溶液不与Na2SO4溶液反应 C、用HNO2溶液做导电性实验,灯泡很暗 D、等浓度、等体积的HNO2溶液和盐酸,分别和等浓度的NaOH溶液完全中和,HNO2消耗碱的体积比盐酸的多14. SO2的氧化是工业制硫酸中的一步重要反应:2SO2(g)+O2(g) 2SO3(g) △H<0。如果反应在密闭容器中进行,达到平衡后,以下说法中,正确的是( )A、升高温度,正反应速率增大,化学平衡常数增大 B、增加压强,平衡会向左移动 C、加入催化剂后,正逆反应速率均不变,平衡不移动 D、达到平衡状态时,SO2的消耗速率与SO2的生成速率相等15. X、Y、Z、W是原子序数依次增大的短周期主族元素。X的原子核内只有一个质子,液态ZX3常用作制冷剂,Y原子L层比W原子M层多1个电子,W的单质在常温下能被浓硫酸钝化。下列说法正确的是( )A、最简单氢化物沸点:Z>Y B、X、Y形成的化合物中只含有极性键 C、最高正价:W>Z>Y>X D、最高价氧化物对应水化物的酸性:Y>Z二、填空题
-
16.(1)、已知①CO(g)+ O2(g)=CO2(g) ΔH1=- 283 kJ·mol-1 ,
②C(s)+ O2(g)=CO(g) ΔH2= - 110 kJ·mol-1 , 则碳的燃烧热ΔH =。
(2)、工业合成氨的热化学方程式为N2(g)+3H2(g)⇌2NH3(g) ΔH = -92.4 kJ·mol-1;已知N≡N键的键能是948.9kJ·mol-1 , H—H键的键能是436.0 kJ·mol-1 , 则N—H键的键能是;向体系中加入2 mol N2充分反应,放出的热量(填“大于”“小于”或“等于”)184.8 kJ,原因是。(3)、已知某反应过程如图所示,则该反应为的( 填“放热”或“吸热”)反应,该反应的热化学方程式为。 17. 科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2 , 其反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。(1)、若将3molNO和2molCO通入10L的恒容密闭容器中,在一定条件下发生上述反应,各组分的物质的量浓度随时间的变化情况如图1所示。
17. 科学家在实验室研究利用催化技术将飞机尾气中的NO和CO转变成CO2和N2 , 其反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。(1)、若将3molNO和2molCO通入10L的恒容密闭容器中,在一定条件下发生上述反应,各组分的物质的量浓度随时间的变化情况如图1所示。
①图中曲线A表示(填“NO”“CO”“N2”或“CO2”,下同)的浓度变化,曲线C表示的是的浓度变化。
②在0~4min内NO的平均反应速率v(NO)= , 4min末N2的浓度为。
③4min末,采用下列措施一定能加快上述反应速率的是(填标号)。
A.升高体系的温度 B.充入一定量的O2
C.将容器体积变为5L D.充入一定量氦气
(2)、研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了验证催化剂比表面积对化学反应速率的影响规律,在温度为T0时,某同学设计了以下三组实验:实验编号
T(K)
NO的初始浓度(mol•L-1)
CO的初始浓度(mol•L-1)
催化剂的比表面积(m2•g-1)
Ⅰ
T0
1.20×10-3
3.80×10-3
75
Ⅱ
T0
1.20×10-3
3.80×10-3
50
Ⅲ
T0
1.20×10-3
3.80×10-3
100
在图2中分别画出表中实验Ⅱ、Ⅲ条件下混合气体中NO的浓度随时间变化的曲线,并标明各条曲线的实验编号。

三、综合题
-
18. 25℃时,两种常见酸的电离平衡常数如表所示。
Ka1
Ka2
H2SO3
1.3×10-2
6.3×10-8
H2CO3
4.2×10-7
5.6×10-11
(1)、①HCO 的电离平衡常数表达式K=。②SO 、HSO 、CO 、HCO 结合H+的能力由强到弱的顺序为;向Na2SO3溶液中通入CO2反应的离子方程式为。
(2)、已知HnA为n元弱酸。①写出HnA与足量NaOH反应的离子方程式:。
②HnA的电离方程式为(写第一步电离)。
19. 工业上合成氨的反应为: 。(1)、在体积为 的密闭容器中发生上述反应,其平衡常数 与温度 的关系如表:298
398
498
平衡常数
①试判断 (填写“>”,“=”或“<”)。
② 时,进行合成氨反应,下列能说明该反应已达到平衡状态的是(填字母序号)。
A.混合气体的平均摩尔质量保持不变B. 正 逆
C.容器内压强保持不变D.混合气体的密度保持不变
(2)、甲同学为了探究外界条件对反应的影响,以 参加合成氨的反应,在 、 两种条件下分别达到平衡,测得 的浓度与反应时间的关系如图甲所示。请回答下列问题:① 条件下, 的平均反应速率 。
②相对 而言, 可能改变的条件是。
③在 条件下, 时刻将容器容积压缩至原来的 , 时刻重新建立平衡状态。则图甲中在 时刻 的变化曲线可能为(填图甲中的字母序号)。
 (3)、乙同学向一恒温恒压容器中充入 和 ,模拟合成氨的反应,图乙表示温度 时平衡混合物中氨气的体积分数与总压强 的关系图。若体系在 下达到平衡。
(3)、乙同学向一恒温恒压容器中充入 和 ,模拟合成氨的反应,图乙表示温度 时平衡混合物中氨气的体积分数与总压强 的关系图。若体系在 下达到平衡。①此时 的平衡分压为 。(分压=总压×物质的量分数)
②经计算可得此时的平衡常数 。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
20. 亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,沸点为-5.5℃,遇水和潮气分解。回答下列问题:
(1)、NO与Cl2在通常条件下可反应得到NOCl。某实验小组用浓盐酸与MnO2反应制Cl2 , Cu和稀HNO3制NO。①制取NO的离子方程式为
②选用下列部分装置预制备一瓶干燥纯净的氯气,各玻璃导管接口连接顺序为(气流方向从左至右)。
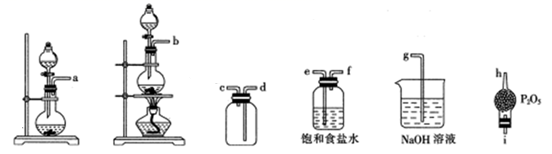 (2)、文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如下所示:
(2)、文献中记录的一种利用浓盐酸和NaNO2浓溶液反应制取NOCl的原理及装置如下所示:反应原理:NaNO2+2HCl=NOCl↑+NaCl+H2O。制取装置图:

①仪器X的名称为 , 用它代替分液漏斗的优点是
②装置C的U形管中观察到的现象是 , 装置D的作用是
(3)、取少量产品NOCl滴入盛有水的试管中,液面上方有白雾且产生无色气体,该气体在试管口变为红棕色,NOCl与水反应的化学方程式为