广西钦州市2020-2021学年高一上学期期末教学质量监测化学试题
试卷更新日期:2021-11-25 类型:期末考试
一、单选题
-
1. 下列关于化学与生产、生活的认识,错误的是( )A、节能减排符合低碳经济的要求 B、大量焚烧田间秸秆会污染空气 C、 等均是造成温室效应的气体 D、使用清洁能源是防止酸雨发生的重要措施之一2. 下列能使湿润的红色石蕊试纸变蓝的气体是( )A、SO2 B、NH3 C、Cl2 D、CO23. 下列物质中,不含有硅酸盐的是( )A、水玻璃 B、硅芯片 C、黏土 D、普通水泥4. “84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用,其有效成分是( )A、NaOH B、Na2O2 C、KMnO4 D、NaClO5. 下列物质较长时间露置在空气中,溶液溶质质量分数无明显变化的是( )A、NaOH溶液 B、饱和NaCl溶液 C、浓硫酸 D、浓盐酸6. 只用一种试剂就能把 四种溶液鉴别开来,这种试剂是( )A、盐酸 B、氯水 C、 溶液 D、 溶液7. 下列单质既能跟氯气直接反应,又能跟稀盐酸反应,且产物不相同的是( )A、Al B、Cu C、Fe D、Zn8. 下列反应中,属于氮的固定的是( )A、由氨制成碳酸氢铵或硫酸铵 B、 与 反应生成 C、 和 反应生成 D、 和 在一定条件下合成氨9. 某课外实验小组设计的下列实验不合理的是( )A、制备并观察氢氧化亚铁
 B、证明过氧化钠与水反应放热
B、证明过氧化钠与水反应放热 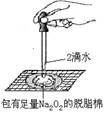 C、制备并收集少量NO2气体
C、制备并收集少量NO2气体  D、实验室制备少量氨气
D、实验室制备少量氨气  10. 为除去括号内的杂质,所选用的试剂或方法错误的是( )A、 溶液 :加热 B、 溶液 :加入过量铁粉,过滤 C、 固体 :加入过量的盐酸,过滤 D、 固体 :加入过量的 溶液,过滤11. 下列实验操作正确的是( )A、洗净的容量瓶必须烘干 B、用带磨口玻璃塞的试剂瓶保存 溶液 C、用二硫化碳清洗残留在试管壁上少量的硫粉 D、用苯萃取溴水中的溴时,有机层从分液漏斗的下口放出12. 下列关于 溶液的描述中,正确的是( )A、 该溶液中含有 B、该溶液中 C、 该溶液中含有 的质量为 D、该溶液就是将 溶于 水中所得到的溶液13. 金属和金属材料与人们的日常生活密不可分,下列认识错误的是( )A、一般用铜而不用银作导线,主要是由于考虑价格的因素 B、铁制品比铝制品容易腐蚀,是由于铁的化学性质比铝活泼 C、用盐酸可区分假黄金,是由于金不能与盐酸反应,而锌能与盐酸反应 D、用硫酸铜配制的波尔多液不能用铁制容器盛放,是因为铁能与硫酸铜发生反应14. 下列对NO、NO2的描述错误的是( )A、NO2是红棕色气体 B、NO通常用排空气法收集 C、NO、NO2在一定条件下可相互转化 D、NO、NO2都有毒,且NO是汽车尾气的有害成分之一15. 下列离子方程式书写正确的是( )A、氢氧化钡溶液与硫酸铜溶液反应: B、氯气溶于水: C、铁与稀硝酸反应: D、过氧化钠与水反应:16. 下列对硝酸的认识正确的是( )A、浓硝酸和稀硝酸都具有强氧化性 B、铜与稀硝酸的反应属于置换反应 C、可用铝制或铁制容器盛装稀硝酸 D、在铜与浓硝酸的反应中,硝酸只体现氧化性,没有体现酸性17. 如图所示,A处通入干燥的Cl2 , 关闭B阀时,C处湿的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( )
10. 为除去括号内的杂质,所选用的试剂或方法错误的是( )A、 溶液 :加热 B、 溶液 :加入过量铁粉,过滤 C、 固体 :加入过量的盐酸,过滤 D、 固体 :加入过量的 溶液,过滤11. 下列实验操作正确的是( )A、洗净的容量瓶必须烘干 B、用带磨口玻璃塞的试剂瓶保存 溶液 C、用二硫化碳清洗残留在试管壁上少量的硫粉 D、用苯萃取溴水中的溴时,有机层从分液漏斗的下口放出12. 下列关于 溶液的描述中,正确的是( )A、 该溶液中含有 B、该溶液中 C、 该溶液中含有 的质量为 D、该溶液就是将 溶于 水中所得到的溶液13. 金属和金属材料与人们的日常生活密不可分,下列认识错误的是( )A、一般用铜而不用银作导线,主要是由于考虑价格的因素 B、铁制品比铝制品容易腐蚀,是由于铁的化学性质比铝活泼 C、用盐酸可区分假黄金,是由于金不能与盐酸反应,而锌能与盐酸反应 D、用硫酸铜配制的波尔多液不能用铁制容器盛放,是因为铁能与硫酸铜发生反应14. 下列对NO、NO2的描述错误的是( )A、NO2是红棕色气体 B、NO通常用排空气法收集 C、NO、NO2在一定条件下可相互转化 D、NO、NO2都有毒,且NO是汽车尾气的有害成分之一15. 下列离子方程式书写正确的是( )A、氢氧化钡溶液与硫酸铜溶液反应: B、氯气溶于水: C、铁与稀硝酸反应: D、过氧化钠与水反应:16. 下列对硝酸的认识正确的是( )A、浓硝酸和稀硝酸都具有强氧化性 B、铜与稀硝酸的反应属于置换反应 C、可用铝制或铁制容器盛装稀硝酸 D、在铜与浓硝酸的反应中,硝酸只体现氧化性,没有体现酸性17. 如图所示,A处通入干燥的Cl2 , 关闭B阀时,C处湿的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是( ) A、浓H2SO4 B、NaOH溶液 C、浓盐酸 D、饱和NaCl溶液18. 高铁酸盐可用作净水剂,不仅可以消毒杀菌,还能吸附水中悬浮物,可以用下面反应制得:Fe2O3+ KOH+ KClO—K2FeO4+ KCl+ H2O(未配平)。下列说法正确的是( )A、Fe2O3发生氧化反应,被还原 B、KClO失去电子,作氧化剂 C、该条件下的氧化性:KClO<K2FeO4 D、参加反应的n(Fe2O3)∶n(KClO)=1∶319. 下列离子能够大量共存的是( )A、强酸性溶液中: B、强碱性溶液中: C、透明溶液中: D、20. 将10g由Mg、Zn、Fe组成的混合物与40mL稀硫酸恰好完全反应,产生的氢气在标准状况下为5.6L,则三种金属的物质的量之和为( )A、0.5mol B、0.25mol C、0.1mol D、0.125mol
A、浓H2SO4 B、NaOH溶液 C、浓盐酸 D、饱和NaCl溶液18. 高铁酸盐可用作净水剂,不仅可以消毒杀菌,还能吸附水中悬浮物,可以用下面反应制得:Fe2O3+ KOH+ KClO—K2FeO4+ KCl+ H2O(未配平)。下列说法正确的是( )A、Fe2O3发生氧化反应,被还原 B、KClO失去电子,作氧化剂 C、该条件下的氧化性:KClO<K2FeO4 D、参加反应的n(Fe2O3)∶n(KClO)=1∶319. 下列离子能够大量共存的是( )A、强酸性溶液中: B、强碱性溶液中: C、透明溶液中: D、20. 将10g由Mg、Zn、Fe组成的混合物与40mL稀硫酸恰好完全反应,产生的氢气在标准状况下为5.6L,则三种金属的物质的量之和为( )A、0.5mol B、0.25mol C、0.1mol D、0.125mol二、填空题
-
21. 现有下列三种气体:A. ;B.约含有 个 分子的氯化氢气体;C.标准状况下 ;请按要求填写:(1)、质量最小(填字母,下同)。(2)、相同状况下气体的体积最大。(3)、分子个数最少。(4)、含有氢原子的数目由小到大的顺序排列。22. 将下面物质的用途与对应的物质进行匹配(填字母)。
a.呼吸面具中作供氧剂 b.漂白消毒剂 c.面粉发酵粉 d.红色油漆和涂料 e.致冷剂
A.过氧化钠;B.碳酸氢钠;C.氧化铁;D.次氯酸钠。
23. 钠、镁、铝、铁是四种重要的金属。请回答:(1)、钠的金属活动性比铝的(填“强”或“弱”)。(2)、钠与水反应,观察不到的实验现象是(填编号)。a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)、 跟S在加热条件下反应,生成物的化学式为。(4)、铁在高温时与水蒸气反应的化学方程式为。(5)、将镁铝合金与过量NaOH溶液反应,所得溶液中不存在的离子是______。A、Na+ B、Mg2+ C、OH- D、24. 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。(1)、可用于制作计算机芯片和太阳能电池的是(填化学式)。(2)、工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为。(3)、高纯度单晶硅可以按下列方法制备:(粗) (纯)
i.步骤①的化学方程式为。
ii.步骤②的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和。
物质
Si
SiCl4
SiHCl3
SiH2Cl2
SiH3Cl
HCl
SiH4
沸点/℃
2355
57.6
31.8
8.2
-30.4
-84.9
-111.9
25. 氮化铝 具有耐高温、抗冲击、导热性好等优良性能,广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:(1)、氮化铝中氮的化合价;生成 氮化铝转移电子的物质的量为。(2)、该反应中,氧化剂是 , 氧化产物。26. 实验室制取、净化并收集氯气涉及以下几个主要阶段:(1)、实验室制取氯气的离子方程式为 , 表示阿伏加德罗常数的值,若有 的 被氧化,则转移的电子总数为;将足量的 投入含 的浓盐酸中,充分加热,可生成的 (填“>”“=”或“<”) 。(2)、现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C. 溶液,则Y溶液应选用(填字母),X溶液的作用是。(3)、 溶液用于尾气吸收,常温下发生反应的离子方程式为。27.(1)、实验室制取氨气。①选用试剂: 与(填化学式)。
②用水吸收多余的氨气时,如将导管直接插入水中,会产生现象;其水溶液显弱碱性,原因是(用化学方程式表示)。
(2)、用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。①物质M的化学式为。
②证明有红褐色胶体生成的最常用实验方法是利用胶体的重要性质,该性质是。
(3)、重铬酸钾 溶液是实验和科研中一种常用氧化剂。酸性条件下, 通常被还原为 。某同学欲用 固体配制 的 溶液。①需用的玻璃仪器有烧杯、量筒、胶头滴管、、。
②应该称取 固体的质量为。
28. 现有1.92g铜与足量的稀硝酸反应,回答以下问题。(1)、写出反应的离子方程式。(2)、计算生成标准状况下气体的体积和被还原硝酸的物质的量。三、综合题
-
29. 高纯氧化铁是现代电子工业的重要材料。

以赤铁矿(主要成分: ,杂质为 等)为原料可制备高纯氧化铁,制备流程如下:
(1)、“酸溶”时 发生反应的离子化学方程式为。(2)、“氧化”时 的作用;被氧化的离子是。(3)、滤渣I的主要成分为。(4)、“灼烧”时用到的仪器;“灼烧”时发生的化学方程式是。