广西北海市2020-2021学年高一上学期期末教学质量检测化学试题
试卷更新日期:2021-11-25 类型:期末考试
一、单选题
-
1. 下图中能实现人工固氮的是( )A、
 闪电
B、
闪电
B、 合成氨车间
C、
合成氨车间
C、 豆科植物根瘤
D、
豆科植物根瘤
D、 绿色植物光合作用
2. 在实验室里可按如图所示装置干燥、收集并吸收多余的气体,该气体是( )
绿色植物光合作用
2. 在实验室里可按如图所示装置干燥、收集并吸收多余的气体,该气体是( )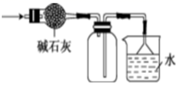 A、 B、 C、 D、HCl3. 在自然界中,既有以游离态形式存在,又有以化合态形式存在的元素是( )A、硫 B、硅 C、氯 D、铝4. 下列材料与其主要成分对应关系错误的是( )A、漂白粉的有效成分为 B、计算机芯片的主要成分为硅 C、水泥的主要成分为硅酸盐 D、水玻璃的主要成分是二氧化硅5. 下列物质的性质和用途均正确且具有因果关系的是( )A、单质硫具有可燃性,可用于焰色试验 B、氢气具有可燃性,可用于金属冶炼 C、铝丝具有还原性,可用作电缆材料 D、铁粉具有还原性,可用作食品的抗氧化剂6. 下列有关金属材料说法正确的是( )A、碳钢与生铁的主要成分相同,所以性能相同 B、通常合金的硬度比其成分金属的小 C、铝的化学性质稳定,所以铝制品耐腐蚀 D、镁在空气中燃烧发出耀眼的白光,可用作照明弹7. 在下列变化中,能表明硝酸具有氧化性的是( )A、能使石蕊溶液变红色 B、能跟Ag反应生成 C、能和碳酸钙反应 D、能和CuO反应生成8. 在水溶液中能大量共存,且加入稀硫酸溶液时,有沉淀生成的是( )A、 、 B、 、 C、 、 D、 、9. 下列溶液中溶质的物质的量浓度为1 mol/L的是( )A、含Na+为2 mol的Na2SO4溶液 B、标准状况下,将22.4 L HCl溶于水配成1 L的溶液 C、将0.5 mol/L的某饱和溶液100 mL,加热蒸发掉50 g水后的溶液 D、称取250 g胆矾(CuSO4·5H2O),溶于1 L水中10. 为了提取饱和碘水中的碘单质,下列实验操作中不需要的步骤是( )A、
A、 B、 C、 D、HCl3. 在自然界中,既有以游离态形式存在,又有以化合态形式存在的元素是( )A、硫 B、硅 C、氯 D、铝4. 下列材料与其主要成分对应关系错误的是( )A、漂白粉的有效成分为 B、计算机芯片的主要成分为硅 C、水泥的主要成分为硅酸盐 D、水玻璃的主要成分是二氧化硅5. 下列物质的性质和用途均正确且具有因果关系的是( )A、单质硫具有可燃性,可用于焰色试验 B、氢气具有可燃性,可用于金属冶炼 C、铝丝具有还原性,可用作电缆材料 D、铁粉具有还原性,可用作食品的抗氧化剂6. 下列有关金属材料说法正确的是( )A、碳钢与生铁的主要成分相同,所以性能相同 B、通常合金的硬度比其成分金属的小 C、铝的化学性质稳定,所以铝制品耐腐蚀 D、镁在空气中燃烧发出耀眼的白光,可用作照明弹7. 在下列变化中,能表明硝酸具有氧化性的是( )A、能使石蕊溶液变红色 B、能跟Ag反应生成 C、能和碳酸钙反应 D、能和CuO反应生成8. 在水溶液中能大量共存,且加入稀硫酸溶液时,有沉淀生成的是( )A、 、 B、 、 C、 、 D、 、9. 下列溶液中溶质的物质的量浓度为1 mol/L的是( )A、含Na+为2 mol的Na2SO4溶液 B、标准状况下,将22.4 L HCl溶于水配成1 L的溶液 C、将0.5 mol/L的某饱和溶液100 mL,加热蒸发掉50 g水后的溶液 D、称取250 g胆矾(CuSO4·5H2O),溶于1 L水中10. 为了提取饱和碘水中的碘单质,下列实验操作中不需要的步骤是( )A、 B、
B、 C、
C、 D、
D、 11. 表示阿伏加德罗常数的值,下列说法正确的是( )A、通常状况下, 个 分子占有的体积为22.4L B、标准状况下,11.2L四氯化碳中含有的分子数为0.5 C、常温常压下,1.06g 含有的钠离子数目为0.02 D、物质的量浓度为0.5 的 溶液中,含有氯离子数目为12. 氮化铝(AlN)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是( )A、AlN中氮的化合价为+3 B、AlN的摩尔质量为41 g C、上述反应中Al2O3是氧化剂 D、上述反应中,N元素的化合价降低13. 下列反应的离子方程式正确的是( )A、一水合氨与醋酸反应: B、氯气与水反应: C、用 溶液腐蚀印刷电路板上铜箔: D、Cu片加入稀 中:14. 将NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )A、NH3 B、O2 C、H2O D、CO2
11. 表示阿伏加德罗常数的值,下列说法正确的是( )A、通常状况下, 个 分子占有的体积为22.4L B、标准状况下,11.2L四氯化碳中含有的分子数为0.5 C、常温常压下,1.06g 含有的钠离子数目为0.02 D、物质的量浓度为0.5 的 溶液中,含有氯离子数目为12. 氮化铝(AlN)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是( )A、AlN中氮的化合价为+3 B、AlN的摩尔质量为41 g C、上述反应中Al2O3是氧化剂 D、上述反应中,N元素的化合价降低13. 下列反应的离子方程式正确的是( )A、一水合氨与醋酸反应: B、氯气与水反应: C、用 溶液腐蚀印刷电路板上铜箔: D、Cu片加入稀 中:14. 将NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )A、NH3 B、O2 C、H2O D、CO2二、综合题
-
15. 某化学兴趣小组测定化工厂排出的酸性废水中[仅含有 、 两种溶质]各溶质的物质的量浓度。回答下列问题:(1)、现需配制2 NaOH溶液480mL。
①配制溶液时必需的玻璃仪器有:表面皿烧杯、玻璃棒、胶头滴管 , 用表面皿称量氢氧化钠的理由是。
②配制该溶液需用托盘天平称取NaOH固体的质量为。
③下列关于容量瓶的使用方法中,正确的是(填字母,下同)。
A.用容量瓶长期存放NaOH溶液
B.在容量瓶中直接溶解NaOH固体
C.将容量瓶用作NaOH溶液与酸性废水的反应容器
D.向容量瓶中转移NaOH溶液时用玻璃棒引流
④下列操作会使所配溶液浓度偏低的是。
A.洗净的容量瓶未干燥
B.称量NaOH时在滤纸上称量
C.转移NaOH溶液时未冷却至室温
D.转移NaOH溶液后,洗涤烧杯和玻璃棒并转移至容量瓶中
(2)、取100mL2 NaOH溶液加水稀释,制得0.5 的NaOH溶液,所加水的体积为mL(假设稀释前后溶液的密度不变)。16. 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又被 H2还原,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称"引火铁"。回答下列问题∶(1)、I.利用图1所示装置(加热装置省略)制取铁的氧化物
试管 A中发生反应的化学方程式是 , 该反应的氧化剂是。
(2)、烧瓶 B的作用是。(3)、II.利用图2所示装置制取"引火铁"
仪器 a的名称是。
(4)、装置 B的作用是;装置C中盛放的试剂是 , 其作用是。(5)、为了安全,在试管中的反应发生前,在导管出口处必须。17. 某化学兴趣小组探究 与 溶液的反应,所用装置如图所示(夹持仪器已略去)。实验过程中发现B试管中溶液黄色逐渐褪去。
回答下列问题:
(1)、A试管中发生反应的化学方程式为。(2)、下列不能用来吸收多余 尾气的是(填字母)。a.NaOH溶液 b.饱和 溶液 c. 溶液
(3)、试管B中发生反应的离子方程式为。(4)、该实验装置存在一种缺陷为:(文字叙述)。(5)、SO2是大污染物,空气中若含较多SO2 , 可能导致的环境问题是。18. 阅读下列科普短文并回答下列问题:燃料电池是一种化学电池,具有能量转化率高、对环境友好等优点。例如氢氧燃料电池在工作时,从负极连续通入 ,从正极连续通入 ,二者在电池内部(含 或 等物质的溶液)发生反应生成 ,同时产生电能。除 外, 、 等也可以作为燃料电池的燃料,发生反应生成 和 。目前已研制成功 — 燃料电池,它可以代替汽油为汽车提供动力,反应原理是 。
(1)、在上述短文标有序号的物质中,属于单质的是(填序号,下同);属于有机物的是;属于电解质的是;溶于水能导电的物质是。(2)、写出物质③的电离方程式:。(3)、燃料电池所使用的氢燃料可以来自于水的电解,该反应的化学方程式为。若电解18kg水,可分解得到L (标准状况下)。(4)、反应 中,得电子的物质是。在反应中,每转移1mol电子,消耗Almol。19. 氯的常见氧化物有 、 、 ),其沸点分别为3.8℃、11.0℃、82.0℃。回答下列问题:(1)、常温常压下,上述三种氧化物中属于气体的是(填化学式)。(2)、用 消毒水时, 还可将水中的 转化为 , 再水解生成 胶体,说明 具有性,检验有胶体生成的简便方法是。(3)、工业上可以用反应 制备 ,生成1mol 反应中转移电子的物质的量为。(4)、实验室制备 的反应原理为 ,浓盐酸在反应中体现的性质是_______(填字母)。A、还原性 B、氧化性 C、酸性20. 某研究小组以工厂废渣( 、 )为原料制取 工艺流程如图。回答下列问题: (1)、“酸溶”时发生反应的化学方程式为。(2)、“操作a”的名称为 , 用到的玻璃仪器有玻璃棒、。(3)、“氧化”的目的是(用语言叙述),“操作c”包括洗涤、干燥、灼烧,洗涤时证明沉淀洗涤干净所用的试剂是(填化学式)。(4)、“沉铁”步骤发生反应的离子方程式为。
(1)、“酸溶”时发生反应的化学方程式为。(2)、“操作a”的名称为 , 用到的玻璃仪器有玻璃棒、。(3)、“氧化”的目的是(用语言叙述),“操作c”包括洗涤、干燥、灼烧,洗涤时证明沉淀洗涤干净所用的试剂是(填化学式)。(4)、“沉铁”步骤发生反应的离子方程式为。