广西来宾市2020-2021学年高二上学期期末教学质量检测化学试题
试卷更新日期:2021-11-25 类型:期末考试
一、单选题
-
1. 化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是( )A、煤、石油、天然气都是可再生能源 B、气象环境报告中的”PM2.5”是对一种新分子的描述 C、由于 Al 的活泼性强,故工业上采用电解熔融 AlCl3的方法生产 Al D、“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸的主要成分是蛋白质,属于高分子化合物2. 下列化学用语正确的是( )A、HClO 的结构式为 H—O—Cl B、核数 中质子数为116,中子数为 293 C、S2-的离子结构示意图为
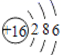 D、Cl2的电子式为 Cl:Cl
3. 用NA表示阿伏加德罗常数的值,下列说法中正确的是( )A、44 g CO2与 28g CO所含有的原子数均为NA B、24gMg与足量的稀盐酸反应转移的电子数为2NA C、NA个氧分子和 NA个氢分子的质量比为8:1 D、常温常压下,NA个 Cl2分子所占有的体积为22.4L4. 下列表示对应化学反应的离子方程式正确的是( )A、向稀硫酸中加入铁粉: B、NO2与水的反应: C、冷的氢氧化钠溶液中通入氯气: D、醋酸溶液与水垢中的CaCO3反应:5. 下列离子在指定的分散系中能大量共存的一组是( )A、透明的溶液中: B、碱性溶液中: C、氢氧化铁胶体: D、酸性溶液中:6. 高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。已知反应 ,下列说法错误的是( )A、 是还原剂 B、 既是氧化产物又是还原产物 C、 具有强氧化性,能消毒杀菌 D、1 mol Na2O2发生反应,有4 mol发生电子转移7. 已知X、Y、Z、W 四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W 同主族,Y、Z为同周期的相邻元素。W 原子的质子数等于Y、Z原子最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。下列说法正确的是( )A、简单离子半径大小:W>Z B、简单气态氢化物的稳定性:Y>Z C、Y 的氧化物对应的水化物为强酸 D、Z、W可组成 W2Z、W2Z2型化合物8. 如图有a、b 两种物质,下列说法正确的是( )
D、Cl2的电子式为 Cl:Cl
3. 用NA表示阿伏加德罗常数的值,下列说法中正确的是( )A、44 g CO2与 28g CO所含有的原子数均为NA B、24gMg与足量的稀盐酸反应转移的电子数为2NA C、NA个氧分子和 NA个氢分子的质量比为8:1 D、常温常压下,NA个 Cl2分子所占有的体积为22.4L4. 下列表示对应化学反应的离子方程式正确的是( )A、向稀硫酸中加入铁粉: B、NO2与水的反应: C、冷的氢氧化钠溶液中通入氯气: D、醋酸溶液与水垢中的CaCO3反应:5. 下列离子在指定的分散系中能大量共存的一组是( )A、透明的溶液中: B、碱性溶液中: C、氢氧化铁胶体: D、酸性溶液中:6. 高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。已知反应 ,下列说法错误的是( )A、 是还原剂 B、 既是氧化产物又是还原产物 C、 具有强氧化性,能消毒杀菌 D、1 mol Na2O2发生反应,有4 mol发生电子转移7. 已知X、Y、Z、W 四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W 同主族,Y、Z为同周期的相邻元素。W 原子的质子数等于Y、Z原子最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。下列说法正确的是( )A、简单离子半径大小:W>Z B、简单气态氢化物的稳定性:Y>Z C、Y 的氧化物对应的水化物为强酸 D、Z、W可组成 W2Z、W2Z2型化合物8. 如图有a、b 两种物质,下列说法正确的是( ) A、a 的分子式为 B、a、b 都属于芳香化合物 C、a、b 均可以发生加成反应 D、a 中所有原子均在同一平面上9. 欲除去下列物质中的杂质(括号内物质为杂质),所用试剂错误的是( )A、Fe(Al):NaOH 溶液,过滤 B、CaCO3粉末(CaCl2):过量盐酸 C、NaCl 溶液(Br2):加 CCl4 , 分液 D、NaCl 溶液(BaCl2):加过量 Na2CO3溶液,过滤,再加适量盐酸并加热10. 可逆反应X(s)+3Y(g) 2Z(g)+Q(g)在不同条件下的反应速率如下,其中反应速率最快的是( )A、v(X)=0.25mol/(L•s) B、v(Y)=3.6mol/(L•min) C、v(Q)=0.1mol/(L•s) D、v(Z)=0.3mol/(L•s)11. 一定条件下,在2L密闭容器中发生如下反应 ,反应过程中测得的有关数据如下表所示;
A、a 的分子式为 B、a、b 都属于芳香化合物 C、a、b 均可以发生加成反应 D、a 中所有原子均在同一平面上9. 欲除去下列物质中的杂质(括号内物质为杂质),所用试剂错误的是( )A、Fe(Al):NaOH 溶液,过滤 B、CaCO3粉末(CaCl2):过量盐酸 C、NaCl 溶液(Br2):加 CCl4 , 分液 D、NaCl 溶液(BaCl2):加过量 Na2CO3溶液,过滤,再加适量盐酸并加热10. 可逆反应X(s)+3Y(g) 2Z(g)+Q(g)在不同条件下的反应速率如下,其中反应速率最快的是( )A、v(X)=0.25mol/(L•s) B、v(Y)=3.6mol/(L•min) C、v(Q)=0.1mol/(L•s) D、v(Z)=0.3mol/(L•s)11. 一定条件下,在2L密闭容器中发生如下反应 ,反应过程中测得的有关数据如下表所示;时间/min
0
2
4
6
8
10
12
n(CH3OH)/mol
0
0.05
0.08
0.10
0.12
0.12
0.12
下列说法错误的是( )
A、使用催化剂能够改变反应速率 B、达到 8s 时,反应达到动态平衡 C、用 O2表示 0~4min内该反应的平均反应速率为0.01mol·L-1·min-1 D、生成 CH3OH的平均反应速率:0~2s的平均速率比 2~4s的大12. 锂二氧化锰电池是一种典刑的有机由解质锂电池,与其他锂电池相比,其材料和制造成本相对要低,目安全性很好。该电池的原理如图所示,其中 LiClO4溶干混合有机溶剂,Li+通过电解质迁移入 MnO2晶格中,生成 LiMnO2.下列说法正确的是( ) A、a 为正极 B、正极反应式是 C、外电路的电流方向是从 a 极流向 b 极 D、用水代替电池中的混合有机溶剂更环保13. 双酚A是重要的有机化工原料,苯酚和丙酮的重要衍生物,下列有关双酚A的叙述正确的是( )
A、a 为正极 B、正极反应式是 C、外电路的电流方向是从 a 极流向 b 极 D、用水代替电池中的混合有机溶剂更环保13. 双酚A是重要的有机化工原料,苯酚和丙酮的重要衍生物,下列有关双酚A的叙述正确的是( ) A、该有机物的分子式是 B、 该有机物与溴水发生反应最多能消耗 C、该有机物分子中所有碳原子可能共平面 D、该有机物的核磁共振氢谱显示氢原子数之比是1∶2∶2∶314. 有机物
A、该有机物的分子式是 B、 该有机物与溴水发生反应最多能消耗 C、该有机物分子中所有碳原子可能共平面 D、该有机物的核磁共振氢谱显示氢原子数之比是1∶2∶2∶314. 有机物 有多种同分异构体结构,其中含有苯环且属于酯类的有( ) A、2种 B、3种 C、4种 D、6种15. 下列实验能达到预期目的的是( )
有多种同分异构体结构,其中含有苯环且属于酯类的有( ) A、2种 B、3种 C、4种 D、6种15. 下列实验能达到预期目的的是( )选项
实验操作
实验目的
A
在苯和苯酚的混合液中加入足量的浓溴水,振荡、过滤
分离出苯酚
B
向卤代烃水解后的溶液中加入 溶液
判断卤素原子种类
C
淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水
验证淀粉是否水解完全
D
向 溶液中滴入酸性 溶液
证明 中含有碳碳双键
A、A B、B C、C D、D16. 芴酮是一种白色或淡黄色晶体,常用于制合成树脂、染料、防腐剂等。芴酮可通过下列反应得到:
下列说法正确的是( )
A、化合物II分子中所有原子不可能共处同一平面 B、化合物II可发生加成反应、取代反应、消去反应 C、等物质的量的化合物I、II与足量的 溶液反应,消耗 的物质的量比为3∶2 D、化合物I的同分异构体中含有两个苯环,核磁共振氢谱有6组峰,且能发生水解反应、银镜反应,与 溶液能发生显色反应的同分异构体有3种二、综合题
-
17. 某学习小组设计实验探究 与铜粉的反应并检验 ,实验装置如图所示(夹持装置略)。已知在溶液中: (棕色),该反应可用于检验 。
 (1)、实验开始前,向装置中通入一段时间的 ,目的是。(2)、请写出装置E中反应的离子方程式:。(3)、装置F中盛放的是水,作用是;装置Ⅰ中盛放的试剂是 , 作用是。(4)、若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式:。18. 下表列出了10种元素在元素周期表中的位置,请回答下列问题:
(1)、实验开始前,向装置中通入一段时间的 ,目的是。(2)、请写出装置E中反应的离子方程式:。(3)、装置F中盛放的是水,作用是;装置Ⅰ中盛放的试剂是 , 作用是。(4)、若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式:。18. 下表列出了10种元素在元素周期表中的位置,请回答下列问题:族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
二
①
②
③
④
三
⑤
⑥
⑦
⑧
四
⑨
⑩
(1)、写出元素①与⑦组成的分子的电子式:。(2)、这10种元素中,化学性质最不活泼的是(填元素符号,下同);②的简单气态氢化物与其最高价氧化物对应的水化物反应的化学方程式为。(3)、元素③④⑤的离子的半径由大到小的顺序为(用离子符号表示);元素⑤⑨的最高价氧化物对应的水化物的碱性最强的是(填化学式)。(4)、工业上用①的单质为原料在高温条件下生产⑥单质粗品的化学方程式为。(5)、⑦和⑩的原子序数相差(填数字),写出一个能证明⑦比⑩活泼的化学方程式:。19. 甲醇是一种重要的化工原料,已知甲醇燃烧的化学方程式为 的能量变化如图所示: (1)、下列说法正确的是_______(填字母)。A、该反应是一个吸热反应 B、化学变化不仅有新物质生成,同时也一定有能量变化 C、 的生成速率与 的消耗速率之比为1∶2 D、当反应生成 的同时生成 时,则该反应达到平衡状态(2)、某温度下,将 和 充入 的密闭容器中,经过 反应达到平衡,测得 , 内平均反应速率 , 则 的转化率为。(3)、将甲醇与氧气分别通入如图所示装置的电极中,可构成甲醇燃料电池,请回答下列问题:
(1)、下列说法正确的是_______(填字母)。A、该反应是一个吸热反应 B、化学变化不仅有新物质生成,同时也一定有能量变化 C、 的生成速率与 的消耗速率之比为1∶2 D、当反应生成 的同时生成 时,则该反应达到平衡状态(2)、某温度下,将 和 充入 的密闭容器中,经过 反应达到平衡,测得 , 内平均反应速率 , 则 的转化率为。(3)、将甲醇与氧气分别通入如图所示装置的电极中,可构成甲醇燃料电池,请回答下列问题:
①B口通入的气体为。
②写出负极反应式:;
③若电池工作过程中通过2mol电子,则理论上消耗L(标准状况下)的O2。
20. 丙烯是一种重要的化工原料,它是合成塑料的基本原料之一、请回答下列问题: (1)、写出下列物质的结构简式:A、B。(2)、E 生成F 的反应原子利用率为 100%,则 D 的结构简式为。(3)、请写出 A→C的化学方程式: , 该反应的反应类型是。(4)、下列说法正确的是______(填字母)。A、化合物 G属于纯净物 B、化合物 D 能与银氨溶液发生银镜反应 C、1 mol F 与足量的 Na 反应可生成标准状况下 22.4L的氢气 D、聚丙烯能使酸性 KMnO4溶液褪色21. 丁苯酞(J)作为药物被广泛使用在临床上,主要应用于缺血性疾病,合成J的一种路线如图所示:
(1)、写出下列物质的结构简式:A、B。(2)、E 生成F 的反应原子利用率为 100%,则 D 的结构简式为。(3)、请写出 A→C的化学方程式: , 该反应的反应类型是。(4)、下列说法正确的是______(填字母)。A、化合物 G属于纯净物 B、化合物 D 能与银氨溶液发生银镜反应 C、1 mol F 与足量的 Na 反应可生成标准状况下 22.4L的氢气 D、聚丙烯能使酸性 KMnO4溶液褪色21. 丁苯酞(J)作为药物被广泛使用在临床上,主要应用于缺血性疾病,合成J的一种路线如图所示:
已知:R-Br RMgBr
 。请回答下列问题:(1)、化合物 H 中含有的官能团有:(填名称)。(2)、已知化合物C可发生银镜反应,请写出C的结构简式:。(3)、E的核磁共振氢谱只有一组峰,则D的结构简式为 , 由D→E的反应类型为。(4)、请写出 H→J 反应的化学方程式: , 该反应的反应类型是。(5)、G 的分子式为 , 请写出同时满足下列条件的G的一种同分异构体的结构简式:。
。请回答下列问题:(1)、化合物 H 中含有的官能团有:(填名称)。(2)、已知化合物C可发生银镜反应,请写出C的结构简式:。(3)、E的核磁共振氢谱只有一组峰,则D的结构简式为 , 由D→E的反应类型为。(4)、请写出 H→J 反应的化学方程式: , 该反应的反应类型是。(5)、G 的分子式为 , 请写出同时满足下列条件的G的一种同分异构体的结构简式:。①能与 FeCl3溶液发生显色反应;
②核磁共振氢谱有四组峰,且峰面积之比为6:6:2:1。
(6)、根据题给信息,以乙醛和苯为原料经过三步合成某化工原料 ,请写出合成路线(其他无机试剂任选)。
,请写出合成路线(其他无机试剂任选)。