广西河池市2020-2021学年高二上学期期末教学质量检测化学试题
试卷更新日期:2021-11-25 类型:期末考试
一、单选题
-
1. 化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是( )A、煤、石油、天然气都是可再生能源 B、气象环境报告中的”PM2.5”是对一种新分子的描述 C、由于 Al 的活泼性强,故工业上采用电解熔融 AlCl3的方法生产 Al D、“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸的主要成分是蛋白质,属于高分子化合物2. 下列化学用语正确的是( )A、HClO 的结构式为 H—O—Cl B、核数 中质子数为116,中子数为 293 C、S2-的离子结构示意图为
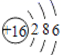 D、Cl2的电子式为 Cl:Cl
3. 用NA表示阿伏加德罗常数的值,下列说法中正确的是( )A、44 g CO2与 28g CO所含有的原子数均为NA B、24gMg与足量的稀盐酸反应转移的电子数为2NA C、NA个氧分子和 NA个氢分子的质量比为8:1 D、常温常压下,NA个 Cl2分子所占有的体积为22.4L4. 下列表示对应化学反应的离子方程式正确的是( )A、向稀硫酸中加入铁粉: B、NO2与水的反应: C、冷的氢氧化钠溶液中通入氯气: D、醋酸溶液与水垢中的CaCO3反应:5. 下列离子在指定的分散系中能大量共存的一组是( )A、透明的溶液中: B、碱性溶液中: C、氢氧化铁胶体: D、酸性溶液中:6. 高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。已知反应 ,下列说法错误的是( )A、 是还原剂 B、 既是氧化产物又是还原产物 C、 具有强氧化性,能消毒杀菌 D、1 mol Na2O2发生反应,有4 mol发生电子转移7. 金属保护是指为避免或减轻金属腐蚀,延长其使用寿命而采取的措施。埋在地下的钢管道可以用如图所示方法进行电化学保护。下列说法错误的是( )
D、Cl2的电子式为 Cl:Cl
3. 用NA表示阿伏加德罗常数的值,下列说法中正确的是( )A、44 g CO2与 28g CO所含有的原子数均为NA B、24gMg与足量的稀盐酸反应转移的电子数为2NA C、NA个氧分子和 NA个氢分子的质量比为8:1 D、常温常压下,NA个 Cl2分子所占有的体积为22.4L4. 下列表示对应化学反应的离子方程式正确的是( )A、向稀硫酸中加入铁粉: B、NO2与水的反应: C、冷的氢氧化钠溶液中通入氯气: D、醋酸溶液与水垢中的CaCO3反应:5. 下列离子在指定的分散系中能大量共存的一组是( )A、透明的溶液中: B、碱性溶液中: C、氢氧化铁胶体: D、酸性溶液中:6. 高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂。已知反应 ,下列说法错误的是( )A、 是还原剂 B、 既是氧化产物又是还原产物 C、 具有强氧化性,能消毒杀菌 D、1 mol Na2O2发生反应,有4 mol发生电子转移7. 金属保护是指为避免或减轻金属腐蚀,延长其使用寿命而采取的措施。埋在地下的钢管道可以用如图所示方法进行电化学保护。下列说法错误的是( ) A、该方法称为“外加电流的阴极保护法” B、该方法将化学能转化成电能 C、在此装置中钢管道作正极 D、镁块上发生的电极反应为 Mg-2e-+2OH-=Mg(OH)2↓8. 已知X、Y、Z、W 四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W 同主族,Y、Z为同周期的相邻元素。W 原子的质子数等于Y、Z原子最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。下列说法正确的是( )A、简单离子半径大小:W>Z B、简单气态氢化物的稳定性:Y>Z C、Y 的氧化物对应的水化物为强酸 D、Z、W可组成 W2Z、W2Z2型化合物9. 如图有a、b 两种物质,下列说法正确的是( )
A、该方法称为“外加电流的阴极保护法” B、该方法将化学能转化成电能 C、在此装置中钢管道作正极 D、镁块上发生的电极反应为 Mg-2e-+2OH-=Mg(OH)2↓8. 已知X、Y、Z、W 四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W 同主族,Y、Z为同周期的相邻元素。W 原子的质子数等于Y、Z原子最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。下列说法正确的是( )A、简单离子半径大小:W>Z B、简单气态氢化物的稳定性:Y>Z C、Y 的氧化物对应的水化物为强酸 D、Z、W可组成 W2Z、W2Z2型化合物9. 如图有a、b 两种物质,下列说法正确的是( ) A、a 的分子式为 B、a、b 都属于芳香化合物 C、a、b 均可以发生加成反应 D、a 中所有原子均在同一平面上10. 欲除去下列物质中的杂质(括号内物质为杂质),所用试剂错误的是( )A、Fe(Al):NaOH 溶液,过滤 B、CaCO3粉末(CaCl2):过量盐酸 C、NaCl 溶液(Br2):加 CCl4 , 分液 D、NaCl 溶液(BaCl2):加过量 Na2CO3溶液,过滤,再加适量盐酸并加热11. 可逆反应X(s)+3Y(g) 2Z(g)+Q(g)在不同条件下的反应速率如下,其中反应速率最快的是( )A、v(X)=0.25mol/(L•s) B、v(Y)=3.6mol/(L•min) C、v(Q)=0.1mol/(L•s) D、v(Z)=0.3mol/(L•s)12. 下列对离子反应 的说法中,错误的是( )A、任何氧化还原反应电子得失总数必然相等 B、c=2,R3+是氧化产物 C、b=4,a=c=d=2 D、该反应中 R+得到电子,被还原为 R3+13. 下列有关化学现象和化学概念表述正确的是( )A、浓硫酸和浓盐酸长期暴露在空气中浓度都会降低,且原理相同 B、Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知 Fe(OH)3胶体带正电荷 C、某次焰色试验火焰为黄色,不能说明该物质中一定不含 K+ D、0.5 mol Fe和含1 mol HNO3的稀溶液充分反应后,滴入 KSCN溶液,溶液变红14. 化学实验能增强学生的观察能力。某实验室在无水、无氧条件下,利用反应 TiO2(s)+CCl4(g) TiCl4(g)+CO2(g)制取TiCl4装置如图所示:
A、a 的分子式为 B、a、b 都属于芳香化合物 C、a、b 均可以发生加成反应 D、a 中所有原子均在同一平面上10. 欲除去下列物质中的杂质(括号内物质为杂质),所用试剂错误的是( )A、Fe(Al):NaOH 溶液,过滤 B、CaCO3粉末(CaCl2):过量盐酸 C、NaCl 溶液(Br2):加 CCl4 , 分液 D、NaCl 溶液(BaCl2):加过量 Na2CO3溶液,过滤,再加适量盐酸并加热11. 可逆反应X(s)+3Y(g) 2Z(g)+Q(g)在不同条件下的反应速率如下,其中反应速率最快的是( )A、v(X)=0.25mol/(L•s) B、v(Y)=3.6mol/(L•min) C、v(Q)=0.1mol/(L•s) D、v(Z)=0.3mol/(L•s)12. 下列对离子反应 的说法中,错误的是( )A、任何氧化还原反应电子得失总数必然相等 B、c=2,R3+是氧化产物 C、b=4,a=c=d=2 D、该反应中 R+得到电子,被还原为 R3+13. 下列有关化学现象和化学概念表述正确的是( )A、浓硫酸和浓盐酸长期暴露在空气中浓度都会降低,且原理相同 B、Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知 Fe(OH)3胶体带正电荷 C、某次焰色试验火焰为黄色,不能说明该物质中一定不含 K+ D、0.5 mol Fe和含1 mol HNO3的稀溶液充分反应后,滴入 KSCN溶液,溶液变红14. 化学实验能增强学生的观察能力。某实验室在无水、无氧条件下,利用反应 TiO2(s)+CCl4(g) TiCl4(g)+CO2(g)制取TiCl4装置如图所示:
有关物质的性质如下表:
物质
熔点/℃
沸点/℃
其他
CCl4
-23
76
与TiCl4互溶
TiCl4
-25
136
遇潮湿空气产生白雾
下列说法错误的是( )
A、装置A为干燥管 B、装置A,E中分别盛放碱石灰和浓硫酸 C、先通入N2一段时间后再点燃C处的酒精灯 D、实验结束后可采用过滤的方法来分离装置D中的液态混合物15. 下列有关说法正确的是( )A、只用水无法鉴别苯、乙醇和四氯化碳 B、淀粉水解和纤维素水解得到的最终产物不同 C、乙烷、乙烯均是气体,既可用燃烧法鉴别,也可通入高锰酸钾溶液来鉴别 D、加入氢氧化钠溶液充分振荡后分液可除去乙酸乙酯中的乙酸16. 甲、乙、丙均为中学化学常见的物质,一定条件下它们有如下转化关系(部分反应产物已省略)。下列说法正确的是( ) A、若 M为 Fe,则甲可能为硝酸溶液 B、若甲、乙、丙均为钠的化合物,则 M一定为稀盐酸 C、若甲为 Al,则 M 可能为氢氧化钠 D、若 M为 O2 , 则甲可能为 S单质17. 一定条件下,在2L密闭容器中发生如下反应 ,反应过程中测得的有关数据如下表所示;
A、若 M为 Fe,则甲可能为硝酸溶液 B、若甲、乙、丙均为钠的化合物,则 M一定为稀盐酸 C、若甲为 Al,则 M 可能为氢氧化钠 D、若 M为 O2 , 则甲可能为 S单质17. 一定条件下,在2L密闭容器中发生如下反应 ,反应过程中测得的有关数据如下表所示;时间/min
0
2
4
6
8
10
12
n(CH3OH)/mol
0
0.05
0.08
0.10
0.12
0.12
0.12
下列说法错误的是( )
A、使用催化剂能够改变反应速率 B、达到 8s 时,反应达到动态平衡 C、用 O2表示 0~4min内该反应的平均反应速率为0.01mol·L-1·min-1 D、生成 CH3OH的平均反应速率:0~2s的平均速率比 2~4s的大18. 锂二氧化锰电池是一种典刑的有机由解质锂电池,与其他锂电池相比,其材料和制造成本相对要低,目安全性很好。该电池的原理如图所示,其中 LiClO4溶干混合有机溶剂,Li+通过电解质迁移入 MnO2晶格中,生成 LiMnO2.下列说法正确的是( ) A、a 为正极 B、正极反应式是 C、外电路的电流方向是从 a 极流向 b 极 D、用水代替电池中的混合有机溶剂更环保19. 在由Fe、FeO和Fe2O3组成的混合物中加入 200 mL1mol/L的盐酸,恰好使混合物完全溶解,并放出448 mL气体(标准状况),此时溶液中无 Fe3+ , 则下列判断正确的是( )A、Fe、FeO 和 Fe2O3三种物质反应时消耗盐酸的物质的量之比为1:4:1 B、反应后所得溶液中的 Fe2+与 Cl-的物质的量浓度之比为1:1 C、混合物中,Fe2O3的物质的量无法确定,但 FeO 比 Fe的物质的量少 D、混合物中,FeO 的物质的量无法确定,但Fe2O3比 Fe的物质的量少20. 某100mL溶液可能含有 中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
A、a 为正极 B、正极反应式是 C、外电路的电流方向是从 a 极流向 b 极 D、用水代替电池中的混合有机溶剂更环保19. 在由Fe、FeO和Fe2O3组成的混合物中加入 200 mL1mol/L的盐酸,恰好使混合物完全溶解,并放出448 mL气体(标准状况),此时溶液中无 Fe3+ , 则下列判断正确的是( )A、Fe、FeO 和 Fe2O3三种物质反应时消耗盐酸的物质的量之比为1:4:1 B、反应后所得溶液中的 Fe2+与 Cl-的物质的量浓度之比为1:1 C、混合物中,Fe2O3的物质的量无法确定,但 FeO 比 Fe的物质的量少 D、混合物中,FeO 的物质的量无法确定,但Fe2O3比 Fe的物质的量少20. 某100mL溶液可能含有 中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( ) A、原溶液一定不存在 Cl- , 可能存在 Na+ B、若原溶液中存在 Na+ , 则c(Cl-)≥0.1 mol/L C、原溶液一定存在 和 ,可能存在Fe3+ D、溶液中可能存在的离子有
A、原溶液一定不存在 Cl- , 可能存在 Na+ B、若原溶液中存在 Na+ , 则c(Cl-)≥0.1 mol/L C、原溶液一定存在 和 ,可能存在Fe3+ D、溶液中可能存在的离子有二、综合题
-
21. 已知a、b、c、d、e、f是中学化学中常见的七种元素,其结构或者性质信息如下表所示:
元素
结构或者性质信息
a
原子的L 层上s能级电子数等于p能级电子数
b
非金属元素,其单质为气态,有多种氧化物且都是大气污染物
c
原子的最外层电子数是内层电子数的3倍
d
元素的正三价离子的 3d 能级为半充满
e
元素基态原子的 M层全充满,N层没有成对电子,只有一个未成对电子
f
单质常温、常压下是易挥发的液体,基态原子的N层上有1个未成对的p电子
(1)、写出元素 d基态原子的电子排布式为。(2)、元素a的原子核外共有种不同运动状态的电子,有种不同能级的电子。(3)、c、f 的气态氢化物的稳定性顺序为(填化学式),请比较 a、b、c的电负性大小顺序为(填元素符号)。(4)、df2与过量的b的最高价氧化物对应水化物的稀溶液反应,其中生成物有 HfO3和一种遇空气显红棕色的气体,试写出反应的化学方程式: , 该反应时若有1 mol df2参加反应,则转移的电子数为。22. N、P、Ni及其化合物在化工医药,材料等方面应用十分广泛。回答下列有关问题:(1)、NH3分子的立体构型为 ,热稳定性 NH3PH3(填“>”或“<”),原因是。(2)、在短周期元素组成的物质中,与 互为等电子体的分子有。(3)、N元素能形成多种化合物,它们之间可以发生相互转化,如: 。①N的基态原子的电子排布中,有个运动状态不同的未成对电子。
②叠氮酸(HN3)在常温下是液体,沸点相对较高(为 308.8 K)主要原因是。
③HNO2中 N 原子的杂化类型是;NH3分子中(填“含有”或“不含”)π键
(4)、已知次氯酸和磷酸的结构简式如图所示,试比较两者的酸性:HClO (填“>”或“<”),原因是(从结构角度分析)。次氯酸
磷酸
Cl—OH
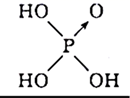 (5)、Ni是一种硬而有延展性并具有铁磁性的金属,它能够高度磨光和抗腐蚀,常被用在电镀上。工业上常用丁二酮肟来检验 Ni2+ , 反应生成鲜红色沉淀,丁二酮肟的结构简式如图所示,则该结构中碳氮之间的共价键类型是型,氮镍之间形成的化学键是 , 碳原子的杂化类型是。
(5)、Ni是一种硬而有延展性并具有铁磁性的金属,它能够高度磨光和抗腐蚀,常被用在电镀上。工业上常用丁二酮肟来检验 Ni2+ , 反应生成鲜红色沉淀,丁二酮肟的结构简式如图所示,则该结构中碳氮之间的共价键类型是型,氮镍之间形成的化学键是 , 碳原子的杂化类型是。 23. 铜及其化合物用途非常广泛,请回答下列问题:(1)、基态Cu+的核外电子排布式为。(2)、Cu2+与 OH‑反应能生成 , 中的配位原子是(填元素符号),配位数是。(3)、胆矾的结构如图所示,其中既含有配位键,又含有氢键,则胆矾的化学式用配合物的形式可表示为 。1 mol胆矾所含σ键的数目为。
23. 铜及其化合物用途非常广泛,请回答下列问题:(1)、基态Cu+的核外电子排布式为。(2)、Cu2+与 OH‑反应能生成 , 中的配位原子是(填元素符号),配位数是。(3)、胆矾的结构如图所示,其中既含有配位键,又含有氢键,则胆矾的化学式用配合物的形式可表示为 。1 mol胆矾所含σ键的数目为。 (4)、Cu与 Cl形成的一种化合物的立方晶胞如图所示。
(4)、Cu与 Cl形成的一种化合物的立方晶胞如图所示。
该化合物的化学式为 , 已知晶胞参数a=0.542 nm,此晶体的密度为 g·cm-3(写出计算式,不要求计算结果,阿伏加德罗常数的值为 NA)。
24. 现有含有Fe2+杂质的硫酸铜晶体(CuSO4·5H2O),为了制取纯净的 CuSO4·5H2O),首先将其制成水溶液,然后按图示步骤进行提纯:
已知:各离子开始沉淀和完全沉淀时的pH如下表:
离子
开始沉淀时的pH
完全沉淀时的pH
6.4
9.6
1.5
3.2
4.7
6.7
请回答下列问题:
(1)、加入氧化剂的目的是 , 最适合的氧化剂X是(填字母)。A.KMnO4 B.氯水 C.H2O2 D.HNO3
(2)、物质Y是(写一种即可)(填化学式)。(3)、本实验用加碱沉淀法能不能达到目的? , 原因是。(4)、除去 Fe3+的有关离子方程式为。(5)、请设计一种实验方案检验溶液中Fe3+是否被完全除去(写出操作步骤、现象和结论):。(6)、除铁后得到的 Fe(OH)3可用KClO 溶液在碱性环境中将其氧化得到一种高效的多功能水处理剂——K2FeO4 , 写出该反应的离子方程式:。25. 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+ H2O(g),其化学平衡常数 K 和温度T的关系如下表:T/℃
700
800
830
1000
1200
K
0.6
0.9
1.0
1.7
2.6
请回答下列问题:
(1)、该反应的平衡常数表达式为 , 该反应为(填“吸热”或“放热”)(2)、能判断该反应是否已达化学平衡状态的依据是______(填字母)。A、混合气体的密度不变 B、容器中压强不变 C、容器中 CO2、H2、CO、H2O的浓度之比为1:1:1:1 D、1 mol H—H 键断裂的同时断裂 2 mol H—O 键 E、混合气体中c(H2)保持不变(3)、能使该反应的反应速率增大,且平衡向正反应方向移动的是(填字母)。a.及时分离出 CO 和 H2O b.升高温度
c.增大压强 d.选择高效的催化剂
(4)、某温度下,在2L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO2平衡浓度为0.25 mol/L,则平衡时 CO2的转化率为 , 试通过计算判断此时的温度为℃。(5)、在830℃时,向2L的密闭容器中,充人2mol CO2、2 mol H2和2 mol H2O,则达到平衡时,混合物中 CO2的物质的量分数可能是______(填字母)。A、16.67% B、22.2% C、33.3% D、36.8%26.(1)、I.研究和深度开发 CO,CO2的应用对构建生态文明社会具有重要的意义。CO 可用于炼铁。
已知:a. △H1=+489.0kJ·mol-1
b. △H2=+172.5 kJ·mol-1
则 △H=。
(2)、CO2和 H2充入一定体积的密闭容器中,在两种温度下发生反应: △H,测得 CH3OH 的物质的量随时间的变化如图所示。
①T1T2 , △H0(填“>”“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器
甲
乙
反应物投入量
1 mol CO2 、2 mol H2
a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g)
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则 c的取值范围为。
(3)、Ⅱ.固体氧化物电解池(SOEC)用于高温共电解 CO2/H2O,既可高效制备合成气(CO+H2),又可实现 CO2的减排,其工作原理如图所示。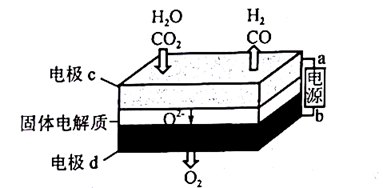
①a为电源的(填“正极”或“负极”);
②该电池是将电能转化为能;请写出电极 c 发生的电极反应式: 、。
27. 丙烯是一种重要的化工原料,它是合成塑料的基本原料之一、请回答下列问题: (1)、写出下列物质的结构简式:A、B。(2)、E 生成F 的反应原子利用率为 100%,则 D 的结构简式为。(3)、请写出 A→C的化学方程式: , 该反应的反应类型是。(4)、下列说法正确的是______(填字母)。A、化合物 G属于纯净物 B、化合物 D 能与银氨溶液发生银镜反应 C、1 mol F 与足量的 Na 反应可生成标准状况下 22.4L的氢气 D、聚丙烯能使酸性 KMnO4溶液褪色28. 丁苯酞(J)作为药物被广泛使用在临床上,主要应用于缺血性疾病,合成J的一种路线如图所示:
(1)、写出下列物质的结构简式:A、B。(2)、E 生成F 的反应原子利用率为 100%,则 D 的结构简式为。(3)、请写出 A→C的化学方程式: , 该反应的反应类型是。(4)、下列说法正确的是______(填字母)。A、化合物 G属于纯净物 B、化合物 D 能与银氨溶液发生银镜反应 C、1 mol F 与足量的 Na 反应可生成标准状况下 22.4L的氢气 D、聚丙烯能使酸性 KMnO4溶液褪色28. 丁苯酞(J)作为药物被广泛使用在临床上,主要应用于缺血性疾病,合成J的一种路线如图所示:
已知:R-Br RMgBr
 。请回答下列问题:(1)、化合物 H 中含有的官能团有:(填名称)。(2)、已知化合物C可发生银镜反应,请写出C的结构简式:。(3)、E的核磁共振氢谱只有一组峰,则D的结构简式为 , 由D→E的反应类型为。(4)、请写出 H→J 反应的化学方程式: , 该反应的反应类型是。(5)、G 的分子式为 , 请写出同时满足下列条件的G的一种同分异构体的结构简式:。
。请回答下列问题:(1)、化合物 H 中含有的官能团有:(填名称)。(2)、已知化合物C可发生银镜反应,请写出C的结构简式:。(3)、E的核磁共振氢谱只有一组峰,则D的结构简式为 , 由D→E的反应类型为。(4)、请写出 H→J 反应的化学方程式: , 该反应的反应类型是。(5)、G 的分子式为 , 请写出同时满足下列条件的G的一种同分异构体的结构简式:。①能与 FeCl3溶液发生显色反应;
②核磁共振氢谱有四组峰,且峰面积之比为6:6:2:1。
(6)、根据题给信息,以乙醛和苯为原料经过三步合成某化工原料 ,请写出合成路线(其他无机试剂任选)。 29. 某化学实验小组为探究苯与溴发生反应的原理,用如图装置进行实验。已知苯与液溴的反应是放热反应。
,请写出合成路线(其他无机试剂任选)。 29. 某化学实验小组为探究苯与溴发生反应的原理,用如图装置进行实验。已知苯与液溴的反应是放热反应。
回答下列问题:
(1)、图中有存在 1处不正确,请指出:。(2)、装置IV中使用倒立干燥管的作用是。(3)、反应结束后,打开K2 , 关闭K1和分液漏斗活塞使装置I中的水倒吸入装置Ⅱ中,这样做的目的是。(4)、写出装置Ⅱ中发生的有机反应的化学方程式: ,反应类型为 , 通过该实验能证明此反应类型的实验现象为。