广西贵港市2020-2021学年高二上学期期末教学质量监测化学试题
试卷更新日期:2021-11-25 类型:期末考试
一、单选题
-
1. 化学与生产、生活密切相关,下列说法错误的是( )A、氢氧化铝、碳酸氢钠都是常见的胃酸中和剂 B、为增强消毒效果,可将“84”消毒液与盐酸混用 C、用K2FeO4处理自来水,即可杀菌消毒又可除去悬浮杂质 D、硅胶可用作食品的干燥剂2. 101kPa时,下列热化学方程式中的ΔH可表示燃烧热的是( )A、C(s)+ O2(g)=CO(g) ΔH B、H2(g)+ O2(g)=H2O(g) ΔH C、4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH D、C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g) ΔH3. 下列物质一定能使溴水褪色(发生化学变化)的是( )A、CH4 B、C2H6 C、C2H2 D、C7H84. 在溶液中下列各组离子能大量共存的是( )A、H+、Mg2+、NO 、Fe2+ B、Ca2+、CH3COO-、Na+、Cl- C、OH-、Na+、AlO 、NH D、SO 、K+、MnO 、Fe3+5. 下列化学用语表示正确的是( )A、中子数为8的碳原子: C B、O2-的结构示意图:
 C、氯化钙的电子式:
C、氯化钙的电子式:  D、丙烷的球棍模型:
D、丙烷的球棍模型:  6. 类推是学习化学的一种重要方法,下列类推一定正确的是( )A、Al在纯氧中燃烧生成Al2O3 , 所以Fe在纯氧中燃烧生成Fe2O3 B、Na和H2O反应是熵增放热的自发反应,所以K和H2O反应也是熵增放热的自发反应 C、CaCO3分解为吸热反应,所以分解反应都为吸热反应 D、MgCl2在熔融状态下能导电,所以AlCl3在熔融状态下也能导电7. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、1mol CO2与NaOH溶液完全反应,则溶液中所含碳原子数为NA B、10g D2O所含的质子数与中子数分别是5NA和4NA C、室温下,0.1mol/L的Ba(OH)2溶液中含OH-的数目为0.2NA D、100g质量分数为98%的浓硫酸中所含的氧原子数为4NA8. 下列实验中反应方程式书写错误的是( )A、向硫酸氢铵溶液中加入几滴氢氧化钾溶液:H++OH-=H2O B、实验室氯气的制备:4H++2Cl-+MnO2=Mn2++Cl2↑+2H2O C、过量CO2通入NaAlO2溶液中:AlO +CO2+2H2O=Al(OH)3↓+HCO D、乙烯使溴水褪色:CH2=CH2+Br2→CH2BrCH2Br9. 短周期主族元素W、X、Y、Z在元素周期表中的相对位置如图所示,其中Z元素所形成的一种固体单质为黄色,且在空气中燃烧后生成一种可形成酸雨的气体。下列说法错误的是( )
6. 类推是学习化学的一种重要方法,下列类推一定正确的是( )A、Al在纯氧中燃烧生成Al2O3 , 所以Fe在纯氧中燃烧生成Fe2O3 B、Na和H2O反应是熵增放热的自发反应,所以K和H2O反应也是熵增放热的自发反应 C、CaCO3分解为吸热反应,所以分解反应都为吸热反应 D、MgCl2在熔融状态下能导电,所以AlCl3在熔融状态下也能导电7. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、1mol CO2与NaOH溶液完全反应,则溶液中所含碳原子数为NA B、10g D2O所含的质子数与中子数分别是5NA和4NA C、室温下,0.1mol/L的Ba(OH)2溶液中含OH-的数目为0.2NA D、100g质量分数为98%的浓硫酸中所含的氧原子数为4NA8. 下列实验中反应方程式书写错误的是( )A、向硫酸氢铵溶液中加入几滴氢氧化钾溶液:H++OH-=H2O B、实验室氯气的制备:4H++2Cl-+MnO2=Mn2++Cl2↑+2H2O C、过量CO2通入NaAlO2溶液中:AlO +CO2+2H2O=Al(OH)3↓+HCO D、乙烯使溴水褪色:CH2=CH2+Br2→CH2BrCH2Br9. 短周期主族元素W、X、Y、Z在元素周期表中的相对位置如图所示,其中Z元素所形成的一种固体单质为黄色,且在空气中燃烧后生成一种可形成酸雨的气体。下列说法错误的是( )W
X
Y
Z
A、原子半径: Y>Z>W>X B、X、Y、Z、W中非金属性最强的是X C、Y、Z的常见单质均为固体 D、X、W、Y元素形成的氢化物的水溶液都是强酸10. 下列实验操作及现象不能推出相应结论的是( )选项
实验操作
现象
结论
A
分别将少量钠投入盛有水和乙醇的烧杯中
钠与水反应更剧烈
乙醇中氢的活泼性比水中氢的弱
B
将石蜡油与碎瓷片混合加强热,产生的气体通入酸性KMnO4溶液中
酸性KMnO4溶液褪色
石蜡油加强热产生的气体是乙烯
C
将灼热后表面变黑的螺旋状铜丝插入约50℃的乙醇中
铜丝能保持红热,反应后溶液有刺激性气味
乙醇的催化氧化反应是放热反应
D
向苯酚钠溶液中通二氧化碳
溶液变浑浊
苯酚的酸性比碳酸的弱
A、A B、B C、C D、D11. 反应2SO2(g)+O2(g) 2SO3(g)已达到平衡,t1时刻只改变一种条件,下列改变的条件与对应的图像不相符的是( )A、 增大SO2的浓度
B、
增大SO2的浓度
B、 增大压强
C、
增大压强
C、 升高温度
D、
升高温度
D、 加入合适的催化剂
12. 一定条件下,M、N、P的起始浓度依次是0.25mol•L-1、0.05mol•L-1、0.8mol•L-1 , 可逆反应M(g)+N(g) 2P(g)达到平衡时,下列数据合理的是( )A、c(N)=0.02mol•L-1;c(P)=0.86mol•L-1 B、c(M)=0.2mol•L-1;c(P)=0.90mol•L-1 C、c(M)=1.05mol•L-1;c(P)=0.85mol•L-1 D、c(M)=0.19mol•L-1;c(P)=0.92mol•L-113. 将0.1mol M、0.2mol N和0.2mol M、0.4mol N,分别充入甲、乙两个密闭容器中,保持相同的温度和压强,发生反应: ,达到平衡后,下列比值为1:2的是( )A、化学平衡常数: B、反应放出或吸收的热量: C、M的平衡转化率: D、反应达到平衡所需的时间:14. 铁和碳形成的原电池装置如图所示,下列说法正确的是( )
加入合适的催化剂
12. 一定条件下,M、N、P的起始浓度依次是0.25mol•L-1、0.05mol•L-1、0.8mol•L-1 , 可逆反应M(g)+N(g) 2P(g)达到平衡时,下列数据合理的是( )A、c(N)=0.02mol•L-1;c(P)=0.86mol•L-1 B、c(M)=0.2mol•L-1;c(P)=0.90mol•L-1 C、c(M)=1.05mol•L-1;c(P)=0.85mol•L-1 D、c(M)=0.19mol•L-1;c(P)=0.92mol•L-113. 将0.1mol M、0.2mol N和0.2mol M、0.4mol N,分别充入甲、乙两个密闭容器中,保持相同的温度和压强,发生反应: ,达到平衡后,下列比值为1:2的是( )A、化学平衡常数: B、反应放出或吸收的热量: C、M的平衡转化率: D、反应达到平衡所需的时间:14. 铁和碳形成的原电池装置如图所示,下列说法正确的是( ) A、碳电极为负极,铁电极为正极 B、铁电极溶解,发生还原反应 C、电子的流向为铁电极→导线→碳电极 D、电解质溶液的酸性增强15. 某种药物合成过程中的一种中间产物结构表示如下:
A、碳电极为负极,铁电极为正极 B、铁电极溶解,发生还原反应 C、电子的流向为铁电极→导线→碳电极 D、电解质溶液的酸性增强15. 某种药物合成过程中的一种中间产物结构表示如下: 。下列有关该中间产物的说法错误的是( ) A、化学式为C15H12NO4Cl B、可以发生水解反应 C、苯环上的一氯代物有7种 D、含有3种官能团16. 在催化剂的作用下,NO可被H2还原成N2 , 反应原理如图所示,下列说法错误的是( )
。下列有关该中间产物的说法错误的是( ) A、化学式为C15H12NO4Cl B、可以发生水解反应 C、苯环上的一氯代物有7种 D、含有3种官能团16. 在催化剂的作用下,NO可被H2还原成N2 , 反应原理如图所示,下列说法错误的是( ) A、该反应的ΔH<0 B、每生成22.4L N2 , 放出的热量为654kJ C、断裂1mol H-H键需吸收436kJ能量 D、催化剂可以降低反应的活化能
A、该反应的ΔH<0 B、每生成22.4L N2 , 放出的热量为654kJ C、断裂1mol H-H键需吸收436kJ能量 D、催化剂可以降低反应的活化能二、填空题
-
17. 回答下列问题:(1)、在无土栽培中,需配制500mL含有NH 、K+、Cl-、SO 的植物培养液,且要求该培养液中c(Cl-)=c(K+)=c(SO )=0.4mol/L。该培养液中,c(NH )= 。若用K2SO4、NH4Cl、(NH4)2SO4配制培养液,则需g (NH4)2SO4。(2)、已知18.4mol/L的硫酸的密度为1.84g/cm3 , 则其溶质的质量分数为。(3)、由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2和H2的体积比为。(4)、在一定温度和压强下,3.6g石墨和6.4g氧气充分反应至固体无剩余,所得产物为。18. 用如图所示的装置进行电解,A中盛有NaCl溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的D端变为蓝色。回答下列问题:
 (1)、电源的F端为(填“正”或“负”)极。(2)、A中发生反应的总化学方程式为。(3)、B中石墨电极上的电极反应式为;Cu电极观察到的现象是;一段时间后,B中溶液pH(填“升高”、“降低”或“不变”)。(4)、去掉该装置中的电源,改用导线连接,为使湿润的淀粉KI试纸的D端变为蓝色,可将(填“A”或“B”)中的溶液换成(填“稀硫酸”或“浓硝酸”)。
(1)、电源的F端为(填“正”或“负”)极。(2)、A中发生反应的总化学方程式为。(3)、B中石墨电极上的电极反应式为;Cu电极观察到的现象是;一段时间后,B中溶液pH(填“升高”、“降低”或“不变”)。(4)、去掉该装置中的电源,改用导线连接,为使湿润的淀粉KI试纸的D端变为蓝色,可将(填“A”或“B”)中的溶液换成(填“稀硫酸”或“浓硝酸”)。三、综合题
-
19. 锶(Sr)和镁位于同主族,锶比镁更活泼,锶与氮气在加热条件下反应产生氮化锶,已知氮化锶遇水发生剧烈反应。某小组同学设计如下装置制备氮化锶(Sr3N2的相对分子质量为290.8)。
已知:碱性连苯三酚溶液能吸收O2。
 (1)、装置B中发生反应的化学方程式为。装置D中盛装的试剂是(填名称),装置C的作用为。(2)、该小组同学认为该实验存在明显不足,可能会导致产品变质,氮化锶遇水发生反应的化学方程式为 , 改进方案为。(3)、产品纯度的测定:称取0.5000g所得产品,加入干燥的三颈烧瓶中,加入蒸馏水,并通过足量水蒸气,将产生的氨全部蒸出,所蒸出的气体恰好被2mL 1.00mol/L HCl标准溶液完全吸收,则产品纯度为。20. 过去电子工业常用30%的FeCl3溶液腐蚀覆有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为3FeCl3+Cu=2FeCl2+CuCl2。(1)、检验腐蚀后的溶液中含有Fe3+应选用的试剂是 , 上述反应说明Fe3+、Cu2+氧化性的强弱关系为。(2)、采用下列实验步骤从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液的流程如图所示。
(1)、装置B中发生反应的化学方程式为。装置D中盛装的试剂是(填名称),装置C的作用为。(2)、该小组同学认为该实验存在明显不足,可能会导致产品变质,氮化锶遇水发生反应的化学方程式为 , 改进方案为。(3)、产品纯度的测定:称取0.5000g所得产品,加入干燥的三颈烧瓶中,加入蒸馏水,并通过足量水蒸气,将产生的氨全部蒸出,所蒸出的气体恰好被2mL 1.00mol/L HCl标准溶液完全吸收,则产品纯度为。20. 过去电子工业常用30%的FeCl3溶液腐蚀覆有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为3FeCl3+Cu=2FeCl2+CuCl2。(1)、检验腐蚀后的溶液中含有Fe3+应选用的试剂是 , 上述反应说明Fe3+、Cu2+氧化性的强弱关系为。(2)、采用下列实验步骤从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液的流程如图所示。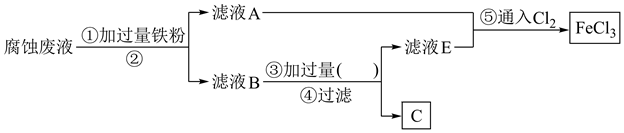
①滤液A中主要含有(填化学式,下同),滤渣B主要为。
②流程图中②的操作名称为 , ③处加过量的(填名称)。
③写出步骤⑤中反应的离子方程式:。
21. 已知汽车尾气排放时容易发生以下反应:Ⅰ.N2(g)+O2(g) 2NO(g) ΔH1=+180.0kJ/mol
Ⅱ.2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)、若CO的燃烧热(ΔH3)为-283.5kJ/mol,则反应Ⅱ的ΔH2=kJ/mol。(2)、若在恒容密闭容器中,充入2mol CO(g)和1mol NO(g),发生反应Ⅱ,下列选项中不能说明该反应已达到平衡状态的是_______(填标号)。A、CO和NO的物质的量之比不变 B、混合气体的密度保持不变 C、混合气体的压强保持不变 D、v正(N2)=2v逆(CO)(3)、CO和NO2也可发生类似于反应Ⅱ的变化,热化学方程式为2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH4<0。一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,测得相关数据如下表:0min
5min
10min
15min
20min
c(NO2)/mol·L-1
2.0
1.7
1.56
1.5
1.5
c(N2)/mol·L-1
0
0.15
0.22
0.25
0.25
①0~5min内,v正(CO2)=mol·L-1·min-1;该温度下反应的化学平衡常数K=(保留两位有效数字)L/mol。
②其他条件不变,升高温度,NO2的平衡转化率(填“增大”、“减小”或“不变”)。
③20min时,保持其他条件不变,再向容器中通入0.4mol CO、0.7mol N2和0. 4mol CO2 , 此时v正(填“ ”、“ ”或“ ”) v逆。
22. 涤纶树脂[聚对苯二甲酸乙二醇酯(PET)],是一种重要的有机高分子材料,其结构为 。利用有机物A制备PET的一种合成路线如图。
。利用有机物A制备PET的一种合成路线如图。 
已知:①
 +
+ 

②


回答下列问题:
(1)、A的名称为。(2)、F中所含官能团的名称是。(3)、反应B→C的化学方程式为 , 其反应类型为。(4)、M分子比B分子多2个碳原子,且M与B互为同系物,则M的结构有种。(5)、参照上述合成路线,写出以2-丁烯为原料合成 的路线图。(无机试剂及溶剂任选)
的路线图。(无机试剂及溶剂任选)