山东省烟台市招远市2021-2022学年九年级上学期化学期中考试试卷
试卷更新日期:2021-11-18 类型:期中考试
一、单选题
-
1. 不同品牌的洗手液pH一般不同,25℃时四种洗手液的pH如图所示。下列说法错误的是( )
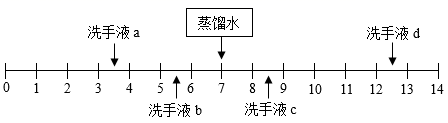 A、洗手液a用蒸馏水稀释后pH减小 B、洗手液b的酸性比a弱 C、洗手液c能使石蕊试液变蓝色 D、洗手液d和a混合液的pH可能等于72. 将一定量的下列固体放入适量水中,能形成溶液且温度明显升高的是( )A、CaCO3 B、NaOH C、NaCl D、NH4NO33. 中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )A、生石灰用于加热即热食品 B、氢氧化铝用于治疗胃酸过多 C、熟石灰用于改良酸性土壤 D、硼酸用于处理皮肤上沾有的碱4. 下列有关硫酸的认识或做法,正确的是( )A、组成:硫酸溶液中H+和 的数目相同 B、性质:能与CO2、SO2等非金属氧化物反应 C、用途:用于生产化肥、农药、火药、染料等 D、生产:含硫酸的工业废水,用CaCl2处理后直接排放5. 下列是稀释浓硫酸并进行硫酸性质实验的操作,其中正确的是( )A、稀释浓硫酸
A、洗手液a用蒸馏水稀释后pH减小 B、洗手液b的酸性比a弱 C、洗手液c能使石蕊试液变蓝色 D、洗手液d和a混合液的pH可能等于72. 将一定量的下列固体放入适量水中,能形成溶液且温度明显升高的是( )A、CaCO3 B、NaOH C、NaCl D、NH4NO33. 中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )A、生石灰用于加热即热食品 B、氢氧化铝用于治疗胃酸过多 C、熟石灰用于改良酸性土壤 D、硼酸用于处理皮肤上沾有的碱4. 下列有关硫酸的认识或做法,正确的是( )A、组成:硫酸溶液中H+和 的数目相同 B、性质:能与CO2、SO2等非金属氧化物反应 C、用途:用于生产化肥、农药、火药、染料等 D、生产:含硫酸的工业废水,用CaCl2处理后直接排放5. 下列是稀释浓硫酸并进行硫酸性质实验的操作,其中正确的是( )A、稀释浓硫酸 B、测稀硫酸的pH
B、测稀硫酸的pH  C、倾倒稀硫酸
C、倾倒稀硫酸  D、滴加稀硫酸
D、滴加稀硫酸  6. 下列有关溶液的说法错误的是( )A、溶液是均一、稳定的混合物 B、溶液中的溶质可以是固体、液体或气体 C、饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液 D、洗涤剂能洗去衣服上的油污,原因是洗涤剂具有乳化作用7. 下列洗涤方法主要利用了物质化学性质的是( )A、无水酒精擦洗手机屏幕 B、食醋洗去水壶内的水垢 C、清水洗涤衣服上的泥土 D、汽油清洗工具上的油污8. 下列有关溶液的说法中,错误的是( )A、物质溶解过程中通常会伴随着热量的变化 B、在氯化钾溶液稀释的过程中,氯化钾的质量不变 C、在压强不变时,升高温度可以增大CO2在水中的溶解度 D、熟石灰的饱和溶液通过降低温度或者增加溶剂转化为不饱和溶液9. 对于碱,下列说法正确的是( )A、碱一定含有 H 元素 B、可使酚酞变红的都是碱溶液 C、所有非金属氧化物都可与碱溶液反应 D、酸与碱反应一定不产生沉淀10. 如图是室温下稀盐酸与稀氢氧化钠溶液反应过程中pH的变化曲线,下列说法错误的是( )
6. 下列有关溶液的说法错误的是( )A、溶液是均一、稳定的混合物 B、溶液中的溶质可以是固体、液体或气体 C、饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液 D、洗涤剂能洗去衣服上的油污,原因是洗涤剂具有乳化作用7. 下列洗涤方法主要利用了物质化学性质的是( )A、无水酒精擦洗手机屏幕 B、食醋洗去水壶内的水垢 C、清水洗涤衣服上的泥土 D、汽油清洗工具上的油污8. 下列有关溶液的说法中,错误的是( )A、物质溶解过程中通常会伴随着热量的变化 B、在氯化钾溶液稀释的过程中,氯化钾的质量不变 C、在压强不变时,升高温度可以增大CO2在水中的溶解度 D、熟石灰的饱和溶液通过降低温度或者增加溶剂转化为不饱和溶液9. 对于碱,下列说法正确的是( )A、碱一定含有 H 元素 B、可使酚酞变红的都是碱溶液 C、所有非金属氧化物都可与碱溶液反应 D、酸与碱反应一定不产生沉淀10. 如图是室温下稀盐酸与稀氢氧化钠溶液反应过程中pH的变化曲线,下列说法错误的是( ) A、实验时将稀盐酸逐滴滴入稀氢氧化钠溶液中 B、a点到b点pH变化的原因是H+和OH-发生反应 C、b点时,参加反应的HCl与NaOH的质量比为36.5:40 D、c点时,溶液中的Na+个数大于Cl-个数11. 如图为甲、乙、丙三种固体的溶解度曲线,下列说法错误的是( )
A、实验时将稀盐酸逐滴滴入稀氢氧化钠溶液中 B、a点到b点pH变化的原因是H+和OH-发生反应 C、b点时,参加反应的HCl与NaOH的质量比为36.5:40 D、c点时,溶液中的Na+个数大于Cl-个数11. 如图为甲、乙、丙三种固体的溶解度曲线,下列说法错误的是( ) A、t2℃时,甲、乙、丙的溶解度由大到小的顺序是甲>乙>丙 B、t1℃时,甲、乙饱和溶液的溶质质量分数均为30% C、甲中含有少量的丙,可采用冷却热的饱和溶液的方法提纯甲 D、t2℃时,将50g甲加入到50g水中充分溶解形成75g饱和溶液12. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法错误的是( )
A、t2℃时,甲、乙、丙的溶解度由大到小的顺序是甲>乙>丙 B、t1℃时,甲、乙饱和溶液的溶质质量分数均为30% C、甲中含有少量的丙,可采用冷却热的饱和溶液的方法提纯甲 D、t2℃时,将50g甲加入到50g水中充分溶解形成75g饱和溶液12. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法错误的是( ) A、甲醛的化学式为CH2O B、生成物丙和丁中氧元素的化合价相同 C、生成物丙由1个碳原子和2个氧原子构成 D、参加反应的甲和生成的丁分子个数比为1:113. 向一包久置于空气中的生石灰干燥剂样品中加入100g溶质质量分数为3.65%的稀盐酸,恰好完全反应,有气泡产生,下列说法正确的是( )A、样品加水溶解,静置,上层清液中可能含有2种溶质 B、样品中钙元素的质量分数可能为75% C、样品中钙元素的质量一定为2g D、产生二氧化碳的质量一定为2.2g14. 下列图像能正确反映其对应操作中各量变化关系的是( )
A、甲醛的化学式为CH2O B、生成物丙和丁中氧元素的化合价相同 C、生成物丙由1个碳原子和2个氧原子构成 D、参加反应的甲和生成的丁分子个数比为1:113. 向一包久置于空气中的生石灰干燥剂样品中加入100g溶质质量分数为3.65%的稀盐酸,恰好完全反应,有气泡产生,下列说法正确的是( )A、样品加水溶解,静置,上层清液中可能含有2种溶质 B、样品中钙元素的质量分数可能为75% C、样品中钙元素的质量一定为2g D、产生二氧化碳的质量一定为2.2g14. 下列图像能正确反映其对应操作中各量变化关系的是( )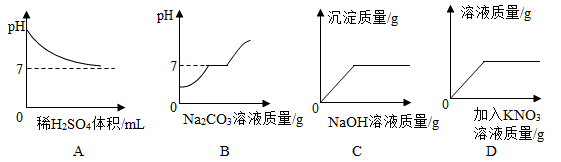 A、向一定质量的Ba(OH)2溶液中逐滴加入稀H2SO4至过量 B、向盐酸和氯化钙的混合溶液中不断滴加碳酸钠溶液至过量 C、向H2SO4和CuSO4的混合溶液中滴加NaOH溶液至过量 D、一定温度下向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
A、向一定质量的Ba(OH)2溶液中逐滴加入稀H2SO4至过量 B、向盐酸和氯化钙的混合溶液中不断滴加碳酸钠溶液至过量 C、向H2SO4和CuSO4的混合溶液中滴加NaOH溶液至过量 D、一定温度下向接近饱和的硝酸钾溶液中不断加入硝酸钾固体二、多选题
-
15. 推理是化学学习中常用的思维方法,下列推理正确的是( )A、生理盐水、酒精溶液是无色透明的,所以溶液都是无色透明的 B、酸性溶液能使紫色石蕊试液变红,所以能使紫色石蕊试液变红的溶液一定呈酸性 C、酸中一定含有氢元素,则含氢元素的物质一定是酸 D、离子是带电荷的粒子,带电荷的粒子不一定是离子
三、简答题
-
16. 化学来源于生活又服务于生活,它为满足人类不断增长的物质、精神需求作出了巨大的贡献。(1)、胃酸的主要成分是盐酸,胃舒平主要成分[Al(OH)3]常用于治疗胃酸过多症,写出用胃舒平治疗胃酸过多症时的化学反应方程式。(2)、了解土壤酸碱度是科学种植最基础的工作,其测量的方法是:取田里少量土壤样品、称量,放入烧杯,再加入五倍土壤样品质量的蒸馏水,充分搅拌后静置,用测澄清液体的酸碱度;水稻最适宜在pH是6-7的土壤中生长,若测得澄清液体的pH是4,应在该田的土壤中施加适量来调节土壤的pH。(3)、切圆葱时眼睛常常被刺激而流泪。查阅资料得知:
①圆葱被切开时因破坏了细胞组织,生成了多种挥发性的能刺激眼睛的物质(其中含有少量SO3)这些挥发性物质是“催人泪下”的元凶。
②SO3跟CO2的化学性质相似。
请你运用类比推理,写出三氧化硫跟水反应的化学方程式。若要避免切圆葱时眼睛流泪,请你给出一条建议:。
(4)、2021年5月15日,天问一号探测器着陆火星。火星上含有丰富的二氧化碳和镁资源。科学家设想用镁作为未来火星上的燃料,因为镁能在二氧化碳中燃烧放出大量的热,同时生成一种氧化物和一种单质。该反应的化学方程式为。17. 南海是我国的固有领海,蕴藏着丰富的海洋资源。(1)、南海不仅蕴含着大量的煤、石油、天然气等常规能源,还蕴藏着大量的可燃冰。可燃冰(主要成分是CH4)被科学家誉为“未来能源”,CH4燃烧的化学方程式 , 可燃冰作为能源与煤、石油相比的优点是。(2)、南海某岛对海水进行了如图1所示的综合利用。
①反渗析法淡化海水是利用海水中各成分的不同分离出淡水。
②将高盐度浓缩海水进行可以分离得到粗盐,跟该过程正好相反的一个物理变化是。
(3)、用苦卤制取金属镁的流程图如图2:
①上述转化过程中,所发生反应属于复分解反应类型的步骤是(填序号),步骤Ⅱ的化学方程式。
②利用苦卤制取氢氧化镁比“直接向海水中加入石灰乳制取氢氧化镁”的优势是。
(4)、粗盐(含CaCl2、MgCl2等杂质),然后进一步得到精制食盐。过程如下:
①母液为NaCl的(填“饱和”或“不饱和”)溶液。试剂X为(填字母序号)。
A.NaOH B.KOH C.NaNO3
②操作Y为。加适量盐酸的作用是为了除去(填物质名称或化学式)。
18. 构建知识网络模型是化学学习中重要的学习方法。如图1是小明同学利用左手构建的酸的化学性质知识网络(其中A、B表示反应物,C表示生成物)。

请完成下列问题:
(1)、如用湿润的pH试纸测定盐酸的pH,则结果会(填“偏大”“偏小”或“无影响”)。(2)、图1中①的现象是。(3)、世界卫生组织推广使用中国铁锅,使用铁锅炒菜时,放点食醋可以补充人体中构成血红素的(填“Fe2+”或“Fe3+”),该反应的原理是利用了酸的(填序号“②”“③”“④”或“⑤”)化学性质。(4)、小明用图2来说明稀硫酸与氢氧化钠溶液反应的过程,该过程不发生变化的微粒是(用符号表示),该反应的微观实质可表示为 。依此类推当图1中③是向稀盐酸中滴加硝酸银溶液时,反应的微观实质用同样的方法可表示为。(5)、图1中⑤的性质可用于除铁锈,反应的化学方程式为。(6)、盐酸、硫酸、食醋具有相似化学性质是因为它们水溶液中都含有(用符号表示)。19.(1)、Ⅰ:在农业上通常用12%的氯化钠溶液选种。实验室欲配制该质量分数的溶液60g,操作如图,请回答下列问题:

请用图中的序号表示配制溶液的正确操作顺序。
(2)、认真观察②,其中的不正确操作是:。若不进行改正,其他操作步骤正确,则所配溶液的溶质的质量分数(填“大于”、“小于”或“等于”)12%。(3)、改正②不正确后,若配制所得的氯化钠溶液溶质质量分数偏小,可能的原因是 。(填字母序号)A、转移已称好的氯化钠固体时,部分洒落在烧杯外 B、用量筒量取水时俯视读数 C、转移已配好的溶液时,有少量溶液溅出(4)、Ⅱ:根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)温度/℃
10
20
30
40
50
60
70
80
溶解度/g
80.8
87.6
94.9
103
113
124
136
149
20℃时,将90 g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的最简质量比为。
(5)、80℃时,将249 g NaNO3饱和溶液降温至℃时,溶液质量变为224g。(6)、50℃时将200g溶质质量分数为50%的NaNO3溶液变为该温度下的饱和溶液,至少应向溶液中再加入g NaNO3固体。20. 已知A、B、C、D、E分别为稀盐酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、硫酸铜溶液中的一种,为鉴别该五种溶液,化学兴趣小组同学设计绘制的思维导图如图所示: (1)、C中的溶质为(填化学式);(2)、若A能使紫色石蕊试液变红,则D为(填物质名称);(3)、为鉴别B和E,加入的物质X为(写出一种即可),其中与氢氧化钙溶液反应的化学方程式为。21. 学习了常见的酸、碱后,同学们对碱的化学性质进行整理归纳,并在教师的指导下进行如下实验活动。(1)、(验证实验)
(1)、C中的溶质为(填化学式);(2)、若A能使紫色石蕊试液变红,则D为(填物质名称);(3)、为鉴别B和E,加入的物质X为(写出一种即可),其中与氢氧化钙溶液反应的化学方程式为。21. 学习了常见的酸、碱后,同学们对碱的化学性质进行整理归纳,并在教师的指导下进行如下实验活动。(1)、(验证实验)序号
实验一
实验二
实验三
实验四
实验内容




实验现象
溶液变红色
产生蓝色沉淀
无明显现象
无明显现象
分析与结论
Ca(OH)2能与指示剂作用
反应的化学方程式为
无法确定是否发生反应
无法确定是否发生反应
(2)、(发现问题)通过实验,同学们发现实验三、实验四无明显现象,无法确定是否发生了化学反应。于是继续进行探究。
(探究实验)
Ⅰ.取少量实验三中的剩余溶液,滴加 , 溶液仍为无色,证明稀盐酸和Ca(OH)2溶液发生了化学反应,判断依据是溶液中完全反应了。
Ⅱ.取少量实验四中的剩余溶液,滴加溶液(填盐类物质),观察到产生白色沉淀,证明CO2和NaOH溶液发生了化学反应。
(3)、(拓展延伸)同学们针对实验四又进行了如图所示的对比实验:将充满CO2的两支相同的试管分别倒扣入盛有不同液体的两个烧杯中,根据试管内液面上升的高度不同,确定二者之间发生了反应。图中空白处应填的内容是。
 (4)、(总结提升)
(4)、(总结提升)没有明显现象的化学反应,可以通过或的方法证明反应发生。
22. 实验室中有一瓶长期使用的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究。(发现问题)该样品中含有哪些物质?
(查阅资料)①NaOH在空气中不会转化成 NaHCO3
②BaCl2溶液呈中性,Ba(OH)2是可溶性碱。
③CO2在饱和的 NaHCO3溶液中几乎不溶解。
(提出猜想)猜想Ⅰ:NaOH 猜想Ⅱ:Na2CO3猜想Ⅲ:NaOH和Na2CO3
(设计实验)
实验操作
实验现象
①:取少量样品于试管中,滴加足量水
样品全部溶解,得到无色溶液
②:取步骤①所得无色溶液于试管中,滴加足量X溶液
观察到现象A
(1)、(收集证据)若现象A是有气泡产生,则X溶液为 , 则猜想(填“Ⅰ”、“Ⅱ”或“Ⅲ”)不成立。(2)、若X溶液为BaCl2溶液,现象A是;再取反应后的上层清液,(填实验操作和现象),则证明猜想Ⅲ成立。(3)、(定量分析)确定部分变质样品中Na2CO3的质量分数。兴趣小组的同学用如图所示装置进行实验。
步骤如下:①按图连接好装置,并检查气密性;②准确称取该样品1.0g,放入烧瓶内;③打开活塞,滴加30.0%的稀硫酸至过量,关闭活塞;④反应结束后,量筒内液体的读数为55.0mL。(已知:室温条件下,CO2的密度为1.6g·L-1)
B装置集气瓶内原有的空气对实验结果(填“有”或“没有”)影响。饱和 NaHCO3溶液如果用水代替,则所测CO2体积(填“偏大”、偏小”或“不变”)。
(4)、该样品中Na2CO3的质量分数(保留一位小数)。(5)、(实验反思)实验中量筒的作用是。四、计算题
-
23. 实验室中有一包CaCl2和CaCO3的混合物,化学活动小组同学为测定该混合物中CaCO3的含量,取20g样品于烧杯中,向其中加入足量的稀盐酸,测得生成的气体与加入稀盐酸的质量关系如图所示,请回答下列问题:
 (1)、恰好完全反应时,产生的气体质量为g。(2)、求样品中CaCO3的质量分数。(3)、求恰好完全反应时,所得溶液中溶质的质量分数。
(1)、恰好完全反应时,产生的气体质量为g。(2)、求样品中CaCO3的质量分数。(3)、求恰好完全反应时,所得溶液中溶质的质量分数。
-