广东省东莞市2020-2021学年九年级上学期化学期中考试试卷
试卷更新日期:2021-11-18 类型:期中考试
一、单选题
-
1. 下列实验操作涉及化学变化的是( )A、
 过滤
B、
过滤
B、 利用简易净水器净化水
C、
利用简易净水器净化水
C、 电解水
D、
电解水
D、 水的蒸馏
2. 下列物质排放到空气中,不会造成大气污染的是( )A、一氧化碳 B、二氧化氮 C、二氧化碳 D、可吸入颗粒物3. 市场上有“葡萄糖酸锌”、“高钙牛奶”、“绿色碘盐”等商品,这里的“锌、钙、碘”指的是( )A、元素 B、分子 C、单质 D、原子4. 下列实验操作错误的是
水的蒸馏
2. 下列物质排放到空气中,不会造成大气污染的是( )A、一氧化碳 B、二氧化氮 C、二氧化碳 D、可吸入颗粒物3. 市场上有“葡萄糖酸锌”、“高钙牛奶”、“绿色碘盐”等商品,这里的“锌、钙、碘”指的是( )A、元素 B、分子 C、单质 D、原子4. 下列实验操作错误的是
A、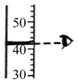 读取液体体积
B、
读取液体体积
B、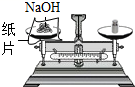 称量NaOH固体
C、
称量NaOH固体
C、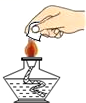 熄灭酒精灯
D、
熄灭酒精灯
D、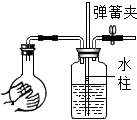 检查装置的气密性
5. 依据下图有关信息判断,下列说法正确的是( )
检查装置的气密性
5. 依据下图有关信息判断,下列说法正确的是( ) A、在元素周期表中,镁元素与氟元素属于同一周期 B、镁离子与氟离子核外电子数相等 C、镁原子与氟原子形成的化合物的化学式为Mg2F D、氟原子的核内有9个中子6. 关于金刚石、石墨、C60的叙述,正确的是( )A、都属于碳单质 B、都由碳原子构成 C、都具有导电性 D、完全燃烧产物不同7. “宏观解识与微观探析“是化学学科核心素养之一.下列微观解释正确的是( )
A、在元素周期表中,镁元素与氟元素属于同一周期 B、镁离子与氟离子核外电子数相等 C、镁原子与氟原子形成的化合物的化学式为Mg2F D、氟原子的核内有9个中子6. 关于金刚石、石墨、C60的叙述,正确的是( )A、都属于碳单质 B、都由碳原子构成 C、都具有导电性 D、完全燃烧产物不同7. “宏观解识与微观探析“是化学学科核心素养之一.下列微观解释正确的是( )选项
客观事实
微观解释
A
水银温度计测温度
原子的质量和体积都很小
B
Ca、Ca2+化学性质不同
微粒中的质子数不同
C
氧气(O2)和臭氧(O3)性质不同
构成物质的分子不同
D
碘受热升华
分子的体积变大
A、A B、B C、C D、D8. 下列关于实验的说法正确的是( )A、用氯酸钾分解制氧气收集完成后,先停止加热后撤离导管 B、收集一试管氢气,点燃后听到尖锐爆鸣声,说明氢气不纯 C、将表面光滑的铁钉放在硫酸铜溶液中,铁钉表面生成银白色固体 D、实验室不能用稀硫酸和大理石反应制取二氧化碳,因为它们不发生反应9. 下列描述与化学用语对应正确的是( )A、2个铁离子:Fe3+ B、2个O原子:O2 C、Na2SeO4中Se的化合价 D、氧化铝:AlO10. 根据化学方程式不能获得的信息是( )A、该反应中的反应物和生成物 B、各反应物和生成物的质量比 C、反应发生所需要的条件 D、化学反应的快慢11. 碳可以与浓硫酸在加热的条件下发生如下反应:C+2H2SO4(浓) CO2↑+2X↑+2H2O,其中X的化学式为( )A、SO2 B、SO3 C、O2 D、H2S12. 密闭容器中有一定质量的甲、乙、丙、丁四种物质,在一定条件下反应一段时 间后,测得各物质的质量如表所示:有关说法正确的是( )物质
甲
乙
丙
丁
反应前的质量/g
8.0
16.8
3.4
2.0
反应后的质量/g
11.4
10
X
2.0
A、该反应中甲与乙的质量比是 57:50 B、x=3.4 C、该反应属于分解反应 D、丁一定是催化剂13. 按如图进行实验,下列分析或结论正确的是( ) A、澄清石灰水的作用只是为了隔绝空气 B、实验结束应立即倒出试管内的粉末 C、本实验主要体现了木炭的可燃性 D、为提高火焰温度,应在酒精灯火焰周围罩一个网罩14. 一氧化碳是一种无色、无味但有剧毒的气体,其密度与空气很接近,难溶于水.现要收集一瓶一氧化碳气体,可采用的方法是( )A、向下排空气法 B、向上排空气法 C、排水法 D、向上排空气法或排水法15. 下列四个图象中能正确反应其对应实验操作的是( )A、
A、澄清石灰水的作用只是为了隔绝空气 B、实验结束应立即倒出试管内的粉末 C、本实验主要体现了木炭的可燃性 D、为提高火焰温度,应在酒精灯火焰周围罩一个网罩14. 一氧化碳是一种无色、无味但有剧毒的气体,其密度与空气很接近,难溶于水.现要收集一瓶一氧化碳气体,可采用的方法是( )A、向下排空气法 B、向上排空气法 C、排水法 D、向上排空气法或排水法15. 下列四个图象中能正确反应其对应实验操作的是( )A、 将水通电电解一段时间
B、
将水通电电解一段时间
B、 碳在含有氧气的密闭容器中燃烧,容器中碳元素的质量变化
C、
碳在含有氧气的密闭容器中燃烧,容器中碳元素的质量变化
C、 用两份相同的过氧化氢溶液分别制取氧气,生成气体质量的变化
D、
用两份相同的过氧化氢溶液分别制取氧气,生成气体质量的变化
D、 加热一定量的高锰酸钾,生成的氧气质量的变化
加热一定量的高锰酸钾,生成的氧气质量的变化
二、填空题
-
16. 生活处处离不开水。(1)、下列做法有利于节约水资源或减少水体污染的是;
①农业和园林浇灌改为喷灌、滴灌;②工业废水直接排入江河中;③生活污水集中处理和排放;④为提高农作物产量,大量使用化肥农药
(2)、一种净水机可以将水厂原水直接净化为饮用水,其中处理流程如图所示:
a.①中超滤膜可起到过滤不溶性杂质的作用,实验室过滤所需要的仪器有带铁圈的铁架台、烧杯、漏斗(含滤纸)和(填仪器名称),该仪器在过滤过程中的作用是;
b.步骤②对应的作用是;步骤③对应的作用是;
c.家中可以用鉴别硬水和软水,实验室可通过的方法降低水的硬度。
(3)、下列实验能证明水是由氢元素和氧元素组成的是(填字母序号)。A 氢气在氧气中燃烧 B 水的蒸发 C 水的电解 D 水的净化
请写出以上A选项涉及到的化学方程式。
17.(1)、高纯硅是制造手机CPU芯片的材料,工业上利用四氯化硅(SiCl4)为原料制高纯硅,此工艺流程简化示意图如下:
图中属于化合物的是(填 “甲”、“乙”、“丙"或“丁”),该反应的化学方程式为 , 请标出SiCl4中硅元素的化合价。
(2)、食醋的主要成分是乙酸,乙酸的分子结构模型如图所示,其 代表碳原子,
代表碳原子,  代表氢原子
代表氢原子  代表氧原子,
代表氧原子, 
①乙酸中碳、氢、氧元素的最简质量比为 , 其中氧元素在地壳中含量排第位;
②60g乙酸中碳元素的质量为g。
三、综合题
-
18. 如图所示是实验室制取气体的一些装置,据图回答有关问。(提示:以下所选装置均填装置的字母序号)
 (1)、写出指定仪器的名称:②。(2)、装置C中试管口略向下倾斜的原因是;在不添加任何仪器的情况下,利用C装置制取氧气,涉及到的化学方程式为:.(3)、若需收集(2)中所得气体供铁丝在氧气中燃烧的实验使用,应选用气体收集装置中的装置,理由是;利用该装置(填"能/不能)用于收集CO2气体。(4)、实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放出大量的热使发生装置炸裂。你认为图中最适合制取乙炔气体的发生装置是;用该装置也能制取二氧化碳,请写出实验室制取二氧化碳的化学方程式。19. 为验证质量守恒定律,某学习小组做了镁条在空气中燃烧的实验(图1)
(1)、写出指定仪器的名称:②。(2)、装置C中试管口略向下倾斜的原因是;在不添加任何仪器的情况下,利用C装置制取氧气,涉及到的化学方程式为:.(3)、若需收集(2)中所得气体供铁丝在氧气中燃烧的实验使用,应选用气体收集装置中的装置,理由是;利用该装置(填"能/不能)用于收集CO2气体。(4)、实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放出大量的热使发生装置炸裂。你认为图中最适合制取乙炔气体的发生装置是;用该装置也能制取二氧化碳,请写出实验室制取二氧化碳的化学方程式。19. 为验证质量守恒定律,某学习小组做了镁条在空气中燃烧的实验(图1) (1)、请写出镁条燃烧的化学方程式.(2)、镁条完全燃烧后,称量发现石棉网上的燃烧产物的质量反而比反应前镁条的质量小,其主导原因可能有.
(1)、请写出镁条燃烧的化学方程式.(2)、镁条完全燃烧后,称量发现石棉网上的燃烧产物的质量反而比反应前镁条的质量小,其主导原因可能有.A 燃烧增加了氧元素的质量 B 有部分白烟逸散在空气中 C 部分产物粘在坩埚钳上
故探究化学反应前后物质的总质量关系时,如反应过程中有气体参加或生成,需要在容器中进行。
(3)、小红按图2装置改进实验,验证了质量守恒定律,最终得出结论是:参加化学反应的各物质的质量总和(填"<”、“>"或"=")反应后生成的各物质的质量总和。(微观解释)从微观角度分析,在化学反应前后一定不变的是(选填序号)。①原子种类 ②分子种类 ③原子数目 ④分子质量 ⑤分子数目 ⑥原子质量
(4)、小红结束图2实验后发现产物中还有一些黄色固体。(查阅资料)①氧化镁为白色固体;②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
(提出问题)黄色固体是什么呢?
(做出猜想)黄色固体为Mg3N2
(实验探究)
实验操作
实验现象及结论
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B

现象:
结论:燃烧产物中含Mg3N2
(5)、(反思与交流)①空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2 , 请给出合理的解释。
②如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,结合注射器的刻度显示,最终测得氧气体积分数1/5(填“大于”、“小于或“等于”)。注射器在本实验中还具备的优点为:。
20. 空气是一种宝贵资源,如利用制得的氢气(H2)和空气中分离出的氮气(N2)合成氨气(NH3),下列是合成氨的工艺流程图: (1)、上述流程中可以回收利用的物质是和。(2)、将沸点不同的气体分离开,常采用液化分离法。如,控制温度在-183℃时,可将空气中氮气与氧气分离,这一过程是变化(填"物理”或"化学”)。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,温度应该控制在以下。
(1)、上述流程中可以回收利用的物质是和。(2)、将沸点不同的气体分离开,常采用液化分离法。如,控制温度在-183℃时,可将空气中氮气与氧气分离,这一过程是变化(填"物理”或"化学”)。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,温度应该控制在以下。物质
H2
N2
NH3
沸点/℃
-252
-195.8
-33.35
(3)、用“ 、
、  、
、  ” 分别表示N2、H2、NH3 , 观察下列微观图:
” 分别表示N2、H2、NH3 , 观察下列微观图: 
①请写出该反应的化学方程式 , 反应类型().
②请补充完整上图反应前后的微观示意图。
四、计算题
-
21. 工业上,在高温的条件下煅烧石灰石(主要成分是CaCO3)可生成氧化钙和二氧化碳.现利用该反应制取得到5.6t的氧化钙,请计算参与反应的CaCO3的质量是多少?