河北省九师联盟2021-2022学年高二上学期期中考试化学试题
试卷更新日期:2021-11-12 类型:期中考试
一、单选题
-
1. 下列反应中, <0且是氧化还原反应的是( )A、生石灰与水的反应 B、C与CO2在高温下的反应 C、KOH与盐酸的反应 D、碳与浓硫酸的反应2. 100mL3mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应进行的速率,又不影响生成氢气的总量,可向反应物中加入适量的( )A、Na2CO3固体 B、蒸馏水 C、NaNO3溶液 D、1mol/L的硫酸溶液3. 下列说法正确的是( )A、一个化学反应,不论是一步完成,还是分几步完成,其总的热效应相同 B、等质量的甲烷分别在足量的纯氧、空气中完全燃烧,前者放出的热量更多 C、 ,则稀H2SO4和稀Ba(OH)2溶液反应生成1mol水的反应热为-57.3kJ/mol D、 ,属于氧化还原反应,可设计成原电池4. 下列事实一定能说明HClO是弱电解质的是( )A、25℃时,用pH试纸测0.01mol/L的HClO溶液的pH为4 B、HClO水溶液中含有HClO分子和H+、ClO- C、10mL0.01mol/LHClO溶液恰好与10mL0.01mol/LNaOH溶液完全反应 D、次氯酸不稳定,在光照条件下易分解5. 《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知: , )下列说法正确的是( )
 A、Y膜为阳离子交换膜 B、每消耗1 mol O2外电路通过4 mol e- C、a极电极反应式:H2-2e-=2H+ D、b极电极反应式:6. N2O是一种温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
A、Y膜为阳离子交换膜 B、每消耗1 mol O2外电路通过4 mol e- C、a极电极反应式:H2-2e-=2H+ D、b极电极反应式:6. N2O是一种温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。途径Ⅰ:
途径Ⅱ:在N2O中加入少量碘蒸气
① (快反应)
② (慢反应)
③ (快反应)
下列表述错误的是( )
A、两途径消耗等量N2O时,能量变化相同 B、途径Ⅱ中反应②的活化能比反应③小 C、途径Ⅱ中N2O的分解速率由反应②决定 D、IO为反应的中间产物7. 某电动汽车的锂离子电池的工作原理如图所示。下列叙述正确的是( ) A、放电时,Li+从正极脱嵌,经过电解质溶液和离子交换膜嵌入负极 B、放电时,正极反应式为LixC6-xe-=C6+xLi+ C、充电时,阳极发生还原反应: D、电池工作时,负极材料减少a g,转移电子8. 下列实验操作和现象与对应结论或目的不相匹配的是( )
A、放电时,Li+从正极脱嵌,经过电解质溶液和离子交换膜嵌入负极 B、放电时,正极反应式为LixC6-xe-=C6+xLi+ C、充电时,阳极发生还原反应: D、电池工作时,负极材料减少a g,转移电子8. 下列实验操作和现象与对应结论或目的不相匹配的是( )选项
实验操作和现象
结论或目的
A
向锌和稀硫酸反应的试管中滴加几滴CuSO4溶液,气泡生成速率加快
CuSO4是该反应的催化剂
B
向5 mL0.1 mol/LKI溶液中滴入0.1 mol/LFeCl3溶液5~6滴,加2 mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象
验证Fe3+与I的反应有一定限度
C
将撒有Na2O2的脱脂棉放在石棉网上,然后向其中滴加少量H2O,观察现象
验证Na2O2与H2O反应放热
D
平衡体系中加入少量FeCl3固体,观察溶液颜色变化
验证勒夏特列原理
A、A B、B C、C D、D9. 已知: ; 。在一定压强下,测得由CO2(g)与H2(g)制取C2H5OH(g)的实验数据中,起始投料比温度与CO2平衡转化率的关系如图所示。下列有关说法正确的是( ) A、由CO2(g)与H2(g)制取C2H5OH(g)的反应吸热 B、图中温度 C、图中投料比中的反应物X与Y分别指CO2与H2 D、图中曲线最低温度、起始投料比为2时,H2平衡转化率为90%10. 下列各图所示装置不能达到实验目的的是( )
A、由CO2(g)与H2(g)制取C2H5OH(g)的反应吸热 B、图中温度 C、图中投料比中的反应物X与Y分别指CO2与H2 D、图中曲线最低温度、起始投料比为2时,H2平衡转化率为90%10. 下列各图所示装置不能达到实验目的的是( ) A、图甲,验证铁的吸氧腐蚀 B、图乙,验证牺牲阳极的阴极保护法 C、图丙,在铁制品表面镀锌 D、图丁,验证铝和稀盐酸反应是放热反应11. 采用如图装置将粗镍提纯。(固体杂质不参与反应)将粗镍粉末装入石英管一端,抽真空后通入适量CO并封管,已知发生反应: 。下列判断正确的是( )
A、图甲,验证铁的吸氧腐蚀 B、图乙,验证牺牲阳极的阴极保护法 C、图丙,在铁制品表面镀锌 D、图丁,验证铝和稀盐酸反应是放热反应11. 采用如图装置将粗镍提纯。(固体杂质不参与反应)将粗镍粉末装入石英管一端,抽真空后通入适量CO并封管,已知发生反应: 。下列判断正确的是( ) A、温区b为高温区 B、在提纯过程中,需要补充CO C、c[Ni(CO)4]:低温区<高温区 D、CO的作用是将Ni从低温区转移到高温区
A、温区b为高温区 B、在提纯过程中,需要补充CO C、c[Ni(CO)4]:低温区<高温区 D、CO的作用是将Ni从低温区转移到高温区二、多选题
-
12. 关于如图所示转化关系(X代表卤素),下列说法正确的是( )
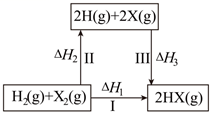 A、 B、 C、若X分别表示Cl、Br、I,则过程Ⅱ吸收的热量依次增多 D、Cl2(g)、I2(g)分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K3 , 则13. 向1L密闭容器中充入足量的焦炭和1molSO2(g)发生反应: 。测得SO2的生成速率与S2(g)的生成速率随温度变化如图所示。下列说法正确的是( )
A、 B、 C、若X分别表示Cl、Br、I,则过程Ⅱ吸收的热量依次增多 D、Cl2(g)、I2(g)分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K3 , 则13. 向1L密闭容器中充入足量的焦炭和1molSO2(g)发生反应: 。测得SO2的生成速率与S2(g)的生成速率随温度变化如图所示。下列说法正确的是( ) A、正反应的活化能小于逆反应的活化能 B、达到平衡后再加热,平衡向正反应方向移动 C、A,B,C,D四点对应状态下,达到平衡状态的是B、D D、达到平衡后缩小容器容积,重新达到平衡后,SO2的平衡转化率增大
A、正反应的活化能小于逆反应的活化能 B、达到平衡后再加热,平衡向正反应方向移动 C、A,B,C,D四点对应状态下,达到平衡状态的是B、D D、达到平衡后缩小容器容积,重新达到平衡后,SO2的平衡转化率增大三、综合题
-
14. 一定条件下,在一密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示,测得3min时反应放出的热量为58.8kJ。回答下列问题:
 (1)、若在体积为4L的恒容容器中进行该反应,0~3min内用气体C表示该反应的平均速率:v(C)= , 写出该反应的热化学方程式:。(2)、该反应的反应速率v随时间t的关系如图乙所示。
(1)、若在体积为4L的恒容容器中进行该反应,0~3min内用气体C表示该反应的平均速率:v(C)= , 写出该反应的热化学方程式:。(2)、该反应的反应速率v随时间t的关系如图乙所示。
根据图乙判断,在t3时刻改变的外界条件是;①、②、③对应的平衡状态中,气体C的体积分数最大的状态是(填“①”“②”或“③”)。
(3)、一定温度下,在刚性密闭容器中发生上述反应,下列情况能判断反应达到化学平衡状态的是(填字母)。a.容器中压强不变
b.混合气体密度不变
c.v正(A)=v逆(C)
d.混合气体平均相对分子质量不变
(4)、为研究上述反应,某同学设计了以下三种已装有相同固体催化剂的密闭容器:
在初始体积与温度相同的条件下,甲、乙、丙中均按2mol B、1mol A投料,达平衡时,三个容器中气体B的体积分数从大到小的顺序为(用“甲、乙、丙”表示)。
15. 弱电解质的电离平衡与日常生活、工农业生产等息息相关。回答下列问题:(1)、Ⅰ.部分弱酸的电离平衡常数如下表:弱酸
HCOOH
H2S
H2CO3
HClO
电离平衡常数(25℃)
HCOOH的电离方程式为。
(2)、HCOOH、H2S、H2CO3、HClO的酸性由强到弱的顺序为。(3)、同浓度的HCOO-、S2-、CO 、ClO-结合H+的能力由强到弱的顺序为。(4)、根据上述电离常数及物质的特性判断下列化学反应方程式错误的是(填序号)。①次氯酸与NaHCO3溶液的反应:
②少量CO2通入NaClO溶液中:
③硫化氢气体通入NaClO溶液中:
④碳酸钠滴入足量甲酸溶液中:
(5)、Ⅱ.常压下,某化学兴趣小组取不同浓度、不同温度的醋酸进行各项内容的测定,得到下表实验数据。温度/℃
c(CH3COOH)/mol/L
电离常数
电离度/%
c(H+)/mol/L
0
16.06
9.098
10
15.16
10.18
20
13.63
11.2
已知:电离度=
温度升高,CH3COOH的电离平衡向(填“左”或“右”)移动,能支持该结论的表中数据是(填字母)。
a.c(H+) b.电离度 c.电离常数 d.c(CH3COOH)
(6)、表中c(H+)基本不变的原因是。(7)、常温下,在醋酸溶液中加入纯醋酸,醋酸的电离度(填“增大”“减小”或“不变”下同);在醋酸溶液中加入一定量的醋酸钠晶体,醋酸的电离度。16. 为了探究原电池和电解池的工作原理,某研究性学习小组分别用如图所示的装置进行实验。回答下列问题:(1)、该小组同学用图1、图2装置进行第一组实验,图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是熔融碳酸盐燃料电池。
①图2电池负极区的电极反应为。
②若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现色,与铅笔接触芯接触的c位置的电极反应式为。
③若用淀粉-KI溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则导线a接的是(填“A”或“B”)电极。
(2)、该小组同学用图3装置进行第二组实验时发现,两极均有气体产生,Y极溶液逐渐变成紫红色。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。查阅资料知,高铁酸根离子(FeO )在溶液中呈紫红色,Na2FeO4只在强碱性条件下稳定。
①电解过程中,X极溶液的pH(填“增大”“减小”或“不变”)。
②电解过程中,Y极生成气体及Y极溶液逐渐变成紫红色发生的电极反应式分别为、。
③c(Na2FeO4)随初始c(NaOH)的变化如图4,分析c(Na2FeO4)变化趋势不同的原因:。
 17. 汽车尾气中含有CO、NO等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。(1)、已知:
17. 汽车尾气中含有CO、NO等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。(1)、已知:①
,
② ,
则 = , 请写出用k1正、k1逆、k2正、k2逆表示该反应在一定温度下的平衡常数表达式K=。
(2)、某实验小组模拟汽车尾气CO与NO净化过程,将CO与NO混合气体充入密闭容器中,发生反应: ,测得平衡时NO、CO的转化率(α)与起始投料比 关系如图1所示,v正~c(CO)的关系如图2所示。
①图1中CO的转化率曲线为(填“M”或“N”),图2中当X点升高到某一温度时,反应重新达到平衡,则变成相应的点为(填图2中的字母)。
②一定温度下,若起始投料比 、反应开始刚性容器总压为80kPa,研究表明:该反应的正反应速率 ,当反应达到平衡状态时测得该温度下 ,则p(CO) =kPa,v正=( ),该温度下 的化学平衡常数Kp=kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③为研究温度对CO转化率的影响,将一定量的CO与NO置于密闭容器中,保持相同的反应时间,CO转化率与温度关系如图3所示,在 及 两个温度区间所示的CO转化率变化趋势不同,其原因是。
