北京市海淀区2021-2022学年高三上学期期中考试化学试题
试卷更新日期:2021-11-12 类型:期中考试
一、单选题
-
1. 我国“天问一号”探测器使用了大量新材料,其中属于金属材料的是( )A、探测器结构材料——镁铝合金 B、深空太阳能电池材料——砷化镓 C、隔热组件材料——二氧化硅纳米气凝胶 D、柔性可伸缩材料——形状记忆聚合物2. 下列有关放射性核素 的说法中,错误的是( )A、 原子核外电子数为15 B、 原子的质量数为15 C、 可能用于同位素示踪 D、 和 的化学性质基本相同3. 下列化学用语或图示表达错误的是( )A、二氧化碳的电子式:
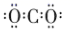 B、乙烯的结构式:
B、乙烯的结构式: 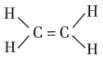 C、乙醇的分子模型:
C、乙醇的分子模型:  D、镁原子的结构示意图:
D、镁原子的结构示意图:  4. 用NA代表阿伏加德罗常数的值,下列说法正确的是( )A、6.2g Na2O中的离子总数为0.2NA B、pH=2的盐酸中的H+总数为0.01NA C、2.3g Na和足量O2反应转移电子数为0.1NA D、标准状况下,5.6L H2O所含O-H键的数目为0.5NA5. 下列反应中, 表现出氧化性的是( )A、 B、 C、 D、6. 维生素C的结构如图所示。下列说法错误的是( )
4. 用NA代表阿伏加德罗常数的值,下列说法正确的是( )A、6.2g Na2O中的离子总数为0.2NA B、pH=2的盐酸中的H+总数为0.01NA C、2.3g Na和足量O2反应转移电子数为0.1NA D、标准状况下,5.6L H2O所含O-H键的数目为0.5NA5. 下列反应中, 表现出氧化性的是( )A、 B、 C、 D、6. 维生素C的结构如图所示。下列说法错误的是( ) A、维生素C中所含的官能团是羟基、酯基和碳碳双键 B、维生素C能使溴水、酸性 溶液褪色 C、维生素C可保存在强碱性环境中 D、维生素C分子中含有σ键和π键7. 下列物质的应用中,主要利用的反应不属于氧化还原反应的是( )A、用铝和氧化铁的混合物焊接铁轨 B、用氮气实现工业合成氨 C、实验室用NaOH溶液吸收 尾气 D、用湿润的淀粉碘化钾试纸检验8. 以下是某种粗盐(主要含 、 、 等杂质离子)精制成NaCl溶液的部分流程。下列说法错误的是( )
A、维生素C中所含的官能团是羟基、酯基和碳碳双键 B、维生素C能使溴水、酸性 溶液褪色 C、维生素C可保存在强碱性环境中 D、维生素C分子中含有σ键和π键7. 下列物质的应用中,主要利用的反应不属于氧化还原反应的是( )A、用铝和氧化铁的混合物焊接铁轨 B、用氮气实现工业合成氨 C、实验室用NaOH溶液吸收 尾气 D、用湿润的淀粉碘化钾试纸检验8. 以下是某种粗盐(主要含 、 、 等杂质离子)精制成NaCl溶液的部分流程。下列说法错误的是( ) A、①中的除杂试剂可以是 溶液 B、②中加入过量 溶液后,只有 被除去 C、③中加入过量NaOH溶液后过滤,还需加适量稀盐酸 D、杂质离子的去除顺序还可以是③①②9. 下列方程式能准确解释相应事实的是( )A、硫酸型酸雨的形成: B、84消毒液不能与洁厕灵混用: C、和面时在小苏打中加少量醋酸,增强效果: D、向 溶液中加入足量 溶液,得到白色沉淀:10. 实验室制备下列气体所选试剂、制备装置及收集方法均正确的是( )
A、①中的除杂试剂可以是 溶液 B、②中加入过量 溶液后,只有 被除去 C、③中加入过量NaOH溶液后过滤,还需加适量稀盐酸 D、杂质离子的去除顺序还可以是③①②9. 下列方程式能准确解释相应事实的是( )A、硫酸型酸雨的形成: B、84消毒液不能与洁厕灵混用: C、和面时在小苏打中加少量醋酸,增强效果: D、向 溶液中加入足量 溶液,得到白色沉淀:10. 实验室制备下列气体所选试剂、制备装置及收集方法均正确的是( )
气体
试剂
制备装置
收集方法
A
和浓盐酸
b
e
B
Cu和稀硫酸
b
c
C
NO
Cu和稀硝酸
b
c
D
和
a
d
A、A B、B C、C D、D11. 常温常压下,1体积水能溶解约700体积 。用下图所示装置进行实验,下列说法正确的是( ) A、挤压滴管并打开止水夹后,观察到烧杯中的水倒吸,产生红色“喷泉” B、“喷泉”的产生能证明 与 发生了反应 C、若将 换成 ,也能产生明显的“喷泉” D、实验后,取出烧瓶中的溶液,测得其 ,原因是: ,12. 以CO和 为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将 转化为甲醇。
A、挤压滴管并打开止水夹后,观察到烧杯中的水倒吸,产生红色“喷泉” B、“喷泉”的产生能证明 与 发生了反应 C、若将 换成 ,也能产生明显的“喷泉” D、实验后,取出烧瓶中的溶液,测得其 ,原因是: ,12. 以CO和 为原料合成甲醇是工业上的成熟方法,直接以 为原料生产甲醇是目前的研究热点。我国科学家用 人工合成淀粉时,第一步就需要将 转化为甲醇。已知:①
②
③
下列说法错误的是( )
A、若温度不变,反应①中生成 时,放出的热量大于90.5kJ B、 与 合成甲醇的热化学方程式为: C、通过电解制 和选用高效催化剂,可降低 与 合成甲醇的反应的焓变 D、以 和 为原料合成甲醇,同时生成 ,该反应需要吸收能量13. 水体中的局部氮循环如下图所示,其中含氮物质转化方向与水深有关。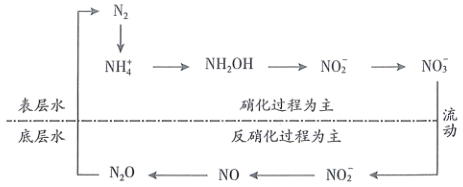
下列说法错误的是( )
A、图中涉及的反应均为氧化还原反应 B、反硝化过程中含N物质被还原 C、不同水深含氮物质转化方向不同,可能与溶氧量有关 D、排放含 废水不会影响水体中 的浓度14. 研究小组在探究卤素离子与硝酸银的反应时,进行了以下实验。编号
操作
试剂
现象
1
①KCl溶液②稀硝酸酸化的 溶液
产生白色沉淀
2
①KCl溶液②浓硝酸酸化的 溶液
产生白色沉淀
3
①KI溶液 ②稀硝酸酸化的 溶液
产生黄色沉淀
4
①KI溶液 ②浓硝酸酸化的 溶液
产生褐色的浊液
下列说法错误的是( )
A、实验1和2说明,硝酸浓度不影响 的检验 B、实验1和3说明,卤素离子的检验可使用稀硝酸酸化的 溶液 C、对比实验2和4,说明异常现象的产生与卤素离子种类有关 D、由上述实验推测, 的检验不能使用浓硝酸酸化的 溶液二、综合题
-
15. 钛酸钙是最典型的钙钛矿型化合物,该类化合物具有特殊的理化性质。(1)、基态 的核外电子排布式为。(2)、钛酸钙的晶胞如图所示,1个晶胞中含有 的个数是。离子半径 大于 ,理由是。
 (3)、钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
(3)、钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。①晶体密度 可以用晶胞的质量除以体积来求算。已知,钛酸钙晶胞的棱长为a pm( ),则钛酸钙晶体密度 (列出计算式)
②若忽略离子替代时的体积变化,下列钙钛矿型化合物中,密度大于钛酸钙的是(填字母序号)
a. b. c.
(4)、通过离子替代可获得具有优异光电性能的有机钙钛矿型化合物 。其中有机阳离子 可由甲胺( )制得。① 中N的杂化方式为。
②请从化学键的角度解释由甲胺形成 的过程:。
16. 碘是人体必须的微量元素之一,海洋植物如海带、海藻中含有丰富的碘元素。在实验室中,从海藻里提取碘的流程如下: (1)、指出上述过程中有关实验操作的名称,步骤i: , 步骤iii:。(2)、步骤ii中可使用 ,从原子结构角度说明理由:。 过量时,可能无法获得 ,原因是 会被继续氧化为 ,该反应的离子方程式为。(3)、当使用 做氧化剂时, 的转化率受外界因素的影响如下图所示。
(1)、指出上述过程中有关实验操作的名称,步骤i: , 步骤iii:。(2)、步骤ii中可使用 ,从原子结构角度说明理由:。 过量时,可能无法获得 ,原因是 会被继续氧化为 ,该反应的离子方程式为。(3)、当使用 做氧化剂时, 的转化率受外界因素的影响如下图所示。
①图1中, 时 转化率几乎为0,结合离子方程式解释原因:。
②图2中, 与 物质的量之比从0.5﹕1提高至1﹕1时, 的转化率明显增大,可能的原因是(写出2条)。
17. 软锰矿浆(主要成分 )可吸收烟气中的 ,同时可制备 ,工艺流程如下: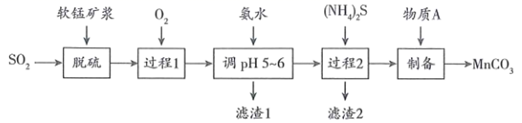
资料:①吸收 后的软锰矿浆中含有 、 、 、 等阳离子;
②金属离子沉淀的pH如下表。
金属离子
开始沉淀的pH
8.1
6.3
1.5
3.4
6.2
沉淀完全的pH
10.1
8.3
2.8
4.7
8.2
(1)、脱硫的产物是 ,软锰矿中 所起的作用是。(2)、过程1向浆液中通入 的目的是。(3)、滤渣1的成分是 , 过程2中发生反应的离子方程式为。(4)、制备 的过程中,一般控制溶液的pH范围为5~7,不宜过大或过小,原因是。(5)、已知:常温下, 溶液的pH约为9.3, 溶液的pH约为7.8.请推测物质A,并写出制备 时发生反应的离子方程式:。(6)、取m g碳酸锰样品,加适量硫酸加热溶解后,用 的 溶液滴定,至滴定终点时,消耗 溶液的体积为 。(已知:反应产物为 ,杂质不参与反应),样品中 质量分数的计算式为(用质量分数表示)。18. W、X、Y、Z为同一周期的四种主族元素,原子序数依次增大。基态Y原子的价电子排布为 ,X的电离能数据如下表所示。电离能
/
738
1451
7733
10540
(1)、X在元素周期表中的位置是。(2)、用电子式表示WZ的形成过程:。(3)、下列事实能用元素周期律解释的是___________(填字母序号)。A、W可用于制备活泼金属钾 B、Y的气态氢化物的稳定性小于 C、将Z单质通入 溶液中,溶液变浑浊 D、Y的氧化物对应的水化物 的酸性比 强(4)、为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。i.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为 ,该水化物中的 结构有两种断键方式:断 键在水中电离出 ;断 键在水中电离出 。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一、水化物的 结构中,成键原子电负性差异越大,所形成的化学键越容易断裂。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响 中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈(填“酸”或“碱”)性,依据是。
②W和X的最高价氧化物对应的水化物中,碱性较强的是(写化学式),结合资料说明理由:。
19. 某实验小组同学用KSCN探究久置 固体变质的情况。将0.3 g 固体用10mL蒸馏水溶解,配成待测液,进行实验。(1)、(初步实验)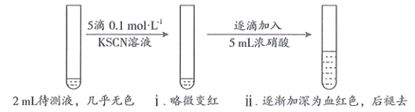
用KSCN检验 的原理是(用离子方程式表示)。
(2)、甲同学认为 固体几乎未变质,ⅱ中变血红色是由于 被氧化,反应的离子方程式为;ⅱ中血红色褪去的可能原因是。(3)、乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与其它因素有关,可能的影响因素是。(4)、(继续探究)步骤
操作
现象
Ⅰ
取2mL待测液,加入5滴0.1 KSCN溶液,再加入5mL浓 溶液
溶液颜色无明显变化
Ⅱ
取2mL待测液,
溶液变为红色
Ⅲ
向Ⅱ中所得溶液中逐滴加入5mL浓硝酸,边加边振荡
溶液逐渐加深为血红色,继续滴加浓硝酸,溶液褪色,pH变化始终不明显
(5)、请补全步骤Ⅱ中的操作:。(6)、由Ⅰ~Ⅲ推测 固体变质的情况是(填字母序号),理由是。a.几乎未变质 b.部分变质 c.完全变质
(7)、(反思与迁移)从上述探究中获得启发,在用KSCN检验 及进行 还原性验证实验时,需要注意的事项有(至少2条)。