浙江省杭州地区(含周边)重点中学2021-2022学年高三上学期期中考试化学试题
试卷更新日期:2021-11-12 类型:期中考试
一、单选题
-
1. 下列物质属于纯净物的是( )A、冰醋酸 B、漂白粉 C、铝热剂 D、水玻璃2. 下列电解质在熔融状态下不导电的是( )A、KOH B、Na2CO3 C、AlCl3 D、BaSO43. 下列物质的化学成分错误的是( )A、碳铵:NH4HCO3 B、摩尔盐: C、熟石膏: D、油酸甘油酯:
 4. 蒸馏操作中不需要用到的仪器是( )A、
4. 蒸馏操作中不需要用到的仪器是( )A、 B、
B、 C、
C、 D、
D、 5. 下列表示错误的是( )A、葡萄糖的实验式: B、氨基的电子式:
5. 下列表示错误的是( )A、葡萄糖的实验式: B、氨基的电子式: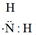 C、2, 二甲基戊烷的键线式:
C、2, 二甲基戊烷的键线式:  D、丁烷的球棍模型:
D、丁烷的球棍模型:  6. 下列说法正确的是( )A、 和 互为同位素 B、金刚石和富勒烯互为同素异形体 C、乙醚和乙醇互为同分异构体 D、
6. 下列说法正确的是( )A、 和 互为同位素 B、金刚石和富勒烯互为同素异形体 C、乙醚和乙醇互为同分异构体 D、 和
和 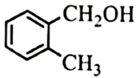 互为同系物
7. 关于有机反应类型,下列判断错误的是( )A、 (加成反应) B、 (氧化反应) C、 (消去反应) D、 (取代反应)8. 关于反应: ,下列说法正确的是( )A、Cu(IO3)2发生氧化反应 B、CuI既是氧化产物又是还原产物 C、生成191g CuI时,转移11 mol电子 D、还原剂与氧化剂的物质的量之比为12:19. 下列说法错误的是( )A、纳米铁粉可去除水体中的Pb2+、Cu2+等重金属离子 B、SO2与过量氨水反应生成 C、天然气不完全燃烧会产生有毒气体 D、H2O2溶液中加入少量MnO2粉末生成H2和O210. 下列说法错误的是( )A、 可用于自来水消毒 B、 可用作治疗胃酸过多的药物 C、 不可用做食品防腐剂和肉类食品的发色剂 D、生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐11. 下列说法正确的是( )A、变色硅胶干燥剂含有CoCl2 , 干燥剂呈蓝色时,表示不具有吸水干燥功能 B、火柴头的浸泡液中滴加AgNO3溶液、稀HNO3 , 可检验火柴头是否含有氯元素 C、金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并用硫黄处理 D、提纯混有少量硝酸钾的氯化钠,应采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法12. 下列“类比”结果错误的是( )A、 的热稳定性比 的弱,则 的热稳定性比 的弱 B、 的分子构型为V形,则 的分子构型为V形 C、纯水的电离 ,则液氨的电离 D、 通入 溶液中无沉淀生成,则 通入 溶液中也没有沉淀生成13. 下列反应的方程式错误的是( )A、铝溶于氢氧化钠溶液: B、溴乙烷和 水溶液反应: C、 溶液中滴加过量氨水: D、硫代硫酸钠和稀硫酸反应:14. 有关
互为同系物
7. 关于有机反应类型,下列判断错误的是( )A、 (加成反应) B、 (氧化反应) C、 (消去反应) D、 (取代反应)8. 关于反应: ,下列说法正确的是( )A、Cu(IO3)2发生氧化反应 B、CuI既是氧化产物又是还原产物 C、生成191g CuI时,转移11 mol电子 D、还原剂与氧化剂的物质的量之比为12:19. 下列说法错误的是( )A、纳米铁粉可去除水体中的Pb2+、Cu2+等重金属离子 B、SO2与过量氨水反应生成 C、天然气不完全燃烧会产生有毒气体 D、H2O2溶液中加入少量MnO2粉末生成H2和O210. 下列说法错误的是( )A、 可用于自来水消毒 B、 可用作治疗胃酸过多的药物 C、 不可用做食品防腐剂和肉类食品的发色剂 D、生物炼铜中通常利用某些细菌把不溶性的硫化铜转化为可溶性铜盐11. 下列说法正确的是( )A、变色硅胶干燥剂含有CoCl2 , 干燥剂呈蓝色时,表示不具有吸水干燥功能 B、火柴头的浸泡液中滴加AgNO3溶液、稀HNO3 , 可检验火柴头是否含有氯元素 C、金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并用硫黄处理 D、提纯混有少量硝酸钾的氯化钠,应采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法12. 下列“类比”结果错误的是( )A、 的热稳定性比 的弱,则 的热稳定性比 的弱 B、 的分子构型为V形,则 的分子构型为V形 C、纯水的电离 ,则液氨的电离 D、 通入 溶液中无沉淀生成,则 通入 溶液中也没有沉淀生成13. 下列反应的方程式错误的是( )A、铝溶于氢氧化钠溶液: B、溴乙烷和 水溶液反应: C、 溶液中滴加过量氨水: D、硫代硫酸钠和稀硫酸反应:14. 有关 的说法错误的是( ) A、分子中至少有12个原子共平面 B、 该物质最多可以和 反应 C、该分子中有2个手性碳原子 D、可与浓溴水发生取代反应15. 叠氮化钠 用作汽车司机安全防护袋(内有 )的气源:可用次氯酸钠溶液对含有 的溶液进行销毁,产生无毒无害物质,下列说法错误的是( )A、叠氮钠 水溶液呈碱性 B、当汽车受撞击时产生的 与 反应产物为 和 C、安全防护袋内 可用 或 代替 D、销毁时的反应:16. 恒温恒压下,下列过程一定不能自发进行的是( )A、 B、 C、 D、17. 设 为阿伏加德罗常数的值,下列说法错误的是( )A、常温常压下, 甲基 中含有的电子数为 B、 和 (均为标准状况)在光照下充分反应后的分子数为 C、 与 混合气体中含 键的数目为 D、 的 溶液中 离子数为18. 时,下列说法错误的是( )A、 、 的醋酸浴液的电离度分别为 ,则 B、 相等的盐酸、 溶液, C、 的 溶液中水电离出 的物质的量为 D、中和 和体积均相等的醋酸、盐酸溶液,所需 的物质的量前者多19. 探究某反应 ,反应物浓度与初始反应速率的关系,在 、恒容密闭容器中充入 进行实验,所得数据如下表:
的说法错误的是( ) A、分子中至少有12个原子共平面 B、 该物质最多可以和 反应 C、该分子中有2个手性碳原子 D、可与浓溴水发生取代反应15. 叠氮化钠 用作汽车司机安全防护袋(内有 )的气源:可用次氯酸钠溶液对含有 的溶液进行销毁,产生无毒无害物质,下列说法错误的是( )A、叠氮钠 水溶液呈碱性 B、当汽车受撞击时产生的 与 反应产物为 和 C、安全防护袋内 可用 或 代替 D、销毁时的反应:16. 恒温恒压下,下列过程一定不能自发进行的是( )A、 B、 C、 D、17. 设 为阿伏加德罗常数的值,下列说法错误的是( )A、常温常压下, 甲基 中含有的电子数为 B、 和 (均为标准状况)在光照下充分反应后的分子数为 C、 与 混合气体中含 键的数目为 D、 的 溶液中 离子数为18. 时,下列说法错误的是( )A、 、 的醋酸浴液的电离度分别为 ,则 B、 相等的盐酸、 溶液, C、 的 溶液中水电离出 的物质的量为 D、中和 和体积均相等的醋酸、盐酸溶液,所需 的物质的量前者多19. 探究某反应 ,反应物浓度与初始反应速率的关系,在 、恒容密闭容器中充入 进行实验,所得数据如下表:相关数据实验编号
①
②
③
④
⑤
0.006
0.001
0.006
0.002
0.003
0.001
0.006
0.002
0.006
0.006
v初始
下列结论错误的是( )
A、实验②、④,探究的是 对反应速率的影响 B、反应达到化学平衡后,温度降低,逆反应速率减小幅度大于正反应速率减小幅度 C、若该反应速率方程为 (k为常数),则 D、实验⑤经过 达到化学平衡,用 表示的平均反应速率为20. 已知NaHCO3溶液与盐酸,反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2放热。关于下列△H的判断正确的是( )A、 B、 C、 D、21. 电解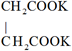 和 的混合溶液制备乙烯,下列说法错误的是( ) A、
和 的混合溶液制备乙烯,下列说法错误的是( ) A、 +
B、
+
B、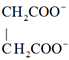 在阳极放电,发生氧化反应
C、阴极的电极反应:
D、电解
在阳极放电,发生氧化反应
C、阴极的电极反应:
D、电解 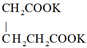 的 混合溶液可得到丙烯
22. 汽车尾气通过 和 的相互转化实现 的储存(过程Ⅱ)和还原(过程Ⅱ)。
的 混合溶液可得到丙烯
22. 汽车尾气通过 和 的相互转化实现 的储存(过程Ⅱ)和还原(过程Ⅱ)。
下列说法错误的是( )
A、 吸收 的反应中氧化剂与还原剂的物质的量之比是 B、若柴油中硫含量较高,在燃烧过程中, 吸收氮氧化物的能力会下降 C、 的储存和还原过程中是 催化剂 D、尾气处理的总反应为:23. 下列方案设计、现象和结论都正确的是( )目的
方案设计
现象和结论
A
探究镀锌铁皮的锌镀层是否已反应完全
将镀锌铁皮放入烧杯中,加入稀硫酸。用玻璃棒小心翻动镀锌铁皮,使其充分反应
若产生氢气的速率突然减小,则锌镀层已反应完全
B
探究某牙膏中是否含有甘油
取少量样品,加入适量蒸馏水,搅拌、静置,取上层清液,滴加适量新制
若有绛蓝色沉淀生成,则该产品中含有甘油
C
探究某溶液中有 ,无
向某溶液中滴加 溶液
若产生蓝色沉淀,则原溶液中有 ,无
D
探究淀粉水解程度
向淀粉溶液中加入硫酸溶液,加热后滴入几滴氢氧化铜悬浊液,再加热至沸腾
若未出现红色物质,则淀粉未水解
A、A B、B C、C D、D二、多选题
-
24. 常温下,用 盐酸滴定 某弱碱 溶液,所得溶液 、 和 的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述错误的是( )
 A、曲线①代表 ,曲线②代表 B、b点溶液中存在 C、 的电离平衡常数为 D、a、b、c三点的溶液,水的电离程度
A、曲线①代表 ,曲线②代表 B、b点溶液中存在 C、 的电离平衡常数为 D、a、b、c三点的溶液,水的电离程度三、填空题
-
25. 回答下列问题:(1)、硅和卤素单质反应可以得到 , 的熔沸点如下表:
熔点/K
183
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
、 、 、 沸点依次升高的原因是。
(2)、肥皂的主要成分是硬脂酸钠 ,在水溶液中电离成 和 。将沾了油污的衣物擦上肥皂搓洗时,将衣物洗净的去污原理是。26. 电解法测定铜的相对原子质量的装置如图所示,调节电阻使电流稳定在 ,通电电解 。取下铜片,水洗、醇洗后晾干,精确称量如下: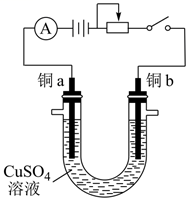
电解前:铜a与铜b的质量分别 和 :
电解后:铜a与铜b的质量分别 和 。
已知: 电子的电量为 ,电路中通过的总电量 (t单位为秒)。
则测得的铜元素的相对原子质量为(计算结果保留3位有效数字),写出简要计算过程。
四、综合题
-
27. 回答下列问题:(1)、Ⅰ.化合物X由四种元素组成的物质,可做净水剂,为探究其组成,设计实验如下:
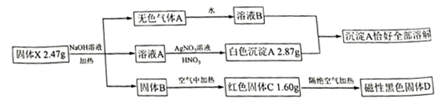
请回答:
组成X的四种元素为:Fe、Cl和(填元素符号),X的化学式为:。
(2)、写出白色沉淀A溶于溶液B的离子反应方程式:。(3)、红色固体C隔绝空气加热生成黑色磁性固体D的化学反应方程式为:。(4)、Ⅱ.某课外活动小组的同学研究过量铁粉与某浓度稀硝酸反应实验,他们设计了如图所示实验装置。
室温下,在注射器中加入铁粉与硝酸,立即有气体产生,将气体通入装有空气的容器,无明显变化,点燃气体有尖锐的爆鸣声,容器壁出现无色液滴,该气体为。
(5)、取反应后溶液,加入足量NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,写出生成该还原产物的离子方程式:。28. 丙烯是重要的工业品,可用于制取卤代烃、丙醇及塑料等。工业中以丙烷催化脱氢来制取丙烯:主反应:副反应:
(1)、已知部分化学键的键能如下表:共价键
键能
348
615
413
436
。
(2)、不同温度下,丙烷以相同的流速经过装有催化剂的管道,测得丙烷转化率、丙烯选择性和温度的关系如图1所示。下列有关丙烷催化脱氢反应说法正确的是_____。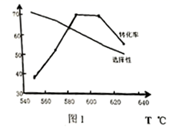 A、主、副反应的 相等 B、温度升高,丙烯的产率增大 C、单位时间内生成 键,同时消耗 键,反应未达到平衡 D、低温有利于 键断键,高温有利于 键断键 E、高于 ,温度升高,主、副反应平衡逆移,导致丙烷转化率下降(3)、某 时,在 密闭反应器中加入 丙烷进行催化脱氢实验,测得 和 的产率随时间的变化关系,如图2所示。
A、主、副反应的 相等 B、温度升高,丙烯的产率增大 C、单位时间内生成 键,同时消耗 键,反应未达到平衡 D、低温有利于 键断键,高温有利于 键断键 E、高于 ,温度升高,主、副反应平衡逆移,导致丙烷转化率下降(3)、某 时,在 密闭反应器中加入 丙烷进行催化脱氢实验,测得 和 的产率随时间的变化关系,如图2所示。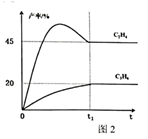
① 前,相同时间内, 的产率高于 的原因是。
② 时,主反应的平衡常数 。(保留2位有效数字)
③在下图3中绘制主、副的“能量~反应过程”示意图。
 (4)、丙烷制丙烯还可以用 氧化脱氢,即在 气氛下,进行氧化脱氢制丙烯。该工艺可以有显著的优点:一是有效消除催化剂表面的积炭,维持催化剂的活性;二是。29. 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黃铜(Cu、Zn合金,含少量杂质Fe)制备阿司匹林铜[
(4)、丙烷制丙烯还可以用 氧化脱氢,即在 气氛下,进行氧化脱氢制丙烯。该工艺可以有显著的优点:一是有效消除催化剂表面的积炭,维持催化剂的活性;二是。29. 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黃铜(Cu、Zn合金,含少量杂质Fe)制备阿司匹林铜[ ]及副产物ZnO。制备流程图如下:
]及副产物ZnO。制备流程图如下: 
已知:①Zn及化合物的性质与Al及化合物的性质相似。
②阿司匹林铜的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂,受热不稳定,遇强酸解离为阿司匹林(
 )和Cu2+。
)和Cu2+。③阿司匹林铜的测定,用Na2S2O3滴定阿司匹林铜与KI生成的I2 , 涉及反应有:
; ; 。
回答下列问题:
(1)、废旧黄铜与NaOH溶液反应的终点现象为。(2)、下列有关说法正确的是___________。A、试剂X为二氧化碳气体、试剂Y为氨水 B、操作Ⅰ包括过滤、洗涤、干燥、煅烧 C、上述流程中涉及4次过滤操作 D、浓HNO3可用O2或H2O2代替(3)、不溶物A制溶液B在如图装置中进行,浓硝酸分多次加入圆底烧瓶中。铜溶解的化学方程式 , 该装置的缺点有。 (4)、操作Ⅱ,选出获取阿司匹林铜过程中合理的操作并排序。
(4)、操作Ⅱ,选出获取阿司匹林铜过程中合理的操作并排序。①依次用蒸馏水、乙醇各洗涤2-3次 ②依次用乙醇、蒸馏水各洗涤2~3次
③小火烘干 ④自然晾干 ⑤蒸发浓缩、冷却结晶 ⑥蒸发结晶 ⑦过滤
(5)、阿司匹林钠的制备是用阿司匹林与NaOH溶液反应,为防止阿司匹林水解,通常采用滴定法,请给出指示剂并说明反应完成时的现象。(6)、碘化亚铜会强力吸附碘单质,实验中如果不加入KSCN试剂会使实验结果。(填“偏高”、“偏低”或“无影响”)30. 化合物G为某药物合成的中间体,其合成路线如下:
已知:


RCl+
请回答:
(1)、下列说法正确的是___________。A、反应①的试剂和条件可以是 、 B、化合物D能发生水解反应 C、反应③④的反应类型是加成反应 D、化合物G的分子式是(2)、写出化合物C的结构简式。(3)、写出反应⑤的化学方程式。(4)、以乙炔为原料合成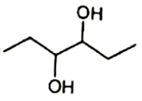 (无机试剂任选) (5)、写出化合物A同时符合下列条件的同分异构体的结构简式。
(无机试剂任选) (5)、写出化合物A同时符合下列条件的同分异构体的结构简式。谱和 谱检测表明:①含有苯环,不含其它环状结构 ②分子中含有4种氢原子。 ③不能使 溶液显色
-