2021年高考化学真题试卷(湖北卷)
试卷更新日期:2021-11-12 类型:高考真卷
一、单选题
-
1. “碳中和”有利于全球气候改善。下列有关CO2的说法错误的是( )A、CO2是Ⅴ形的极性分子 B、CO2可催化还原为甲酸 C、CO2晶体可用于人工增雨 D、CO2是侯氏制碱法的原料之一2. “乌铜走银”是我国非物质文化遗产之一。该工艺将部分氧化的银丝镶嵌于铜器表面,艺人用手边捂边揉搓铜器,铜表面逐渐变黑,银丝变得银光闪闪。下列叙述错误的是( )A、铜的金属活动性大于银 B、通过揉搓可提供电解质溶液 C、银丝可长时间保持光亮 D、用铝丝代替银丝铜也会变黑3. 氢化可的松乙酸酯是一种糖皮质激素,具有抗炎、抗病毒作用,其结构简式如图所示。有关该化合物叙述正确的是( )
 A、分子式为C23H33O6 B、能使溴水褪色 C、不能发生水解反应 D、不能发生消去反应4. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向氢氧化钡溶液中加入盐酸:H++OH-=H2O B、向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-=AgI↓ C、向烧碱溶液中加入一小段铝片:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ D、向次氯酸钙溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO5. 下列实验现象与实验操作不相匹配的是( )
A、分子式为C23H33O6 B、能使溴水褪色 C、不能发生水解反应 D、不能发生消去反应4. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向氢氧化钡溶液中加入盐酸:H++OH-=H2O B、向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-=AgI↓ C、向烧碱溶液中加入一小段铝片:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ D、向次氯酸钙溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO5. 下列实验现象与实验操作不相匹配的是( )实验操作
实验现象
A.
将盛有Fe(OH)3胶体的烧杯置于暗处,用红色激光笔照射烧杯中的液体
在与光束垂直的方向看到一条光亮的“通路”
B.
向盛有少量Mg(OH)2沉淀的试管中加入适量饱和NH4Cl溶液,振荡
白色沉淀溶解
C.
向盛有3.0mL无水乙醇的试管中加入一小块金属钠
有气泡产生
D.
向盛有2.0mL甲苯的试管中加入3滴酸性KMnO4 , 溶液,用力振荡
紫色不变
A、A B、B C、C D、D6. NA为阿伏加德罗常数的值。下列说法错误的是( )A、23gCH3CH2OH中sp3杂化的原子数为NA B、0.5molXeF4中氙的价层电子对数为3NA C、1mol[Cu(H2O)4]2+中配位键的个数为4NA D、标准状况下,11.2LCO和H2的混合气体中分子数为0.5NA7. 某兴趣小组为制备1-氯-2-甲基丙烷(沸点69℃),将2-甲基-1-丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3 , 分液收集CH2Cl2层,无水MgSO4干燥,过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)( )



A.
B.
C.
D.
A、A B、B C、C D、D8. 某离子液体的阴离子的结构如图所示,其中W、X、Y、Z、M为原子序数依次增大的短周期非金属元素,W是有机分子的骨架元素。下列说法正确的是( )

A、Z元素的最高价态为+7 B、基态原子未成对电子数:W>Y C、该阴离子中X不满足8电子稳定结构 D、最简单氢化物水溶液的pH:X>M9. 下列有关N、P及其化合物的说法错误的是( )A、N的电负性比P的大,可推断NCl3分子的极性比PCl3的大 B、N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高 C、NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大 D、HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低10. 某立方晶系的锑钾(Sb—K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
A、Z元素的最高价态为+7 B、基态原子未成对电子数:W>Y C、该阴离子中X不满足8电子稳定结构 D、最简单氢化物水溶液的pH:X>M9. 下列有关N、P及其化合物的说法错误的是( )A、N的电负性比P的大,可推断NCl3分子的极性比PCl3的大 B、N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高 C、NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大 D、HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低10. 某立方晶系的锑钾(Sb—K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )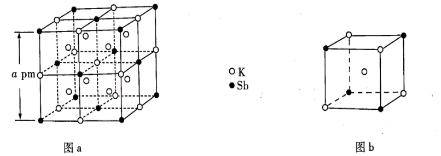 A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm11. 聚醚砜是一种性能优异的高分子材料。它由对苯二酚和4,4'—二氯二苯砜在碱性条件下反应,经酸化处理后得到。下列说法正确的是( )
A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm11. 聚醚砜是一种性能优异的高分子材料。它由对苯二酚和4,4'—二氯二苯砜在碱性条件下反应,经酸化处理后得到。下列说法正确的是( )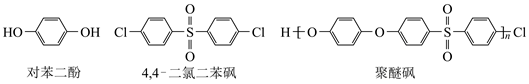 A、聚醚砜易溶于水 B、聚醚砜可通过缩聚反应制备 C、对苯二酚的核磁共振氢谱有3组峰 D、对苯二酚不能与FeCl3溶液发生显色反应12. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( )
A、聚醚砜易溶于水 B、聚醚砜可通过缩聚反应制备 C、对苯二酚的核磁共振氢谱有3组峰 D、对苯二酚不能与FeCl3溶液发生显色反应12. 甲烷单加氧酶(s—mmo)含有双核铁活性中心,是O2氧化CH4生成CH3OH的催化剂,反应过程如图所示。下列叙述错误的是( ) A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O13. 金属Na溶解于液氨中形成氨合钠离子和氨合电子,向该溶液中加入穴醚类配体L,得到首个含碱金属阴离子的金黄色化合物[NaL]+Na-。下列说法错误的是( )A、Na-的半径比F-的大 B、Na-的还原性比Na的强 C、Na-的第一电离能比H-的大 D、该事实说明Na也可表现出非金属性14. 常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1mol·L-1 , 溶液中各含磷物种的pc—pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是( )
A、基态Fe原子的核外电子排布式为[Ar]3d64s2 B、步骤③有非极性键的断裂和极性键的形成 C、每一步骤都存在铁和氧元素之间的电子转移 D、图中的总过程可表示为:CH4+O2+2H++2e- CH3OH+H2O13. 金属Na溶解于液氨中形成氨合钠离子和氨合电子,向该溶液中加入穴醚类配体L,得到首个含碱金属阴离子的金黄色化合物[NaL]+Na-。下列说法错误的是( )A、Na-的半径比F-的大 B、Na-的还原性比Na的强 C、Na-的第一电离能比H-的大 D、该事实说明Na也可表现出非金属性14. 常温下,已知H3PO3溶液中含磷物种的浓度之和为0.1mol·L-1 , 溶液中各含磷物种的pc—pOH关系如图所示。图中pc表示各含磷物种的浓度负对数(pc=-lgc),pOH表示OH-的浓度负对数[pOH=-lgc(OH-)];x、y、z三点的坐标:x(7.3,1.3),y(10.0,3.6),z(12.6,1.3)。下列说法正确的是( ) A、曲线①表示pc(H3PO3)随pOH的变化 B、H3PO3的结构简式为
A、曲线①表示pc(H3PO3)随pOH的变化 B、H3PO3的结构简式为 C、pH=4的溶液中:c(H2PO )<0.1mol·L-1-2c(HPO )
D、H3PO3+HPO 2H2PO 的平衡常数K>1.0×105
15. Na2Cr2O7的酸性水溶液随着H+浓度的增大会转化为CrO3。电解法制备CrO3的原理如图所示。下列说法错误的是( )
C、pH=4的溶液中:c(H2PO )<0.1mol·L-1-2c(HPO )
D、H3PO3+HPO 2H2PO 的平衡常数K>1.0×105
15. Na2Cr2O7的酸性水溶液随着H+浓度的增大会转化为CrO3。电解法制备CrO3的原理如图所示。下列说法错误的是( )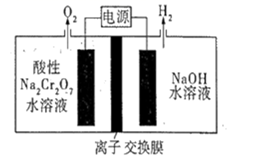 A、电解时只允许H+通过离子交换膜 B、生成O2和H2的质量比为8∶1 C、电解一段时间后阴极区溶液OH-的浓度增大 D、CrO3的生成反应为:Cr2O +2H+=2CrO3+H2O
A、电解时只允许H+通过离子交换膜 B、生成O2和H2的质量比为8∶1 C、电解一段时间后阴极区溶液OH-的浓度增大 D、CrO3的生成反应为:Cr2O +2H+=2CrO3+H2O二、非选择题
-
16. 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如图:

回答下列问题:
(1)、硒(Se)与硫为同族元素,Se的最外层电子数为;镓(Ga)和铟(In)位于元素周期表第IIIA族,CuIn0.5Ga0.5Se2中Cu的化合价为。(2)、“酸浸氧化”发生的主要氧化还原反应的化学方程式为。(3)、25℃时,已知:Kb(NH3·H2O)≈2.0×10-5 , Ksp[Ga(OH)3]≈1.0×10-35 , Ksp[In(OH)3]≈1.0×10-33 , Ksp[Cu(OH)2]≈1.0×10-20 , “浸出液”中c(Cu2+)=0.01mol·L-1。当金属阳离子浓度小于1.0×10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为(保留一位小数);若继续加入6.0mol·L-1氨水至过量,观察到的实验现象是先有蓝色沉淀,然后;为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3+NH3·H2O [Ga(OH)4]-+NH 的平衡常数K=。(已知:Ga3++4OH- [Ga(OH)4]- K′= ≈1.0×1034)
(4)、“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中SO 是否洗净的试剂是;“回流过滤”中SOCl2的作用是将氢氧化物转化为氯化物和。(5)、“高温气相沉积”过程中发生的化学反应方程式为。17. 甲氧苄啶(G)是磺胺类抗菌药物的增效剂,其合成路线如图:
回答下列问题:
(1)、E中的官能团名称是、。(2)、B→C的反应类型为;试剂X的结构简式为。(3)、若每分子F的碳碳双键加上了一分子Br2 , 产物中手性碳个数为。(4)、B的同分异构体中能同时满足以下三个条件的有种(不考虑立体异构)。①属于A的同系物;②苯环上有4个取代基;③苯环上一氯代物只有一种。
(5)、以异烟醛( )和乙醇为原料,制备抗结核杆菌药异烟肼的合成路线如图:
)和乙醇为原料,制备抗结核杆菌药异烟肼的合成路线如图:  Y
Y  异烟肼
异烟肼写出生成Y的化学反应方程式;异烟肼的结构简式为。
18. 超酸是一类比纯硫酸更强的酸,在石油重整中用作高效催化剂。某实验小组对超酸HSbF6的制备及性质进行了探究。由三氯化锑(SbCl3)制备HSbF6的反应如下:SbCl3+Cl2 SbCl5、SbCl5+6HF=HSbF6+5HCl。制备SbCl5的初始实验装置如图(毛细管连通大气,减压时可吸入极少量空气,防止液体暴沸;夹持、加热及搅拌装置略):
相关性质如表:
物质
熔点
沸点
性质
SbCl3
73.4℃
220.3℃
极易水解
SbCl5
3.5℃
140℃分解79℃/2.9kPa
极易水解
回答下列问题:
(1)、实验装置中两个冷凝管(填“能”或“不能”)交换使用。(2)、试剂X的作用为、。(3)、反应完成后,关闭活塞a、打开活塞b,减压转移(填仪器名称)中生成的SbCl5至双口烧瓶中。用真空泵抽气减压蒸馏前,必须关闭的活塞是(填“a”或“b”);用减压蒸馏而不用常压蒸馏的主要原因是。(4)、实验小组在由SbCl5制备HSbF6时,没有选择玻璃仪器,其原因为。(写化学反应方程式)(5)、为更好地理解超酸的强酸性,实验小组查阅相关资料了解到:弱酸在强酸性溶剂中表现出碱的性质,如冰醋酸与纯硫酸之间的化学反应方程式为CH3COOH+H2SO4=[CH3C(OH)2]+[HSO4]-。以此类推,H2SO4与HSbF6之间的化学反应方程式为。(6)、实验小组在探究实验中发现蜡烛可以溶解于HSbF6中,同时放出氢气。已知烷烃分子中碳氢键的活性大小顺序为:甲基(—CH3)<亚甲基(—CH2—)<次甲基( )。写出2—甲基丙烷与HSbF6反应的离子方程式。 19. 丙烯是一种重要的化工原料,可以在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备。
)。写出2—甲基丙烷与HSbF6反应的离子方程式。 19. 丙烯是一种重要的化工原料,可以在催化剂作用下,由丙烷直接脱氢或氧化脱氢制备。反应Ⅰ(直接脱氢):C3H8(g)=C3H6(g)+H2(g)△H1=+125kJ·mol-1
反应Ⅱ(氧化脱氢):C3H8(g)+ O2(g)=C3H6(g)+H2O(g)△H2=-118kJ·mol-1
(1)、已知键能:E(C—H)=416kJ·mol-1 , E(H—H)=436kJ·mol-1 , 由此计算生成1mol碳碳π键放出的能量为kJ。(2)、对于反应Ⅰ,总压恒定为100kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后“通入N2”的作用是。在温度为T1时,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图a所示,计算T1时反应Ⅰ的平衡常数Kp=kPa(以分压表示,分压=总压×物质的量分数,保留一位小数)。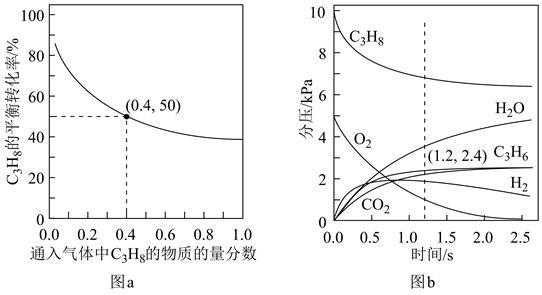 (3)、在温度为T2时,通入气体分压比为p(C3H8):p(O2):p(N2)=10:5:85的混合气体,各组分气体的分压随时间的变化关系如图b所示。0~1.2s生成C3H6的平均速率为kPa·s-1;;在反应一段时间后,C3H8和O2的消耗速率比小于2∶1的原因为。(4)、恒温刚性密闭容器中通入气体分压比为p(C3H8):p(O2):p(N2)=2:13:85的混合气体,已知某反应条件下只发生如下反应(k,k′为速率常数):
(3)、在温度为T2时,通入气体分压比为p(C3H8):p(O2):p(N2)=10:5:85的混合气体,各组分气体的分压随时间的变化关系如图b所示。0~1.2s生成C3H6的平均速率为kPa·s-1;;在反应一段时间后,C3H8和O2的消耗速率比小于2∶1的原因为。(4)、恒温刚性密闭容器中通入气体分压比为p(C3H8):p(O2):p(N2)=2:13:85的混合气体,已知某反应条件下只发生如下反应(k,k′为速率常数):反应Ⅱ:2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) k
反应Ⅲ:2C3H6(g)+9O2(g)=6CO2(g)+6H2O(g) k′
实验测得丙烯的净生成速率方程为v(C3H6)=kp(C3H8)-k′p(C3H6),可推测丙烯的浓度随时间的变化趋势为 , 其理由是。