2021年高考化学真题试卷(天津卷)
试卷更新日期:2021-11-12 类型:高考真卷
一、单选题
-
1. 近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误的是( )A、北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素 B、奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料 C、长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应 D、天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料2. 下列各组物质的晶体类型相同的是( )A、SiO2和SO3 B、I2和NaCl C、Cu和Ag D、SiC和MgO3. 核聚变发电有望成为解决人类能源问题的重要手段之一、氘( )是核聚变反应的主要原料,下列有关叙述正确的是( )A、 的中子数为2 B、 的核电荷数为1 C、 是自然界中最轻的原子 D、 是氢元素的一种同素异形体4. 关于反应 所涉及的物质,下列说法错误的是( )A、H2SO4在该反应中为氧化剂 B、Na2SO3容易被空气中的O2氧化变质 C、Na2SO4是含有共价键的离子化合物 D、SO2是导致酸雨的主要有害污染物5. 下列化学用语表达正确的是( )A、F-的离子结构示意图:
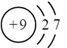 B、基态碳原子的轨道表示式:
B、基态碳原子的轨道表示式:  C、丙炔的键线式:
C、丙炔的键线式: 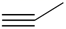 D、H2O分子的球棍模型:
D、H2O分子的球棍模型: 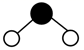 6. 进行下列实验操作时,选用仪器正确的是( )
6. 进行下列实验操作时,选用仪器正确的是( )提取碘水中的碘
量取一定体积的KMnO4溶液
熔化NaOH固体
浓缩NaCl溶液




A
B
C
D
A、A B、B C、C D、D7. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、1mol/LHCl溶液中,HCl分子的数目为NA B、22.4L氢气中,H2分子的数目为NA C、180g葡萄糖中,C原子的数目为6NA D、1molN2中,σ键的数目为3NA8. 最理想的“原子经济性反应”是指反应物的原子全部转化为期望的最终产物的反应。下列属于最理想的“原子经济性反应”的是( )A、用电石与水制备乙炔的反应 B、用溴乙烷与NaOH的乙醇溶液共热制备乙烯的反应 C、用苯酚稀溶液与饱和溴水制备2,4,6-三溴苯酚的反应 D、用乙烯与氧气在Ag催化下制备环氧乙烷( )的反应
9. 常温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=1的溶液:Fe2+、Mg2+、 、 B、pH=12的溶液:K+、Na+、 、 C、pH=7的溶液:Na+、Cu2+、S2-、Cl- D、pH=7的溶液:Al3+、K+、Cl-、10. 常温下,下列有关电解质溶液的叙述正确的是( )A、在 溶液中 B、在 溶液中 C、在 溶液中 D、氨水和NH4Cl溶液混合,形成pH=9的溶液中11. 如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )
)的反应
9. 常温下,下列各组离子在给定溶液中能大量共存的是( )A、pH=1的溶液:Fe2+、Mg2+、 、 B、pH=12的溶液:K+、Na+、 、 C、pH=7的溶液:Na+、Cu2+、S2-、Cl- D、pH=7的溶液:Al3+、K+、Cl-、10. 常温下,下列有关电解质溶液的叙述正确的是( )A、在 溶液中 B、在 溶液中 C、在 溶液中 D、氨水和NH4Cl溶液混合,形成pH=9的溶液中11. 如下所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( ) A、a是电源的负极 B、通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色 C、随着电解的进行,CuCl2溶液浓度变大 D、当 完全溶解时,至少产生气体336mL (折合成标准状况下)12. 元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是( )
A、a是电源的负极 B、通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色 C、随着电解的进行,CuCl2溶液浓度变大 D、当 完全溶解时,至少产生气体336mL (折合成标准状况下)12. 元素X、Y、Z、Q、R的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图所示。下列判断正确的是( )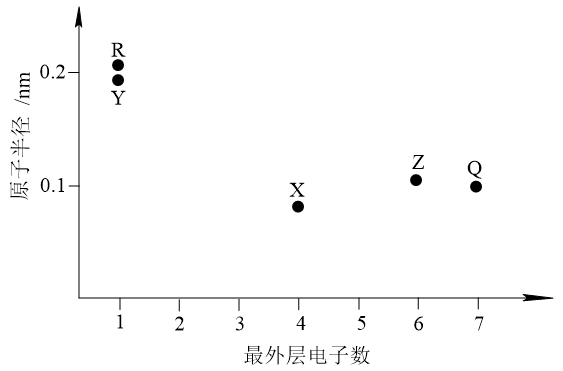 A、X的电负性比Q的大 B、Q的简单离子半径比R的大 C、Z的简单气态氢化物的热稳定性比Q的强 D、Y的最高价氧化物对应的水化物的碱性比R的强
A、X的电负性比Q的大 B、Q的简单离子半径比R的大 C、Z的简单气态氢化物的热稳定性比Q的强 D、Y的最高价氧化物对应的水化物的碱性比R的强二、非选择题
-
13. 铁单质及其化合物的应用非常广泛。(1)、基态Fe原子的价层电子排布式为。(2)、用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为。每个晶胞B中含Fe原子数为。
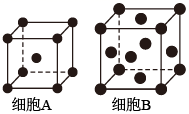 (3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。
(3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。 (4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
(4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
① 为浅紫色,但溶液Ⅰ却呈黄色,其原因是 , 为了能观察到溶液Ⅰ中 的浅紫色,可采取的方法是。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: ; ,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为 , 平衡常数为(用K1和K2表示)。
14. 普瑞巴林能用于治疗多种疾病,结构简式为 ,其合成路线如下:
,其合成路线如下:  (1)、普瑞巴林分子所含官能团的名称为。(2)、化合物A的命名为。(3)、B→C的有机反应类型为。(4)、写出D→E的化学反应方程式。(5)、E~G中,含手性碳原子的化合物有(填字母)。(6)、E→F反应所用的化合物X的分子式为 ,该化合物能发生银镜反应,写出其结构简式 , 化合物X的含有碳氧双键(
(1)、普瑞巴林分子所含官能团的名称为。(2)、化合物A的命名为。(3)、B→C的有机反应类型为。(4)、写出D→E的化学反应方程式。(5)、E~G中,含手性碳原子的化合物有(填字母)。(6)、E→F反应所用的化合物X的分子式为 ,该化合物能发生银镜反应,写出其结构简式 , 化合物X的含有碳氧双键( )的同分异构体(不包括X、不考虑立体异构)数目为 , 其中核磁共振氢谱中有两组峰的为(写结构简式)。 (7)、参考以上合成路线及反应条件,以
)的同分异构体(不包括X、不考虑立体异构)数目为 , 其中核磁共振氢谱中有两组峰的为(写结构简式)。 (7)、参考以上合成路线及反应条件,以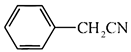 和必要的无机试剂为原料,合成
和必要的无机试剂为原料,合成  ,在方框中写出路线流程图。
,在方框中写出路线流程图。  15. 某化学小组同学利用一定浓度的H2O2溶液制备O2 , 再用O2氧化C2H5OH,并检验氧化产物。(1)、Ⅰ.制备O2
15. 某化学小组同学利用一定浓度的H2O2溶液制备O2 , 再用O2氧化C2H5OH,并检验氧化产物。(1)、Ⅰ.制备O2该小组同学设计了如下气体发生装置(夹持装置省略)

甲装置中主要仪器的名称为。
(2)、乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1 , 经长颈漏斗向试管中缓慢加入3% H2O2溶液至。欲使反应停止,关闭活塞K1即可,此时装置中的现象是。(3)、丙装置可用于制备较多O2 , 催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是 , 此时可以将铂丝抽离H2O2溶液,还可以采取的安全措施是。(4)、丙装置的特点是(填序号)。a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
(5)、Ⅱ.氧化C2H5OH该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)
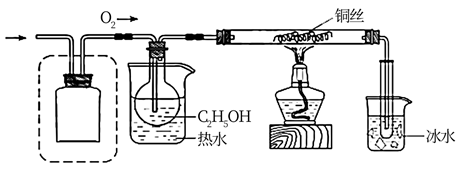
在图中方框内补全干燥装置和干燥剂。
(6)、Ⅲ.检验产物为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验序号
检验试剂和反应条件
现象
结论
①
酸性KMnO4溶液
紫红色褪去
产物含有乙醛
②
新制Cu(OH)2 , 加热
生成砖红色沉淀
产物含有乙醛
③
微红色含酚酞的NaOH溶液
微红色褪去
产物可能含有乙酸
实验①~③中的结论不合理的是(填序号),原因是。
16. CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2 , S8受热分解成气态S2 , 发生反应 ,回答下列问题:(1)、CH4的电子式为 , CS2分子的立体构型为。(2)、某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。①当CS2的体积分数为10%时,CH4的转化率为。
②当以下数值不变时,能说明该反应达到平衡的是(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)、一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是。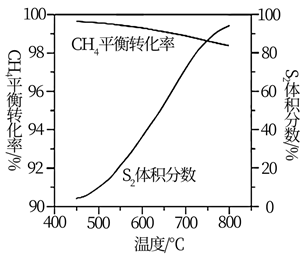 (4)、用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式。
(4)、用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式。