2021年高考化学真题试卷(辽宁卷)
试卷更新日期:2021-11-12 类型:高考真卷
一、单选题
-
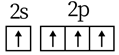
1. 下列说法错误的是( )A、纯铁比生铁易生锈 B、臭氧可用于自来水消毒 C、酚醛树脂可用作绝缘、隔热材料 D、高纯硅可用于制芯片2. 下列化学用语使用正确的是( )A、基态C原子价电子排布图:
 B、 结构示意图:
B、 结构示意图: 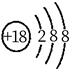 C、 形成过程:
C、 形成过程: 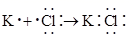 D、质量数为2的氢核素:
3. 《天工开物》中记载:“凡乌金纸由苏、杭造成,其纸用东海巨竹膜为质。用豆油点灯,闭塞周围,只留针孔通气,熏染烟光而成此纸,每纸一张打金箔五十度……”下列说法错误的是( )A、“乌金纸”的“乌”与豆油不完全燃烧有关 B、“巨竹膜”为造纸的原料,主要成分是纤维素 C、豆油的主要成分油脂属于天然高分子化合物 D、打金成箔,说明金具有良好的延展性4. 下列说法正确的是( )A、 (标准状况)与水充分反应转移 电子 B、 和 均可通过化合反应得到 C、将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、 与 溶液反应:5. 有机物a、b、c的结构如图。下列说法正确的是( )
D、质量数为2的氢核素:
3. 《天工开物》中记载:“凡乌金纸由苏、杭造成,其纸用东海巨竹膜为质。用豆油点灯,闭塞周围,只留针孔通气,熏染烟光而成此纸,每纸一张打金箔五十度……”下列说法错误的是( )A、“乌金纸”的“乌”与豆油不完全燃烧有关 B、“巨竹膜”为造纸的原料,主要成分是纤维素 C、豆油的主要成分油脂属于天然高分子化合物 D、打金成箔,说明金具有良好的延展性4. 下列说法正确的是( )A、 (标准状况)与水充分反应转移 电子 B、 和 均可通过化合反应得到 C、将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、 与 溶液反应:5. 有机物a、b、c的结构如图。下列说法正确的是( )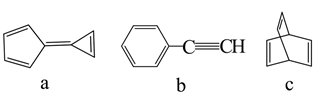 A、a的一氯代物有3种 B、b是
A、a的一氯代物有3种 B、b是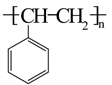 的单体
C、c中碳原子的杂化方式均为
D、a、b、c互为同分异构体
6. 我国科技工作者发现某“小分子胶水”(结构如图)能助力自噬细胞“吞没”致病蛋白。下列说法正确的是( )
的单体
C、c中碳原子的杂化方式均为
D、a、b、c互为同分异构体
6. 我国科技工作者发现某“小分子胶水”(结构如图)能助力自噬细胞“吞没”致病蛋白。下列说法正确的是( )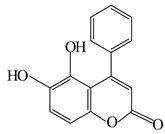 A、该分子中所有碳原子一定共平面 B、该分子能与蛋白质分子形成氢键 C、 该物质最多能与 反应 D、该物质能发生取代、加成和消去反应7. 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )
A、该分子中所有碳原子一定共平面 B、该分子能与蛋白质分子形成氢键 C、 该物质最多能与 反应 D、该物质能发生取代、加成和消去反应7. 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( ) A、S位于元素周期表p区 B、该物质的化学式为 C、S位于H构成的八面体空隙中 D、该晶体属于分子晶体8. 含S元素的某钠盐a能发生如图转化。下列说法错误的是( )
A、S位于元素周期表p区 B、该物质的化学式为 C、S位于H构成的八面体空隙中 D、该晶体属于分子晶体8. 含S元素的某钠盐a能发生如图转化。下列说法错误的是( )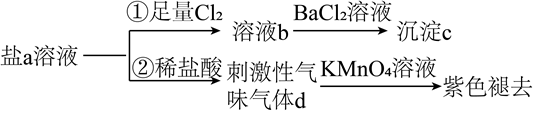 A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀9. 由下列实验操作及现象能得出相应结论的是( )
A、a可能为正盐,也可能为酸式盐 B、c为不溶于盐酸的白色沉淀 C、d为含极性键的非极性分子 D、反应②中还可能生成淡黄色沉淀9. 由下列实验操作及现象能得出相应结论的是( )实验操作
现象
结论
A
向KBr、KI混合溶液中依次加入少量氯水和CCl4 , 振荡,静置
溶液分层,下层呈紫红色
氧化性:
B
在火焰上灼烧搅拌过某无色溶液的玻璃棒
火焰出现黄色
溶液中含Na元素
C
用pH计测定pH:①NaHCO3溶液②CH3COONa溶液
pH:①>②
H2CO3酸性弱于CH3COOH
D
把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口
木条复燃
反应生成了O2
A、A B、B C、C D、D10. 如图,某液态金属储能电池放电时产生金属化合物 。下列说法正确的是( )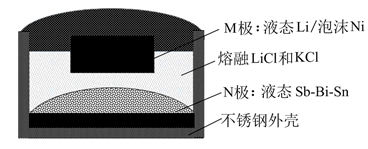 A、放电时,M电极反应为 B、放电时, 由M电极向N电极移动 C、充电时,M电极的质量减小 D、充电时,N电极反应为11. 某温度下,在恒容密闭容器中加入一定量X,发生反应 ,一段时间后达到平衡。下列说法错误的是( )A、升高温度,若 增大,则 B、加入一定量Z,达新平衡后 减小 C、加入等物质的量的Y和Z,达新平衡后 增大 D、加入一定量氩气,平衡不移动12. 某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是( )
A、放电时,M电极反应为 B、放电时, 由M电极向N电极移动 C、充电时,M电极的质量减小 D、充电时,N电极反应为11. 某温度下,在恒容密闭容器中加入一定量X,发生反应 ,一段时间后达到平衡。下列说法错误的是( )A、升高温度,若 增大,则 B、加入一定量Z,达新平衡后 减小 C、加入等物质的量的Y和Z,达新平衡后 增大 D、加入一定量氩气,平衡不移动12. 某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是( ) A、其他条件相同时,催化剂浓度越大,反应速率越大 B、其他条件相同时,降冰片烯浓度越大,反应速率越大 C、条件①,反应速率为 D、条件②,降冰片烯起始浓度为 时,半衰期为13. 利用
A、其他条件相同时,催化剂浓度越大,反应速率越大 B、其他条件相同时,降冰片烯浓度越大,反应速率越大 C、条件①,反应速率为 D、条件②,降冰片烯起始浓度为 时,半衰期为13. 利用 (Q)与
(Q)与  电解转化法从烟气中分离 的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是( )
电解转化法从烟气中分离 的原理如图。已知气体可选择性通过膜电极,溶液不能通过。下列说法错误的是( )  A、a为电源负极 B、溶液中Q的物质的量保持不变 C、 在M极被还原 D、分离出的 从出口2排出14. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是( )
A、a为电源负极 B、溶液中Q的物质的量保持不变 C、 在M极被还原 D、分离出的 从出口2排出14. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是( ) A、氢化物沸点: B、原子半径: C、第一电离能: D、阴、阳离子中均有配位键15. 用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是(如 分布分数: )( )
A、氢化物沸点: B、原子半径: C、第一电离能: D、阴、阳离子中均有配位键15. 用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随pH变化曲线及滴定曲线如图。下列说法正确的是(如 分布分数: )( ) A、 的 为 B、c点: C、第一次突变,可选酚酞作指示剂 D、
A、 的 为 B、c点: C、第一次突变,可选酚酞作指示剂 D、二、综合题
-
16. 从钒铬锰矿渣(主要成分为 、 、 )中提铬的一种工艺流程如下:

已知:pH较大时,二价锰[ ](在空气中易被氧化.回答下列问题:
(1)、Cr元素位于元素周期表第周期族。(2)、用 溶液制备 胶体的化学方程式为。(3)、常温下,各种形态五价钒粒子总浓度的对数[ ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中 ,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为(填化学式)。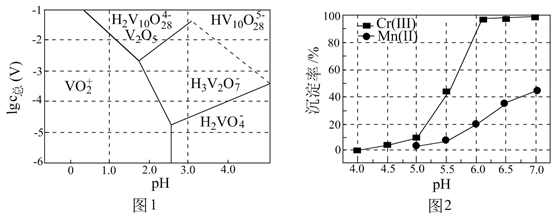 (4)、某温度下, 、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为;在该条件下滤液B中 ( 近似为 , 的 近似为 )。(5)、“转化”过程中生成 的离子方程式为。(6)、“提纯”过程中 的作用为。17. 苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
(4)、某温度下, 、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为;在该条件下滤液B中 ( 近似为 , 的 近似为 )。(5)、“转化”过程中生成 的离子方程式为。(6)、“提纯”过程中 的作用为。17. 苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:Ⅰ.主反应:
 (g)+3H2(g)⇌
(g)+3H2(g)⇌  (g) ∆H1<0
(g) ∆H1<0Ⅱ.副反应:
 (g) ⇌
(g) ⇌  (g) ∆H2>0
(g) ∆H2>0回答下列问题:
(1)、已知:Ⅲ.Ⅳ.2
 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4Ⅴ.
 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5则 (用 、 和 表示)。
(2)、有利于提高平衡体系中环己烷体积分数的措施有_______。A、适当升温 B、适当降温 C、适当加压 D、适当减压(3)、反应Ⅰ在管式反应器中进行,实际投料往往在 的基础上适当增大 用量,其目的是。(4)、氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当 中混有微量 或 等杂质时,会导致反应Ⅰ的产率降低,推测其可能原因为。 (5)、催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合弧电子对,下图中可作为酸性中心的原子的标号是(填“①”“②”或“③”)。
(5)、催化剂载体中的酸性中心能催化苯及环己烷的裂解。已知酸性中心可结合弧电子对,下图中可作为酸性中心的原子的标号是(填“①”“②”或“③”)。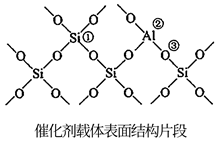 (6)、恒压反应器中,按照 投料,发生Ⅰ、Ⅱ反应,总压为 ,平衡时苯的转化率为α,环己烷的分压为p,则反应1的 (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。18. 磁性材料在很多领域具有应用前景,其制备过程如下(各步均在 氛围中进行):
(6)、恒压反应器中,按照 投料,发生Ⅰ、Ⅱ反应,总压为 ,平衡时苯的转化率为α,环己烷的分压为p,则反应1的 (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。18. 磁性材料在很多领域具有应用前景,其制备过程如下(各步均在 氛围中进行):①称取 ,配成 溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入 溶液。
③持续磁力搅拌,将 溶液以 的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在 干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
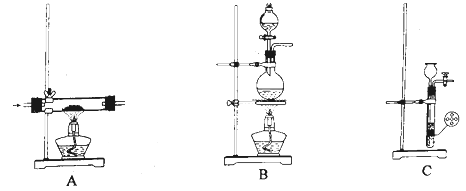
(1)、仪器a的名称是;使用恒压滴液漏斗的原因是。(2)、实验室制取 有多种方法,请根据元素化合物知识和氧化还原反应相关理论,结合下列供选试剂和装置,选出一种可行的方法,化学方程式为 , 对应的装置为(填标号)。可供选择的试剂: 、 、 、 、饱和 、饱和
可供选择的发生装置(净化装置略去):
 (3)、三颈烧瓶中反应生成了Fe和 ,离子方程式为。(4)、为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。A、采用适宜的滴液速度 B、用盐酸代替KOH溶液,抑制 水解 C、在空气氛围中制备 D、选择适宜的焙烧温度(5)、步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为;使用乙醇洗涤的目的是。(6)、该实验所得磁性材料的产率为(保留3位有效数字)。19. 中华裸蒴中含有一种具有杀菌活性的化合物J,其合成路线如下:
(3)、三颈烧瓶中反应生成了Fe和 ,离子方程式为。(4)、为保证产品性能,需使其粒径适中、结晶度良好,可采取的措施有_______。A、采用适宜的滴液速度 B、用盐酸代替KOH溶液,抑制 水解 C、在空气氛围中制备 D、选择适宜的焙烧温度(5)、步骤④中判断沉淀是否已经用水洗涤干净,应选择的试剂为;使用乙醇洗涤的目的是。(6)、该实验所得磁性材料的产率为(保留3位有效数字)。19. 中华裸蒴中含有一种具有杀菌活性的化合物J,其合成路线如下:
已知:

回答下列问题:
(1)、D中含氧官能团的名称为;J的分子式为。(2)、A的两种同分异构体结构分别为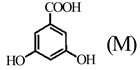 和
和 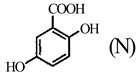 ,其熔点MN(填“高于”或“低于”)。 (3)、由A生成B的化学方程式为。(4)、由B生成C的反应类型为。(5)、G的结构简式为。(6)、F的同分异构体中,含有苯环、 ,且能发生银镜反应的有种;其中核磁共振氢谱峰面积之比为2∶2∶2∶2∶1的同分异构体的结构简式为。
,其熔点MN(填“高于”或“低于”)。 (3)、由A生成B的化学方程式为。(4)、由B生成C的反应类型为。(5)、G的结构简式为。(6)、F的同分异构体中,含有苯环、 ,且能发生银镜反应的有种;其中核磁共振氢谱峰面积之比为2∶2∶2∶2∶1的同分异构体的结构简式为。