2021年高考化学真题卷(海南卷)
试卷更新日期:2021-11-12 类型:高考真卷
一、单选题
-
1. 2020年9月22日,中国向全世界宣布,努力争取2060年前实现碳中和。下列措施不利于大气中 减少的是( )A、用氨水捕集废气中的 ,将其转化为氮肥 B、大力推广使用风能、水能、氢能等清洁能源 C、大力推广使用干冰实现人工增雨,缓解旱情 D、通过植树造林,利用光合作用吸收大气中的2. 元末陶宗仪《辍耕录》中记载:“杭人削松木为小片,其薄为纸,熔硫磺涂木片顶端分许,名日发烛……,盖以发火及代灯烛用也。”下列有关说法错误的是( )A、将松木削薄为纸片状有助于发火和燃烧 B、“发烛”发火和燃烧利用了物质的可燃性 C、“发烛”发火和燃烧伴随不同形式的能量转化 D、硫磺是“发烛”发火和燃烧反应的催化剂3. 用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )

选项
气体
a
b
A
稀
B
溶液
C
浓
铁片
D
浓氨水
A、A B、B C、C D、D4. 生活中处处有化学。下列说法错误的是( )A、天然橡胶的主要成分是聚苯乙烯 B、天然气的主要成分是甲烷 C、乙烯可用作水果催熟剂 D、苯酚可用作消毒剂5. SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是( )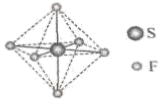 A、是非极性分子 B、键角 都等于90° C、 与 之间共用电子对偏向S D、 原子满足8电子稳定结构6. 一次性鉴别等浓度的 、 、 三种溶液,下列方法不可行的是( )A、测定 B、焰色试验 C、滴加 溶液 D、滴加饱和 溶液,微热7. 代表阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的电子数为1.3 B、 中含有的共价键的数目为0.1 C、 肼 含有的孤电子对数为0.2 D、 ,生成 乙烷时断裂的共价键总数为8. 制备水煤气的反应 ,下列说法正确的是( )A、该反应 B、升高温度,反应速率增大 C、恒温下,增大总压,H2O(g)的平衡转化率不变 D、恒温恒压下,加入催化剂,平衡常数增大9. 液氨中存在平衡: 。如图所示为电解池装置,以 的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下列有关说法正确的是( )
A、是非极性分子 B、键角 都等于90° C、 与 之间共用电子对偏向S D、 原子满足8电子稳定结构6. 一次性鉴别等浓度的 、 、 三种溶液,下列方法不可行的是( )A、测定 B、焰色试验 C、滴加 溶液 D、滴加饱和 溶液,微热7. 代表阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的电子数为1.3 B、 中含有的共价键的数目为0.1 C、 肼 含有的孤电子对数为0.2 D、 ,生成 乙烷时断裂的共价键总数为8. 制备水煤气的反应 ,下列说法正确的是( )A、该反应 B、升高温度,反应速率增大 C、恒温下,增大总压,H2O(g)的平衡转化率不变 D、恒温恒压下,加入催化剂,平衡常数增大9. 液氨中存在平衡: 。如图所示为电解池装置,以 的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下列有关说法正确的是( ) A、b电极连接的是电源的负极 B、a电极的反应为 C、电解过程中,阴极附近K+浓度减小 D、理论上两极产生的气体物质的量之比为1:110. 关于 性质的解释合理的是( )
A、b电极连接的是电源的负极 B、a电极的反应为 C、电解过程中,阴极附近K+浓度减小 D、理论上两极产生的气体物质的量之比为1:110. 关于 性质的解释合理的是( )选项
性质
解释
A
比 容易液化
分子间的范德华力更大
B
熔点高于
键的键能比 大
C
能与 以配位键结合
中氮原子有孤电子对
D
氨水中存在
是离子化合物
A、A B、B C、C D、D11. 依据下列实验和现象,得出结论正确的是( )选项
实验
现象
结论
A
点燃无色气体 ,将生成的气体通入澄清石灰水
澄清石灰水先浑浊后澄清
为
B
25℃时,向无色的 溶液中滴加1~2滴酚酞试液
溶液仍为无色
溶液的
C
在淀粉和 的混合溶液中滴加 溶液。[已知: 、 分别与卤素单质、卤素离子性质相似]
溶液仍为蓝色
氧化性:
D
在稀 中加入少量
溶液由无色变为蓝色并有红色固体生成
反应中 既作氧化剂又作还原剂
A、A B、B C、C D、D二、多选题
-
12. 短周期主族元素 、 、 、 的原子序数依次增大, 离子与 分子均含有14个电子;习惯上把电解饱和 水溶液的工业生产称为氯碱工业。下列判断正确的是( )A、原子半径: B、最高价氧化物对应的水化物的酸性: C、化合物 的水溶液呈中性 D、 分子中既有 键又有 键13. 我国化工专家吴蕴初自主破解了“味精”的蛋白质水解工业生产方式。味精的主要成分为谷氨酸单钠盐。 是谷氨酸(结构简式如下)的同分异构体,与谷氨酸具有相同的官能团种类与数目。下列有关说法正确的是( )
 A、谷氨酸分子式为 B、谷氨酸分子中有2个手性碳原子 C、谷氨酸单钠能溶于水 D、 的数目(不含立体异构)有8种14. 25℃时,向 的 溶液中滴加 的盐酸,溶液的 随加入的盐酸的体积 变化如图所示。下列有关说法正确的是( )
A、谷氨酸分子式为 B、谷氨酸分子中有2个手性碳原子 C、谷氨酸单钠能溶于水 D、 的数目(不含立体异构)有8种14. 25℃时,向 的 溶液中滴加 的盐酸,溶液的 随加入的盐酸的体积 变化如图所示。下列有关说法正确的是( )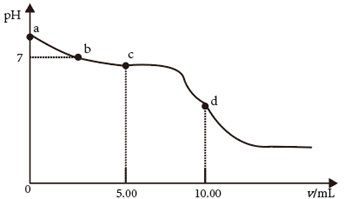 A、 点,溶液 是由于 水解程度大于电离程度 B、 点, C、 点,溶液中的 主要来自 的电离 D、 点,
A、 点,溶液 是由于 水解程度大于电离程度 B、 点, C、 点,溶液中的 主要来自 的电离 D、 点,三、综合题
-
15. 无水 常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和 杂质)为原料制备无水 。
已知:氯化亚砜(
 )熔点-101℃,沸点76℃,易水解。
)熔点-101℃,沸点76℃,易水解。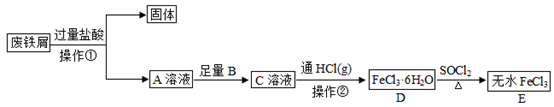
回答问题:
(1)、操作①是过滤,用到的玻璃仪器有烧杯、玻璃棒和。(2)、为避免引入新的杂质,试剂B可以选用___________(填编号)。A、 溶液 B、 水 C、 水 D、 溶液(3)、操作②是蒸发结晶,加热的同时通入 的目的是。(4)、取少量 晶体,溶于水并滴加 溶液,现象是。(5)、反应 的化学方程式为。(6)、由 转化成 的过程中可能产生少量亚铁盐,写出一种可能的还原剂 , 并设计实验验证是该还原剂将 还原。16. 碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知25℃, 时:① 葡萄糖 完全燃烧生成 和 ,放出 热量。
② 。
回答问题:
(1)、25℃时, 与 经光合作用生成葡萄糖 和 的热化学方程式为。(2)、25℃, 时,气态分子断开 化学键的焓变称为键焓。已知 、 键的键焓分别为 、 , 分子中碳氧键的键焓为 。(3)、溶于水的 只有部分转化为 ,大部分以水合 的形式存在,水合 可用 表示。已知25℃时, 的平衡常数 ,正反应的速率可表示为 ,逆反应的速率可表示为 ,则 (用含 的代数式表示)。(4)、25℃时,潮湿的石膏雕像表面会发生反应: ,其平衡常数 。[已知 , ](5)、溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因。17. 亚硝酰氯 可作为有机合成试剂。已知:①
②沸点: 为-6℃, 为-34℃, 为-152℃。
③ 易水解,能与 反应。
某研究小组用 和 在如图所示装置中制备 ,并分离回收未反应的原料。

回答问题:
(1)、通入 和 前先通入氩气,作用是;仪器 的名称是。(2)、将催化剂负载在玻璃棉上而不是直接平铺在玻璃管中,目的是。(3)、实验所需的 可用 和 溶液在稀 中反应制得,离子反应方程式为。(4)、为分离产物和未反应的原料,低温溶槽A的温度区间应控制在 , 仪器C收集的物质是。(5)、无色的尾气若遇到空气会变为红棕色,原因是。18. 二甲双酮是一种抗惊厥药,以丙烯为起始原料的合成路线如下: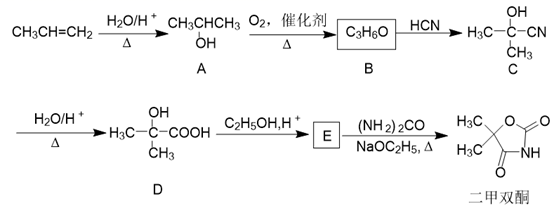 回答问题:(1)、A的名称是 , A与金属钠反应的产物为和。(2)、B的核磁共振氢谱有组峰。(3)、 、 的反应类型分别为、。(4)、D中所含官能团名称为、。(5)、D→E的反应方程式为。(6)、设计以
回答问题:(1)、A的名称是 , A与金属钠反应的产物为和。(2)、B的核磁共振氢谱有组峰。(3)、 、 的反应类型分别为、。(4)、D中所含官能团名称为、。(5)、D→E的反应方程式为。(6)、设计以 为原料合成乌头酸(
为原料合成乌头酸( 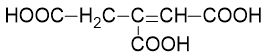 )的路线(无机试剂任选)。
)的路线(无机试剂任选)。 已知:① ②
 19. 金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。
19. 金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。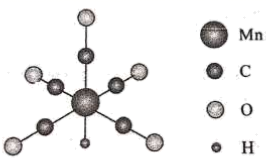
回答问题:
(1)、基态锰原子的价层电子排布式为。(2)、配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为。(3)、第一电离能的大小:CO(填“大于”或“小于”)。(4)、 中碳原子的杂化轨道类型是 , 写出一种与具有相同空间结构的-1价无机酸根离子的化学式。(5)、CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为。(6)、MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是。
以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为 ,b点锰原子坐标为 ,则c点锰原子坐标为。