山东省东营市广饶县2021-2022学年第一学期期中测试九年级化学试题
试卷更新日期:2021-11-08 类型:期中考试
一、单选题(本题包括12小题, 共40分。1至8题每小题3分,9至12题每小题4分。每小题只有一个选项符合题意)
-
1. 厨房是家庭中的小小实验室,厨房中有①面粉②豆油③纯碱④料酒⑤味精⑥胡椒面⑦面酱⑧食醋⑨食盐⑩白砂糖等,把它们分别放入适量水中,充分搅拌能够得到溶液的是( )A、①③⑤⑥⑧⑨⑩ B、③④⑤⑧⑨⑩ C、②③⑦⑧⑨⑩ D、③④⑥⑧⑨⑩2. 推理是一种重要的化学思维方法,以下推理合理的是( )A、酸溶液的pH小于7,故pH小于7的溶液一定是酸溶液 B、溶液是均一、稳定的,所以均一、稳定的物质一定是溶液 C、洗涤剂去油污是利用了乳化作用,则汽油去油污也是利用了乳化作用 D、中和反应一定有盐和水生成,但是有盐和水生成的反应不一定是中和反应3. 《天工开物》中对“海水盐”有如下描述:“ 凡煎盐锅古谓之‘牢盆’,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……燃釜底,滚沸延及成盐。”文中没有涉及到的操作是( )A、加热 B、结晶 C、蒸发 D、过滤4. 根据如图原理,海水加压一段时间后,剩余海水中不变的是( )
 A、溶质质量 B、溶液组成 C、溶液质量 D、溶剂质量5. 下列叙述错误的是( )A、利用光照和风力使水分蒸发得到食盐 B、海水晒盐得到食盐后的母液可用于提取多种化工原料 C、海水淡化只能得到淡水,剩余物质不再有利用价值 D、'海水中溶有二氧化碳,可供海水中的绿色植物进行光合作用6. 正确规范的操作是实验成功和人身安全的重要保证。下列实验操作正确的是( )A、
A、溶质质量 B、溶液组成 C、溶液质量 D、溶剂质量5. 下列叙述错误的是( )A、利用光照和风力使水分蒸发得到食盐 B、海水晒盐得到食盐后的母液可用于提取多种化工原料 C、海水淡化只能得到淡水,剩余物质不再有利用价值 D、'海水中溶有二氧化碳,可供海水中的绿色植物进行光合作用6. 正确规范的操作是实验成功和人身安全的重要保证。下列实验操作正确的是( )A、 测定溶液pH
B、
测定溶液pH
B、 配制溶液
C、
配制溶液
C、 称量固体
D、
称量固体
D、 稀释浓硫酸
7. 食醋里通常含有3%-5%的醋酸(CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。下列能作为醋酸属于酸的证据的是( )A、产生的气体是二氧化碳 B、食醋可以去除金属制品上的少量锈迹 C、加水稀释食醋,溶液pH变大 D、不宜用铝制容器盛装食醋8. 下列关于海洋开发利用的说法中正确的是( )A、海水“晒盐"获得是纯净物氯化钠 B、海底的可燃冰大量燃烧后,不会造成温室效应 C、海洋是个巨大的水资源库,如何获取廉价的淡水对缓解淡水危机意义重大 D、可以从海水中直接提取纯碱9. 下列图象不能正确反映其对应的实验操作的是( )A、
稀释浓硫酸
7. 食醋里通常含有3%-5%的醋酸(CH3COOH),食醋与鸡蛋壳反应产生能使澄清石灰水变浑浊的气体。下列能作为醋酸属于酸的证据的是( )A、产生的气体是二氧化碳 B、食醋可以去除金属制品上的少量锈迹 C、加水稀释食醋,溶液pH变大 D、不宜用铝制容器盛装食醋8. 下列关于海洋开发利用的说法中正确的是( )A、海水“晒盐"获得是纯净物氯化钠 B、海底的可燃冰大量燃烧后,不会造成温室效应 C、海洋是个巨大的水资源库,如何获取廉价的淡水对缓解淡水危机意义重大 D、可以从海水中直接提取纯碱9. 下列图象不能正确反映其对应的实验操作的是( )A、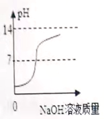 向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
B、
向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
B、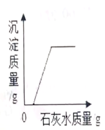 向一定量氢氧化钠和碳酸钠的混合溶液中加入过量的石灰水
C、
向一定量氢氧化钠和碳酸钠的混合溶液中加入过量的石灰水
C、 向含有一定量硫酸的硫酸钠溶液中滴加氯化钡溶液
D、
向含有一定量硫酸的硫酸钠溶液中滴加氯化钡溶液
D、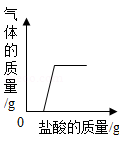 向部分变质的NaOH溶液中滴加过量稀盐酸
10. 如图为甲、乙、丙三种物质的溶解度曲线。下列说法正确的是( )
向部分变质的NaOH溶液中滴加过量稀盐酸
10. 如图为甲、乙、丙三种物质的溶解度曲线。下列说法正确的是( ) A、将甲的饱和溶液由t1℃升温至t2℃ , 溶质质量分数变大 B、将甲、乙、丙的饱和溶液从t2℃降到t1℃,析出晶体质量最大的是甲 C、t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等 D、t2℃时,等质量的甲乙丙三种物质分别溶于水得到饱和溶液,甲需要的水质量最大11. 除去下列物质中的杂质,选用的方法和试剂正确的是( )
A、将甲的饱和溶液由t1℃升温至t2℃ , 溶质质量分数变大 B、将甲、乙、丙的饱和溶液从t2℃降到t1℃,析出晶体质量最大的是甲 C、t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等 D、t2℃时,等质量的甲乙丙三种物质分别溶于水得到饱和溶液,甲需要的水质量最大11. 除去下列物质中的杂质,选用的方法和试剂正确的是( )选项
物质
杂质
除去杂质所用的试剂和方法
A
碳酸钠粉末
碳酸钙粉末
加足量水过滤、蒸发
B
二氧化碳
氯化氢
通过氢氧化钠溶液、洗气
C
铁
氧化铁
加足量盐酸、过滤
D
氯化铁溶液
盐酸
加足量铁粉、过滤
A、A B、B C、C D、D12. 石蕊、硫酸、氢氧化钙、碳酸钠是常见的四种物质,它们的溶液之间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质间反应的主要实验现象,其中描述正确的是( )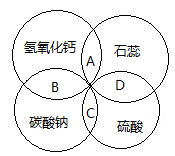 A、石蕊溶液变为红色 B、无明显现象 C、生成无色气体 D、石蕊呈紫色
A、石蕊溶液变为红色 B、无明显现象 C、生成无色气体 D、石蕊呈紫色二、填空简答题(本题包括4小题,共36分)
-
13. 酸、碱、盐之间的反应与人们日常生活有着密切的关系。(1)、食醋能作酸味的调味剂,是因为其主要成分醋酸(化学式为CH3OOH)在水溶液中能解离出CH3COO-和(填离子符号)。(2)、胃液分泌过多会引起胃病。服用含有氢氧化铝的药物可缓解病痛,其治疗的化学原理为(用化学方程式表示)。(3)、某同学不小心被黄蜂了(黄蜂毒液呈碱性),为了减轻疼痛可以涂抹下列物质中的(填字母)。
A.食醋(pH=3)
B.浓硫酸
C.食盐水(pH=7)
D.苏打或肥皂水(pH=9~10)
(4)、酿酒厂生产白酒时,常加入适量稀硫酸来控制酸度,发酵完成后进行蒸馏,即可得到白酒,盐酸的价格比硫酸低,同样能控制酸度,请说明控制酸度不用盐酸的原因。14. 图1是三种常见物质的溶解度曲线。请回答以下问题。
 (1)、由图1可知,同质量的三种物质的饱和溶液由50℃降温到10℃时,析出晶体质量最多的物质是(填名称)。(2)、图1所示三种物质中溶解度随温度升高而减小的物质(填名称)。(3)、若硝酸钾固体中混有少量氯化钠、提纯硝酸钾的方法是(选填“降温结晶”、“蒸发结晶”)。(4)、现有40℃时等质量的硝酸钾、氯化钠的饱和溶液,加热蒸发等质量的水后恢复至40℃,剩余溶液的质量关系大小为硝酸钾的氯化钠的(选填“>”、“=”或“<”)。(5)、若a、b、c分别代表上述三种物质,图2是在室温下,烧杯中a物质的溶液、试管①中b物质的溶液和试管②中c物质的溶液的状态。当从室温升至60℃时,发现烧杯中a物质没有明显变化,试管①中b物质全部溶解,试管②中有c物质析出,写出a、b、c三种物质的化学式:abc(6)、20℃时,欲测定Ca(OH)2溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH(填“偏大”、“偏小”或“不受影响”)15. 构建模型和构建知识网络是化学学习中重要的学习方法,小光同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
(1)、由图1可知,同质量的三种物质的饱和溶液由50℃降温到10℃时,析出晶体质量最多的物质是(填名称)。(2)、图1所示三种物质中溶解度随温度升高而减小的物质(填名称)。(3)、若硝酸钾固体中混有少量氯化钠、提纯硝酸钾的方法是(选填“降温结晶”、“蒸发结晶”)。(4)、现有40℃时等质量的硝酸钾、氯化钠的饱和溶液,加热蒸发等质量的水后恢复至40℃,剩余溶液的质量关系大小为硝酸钾的氯化钠的(选填“>”、“=”或“<”)。(5)、若a、b、c分别代表上述三种物质,图2是在室温下,烧杯中a物质的溶液、试管①中b物质的溶液和试管②中c物质的溶液的状态。当从室温升至60℃时,发现烧杯中a物质没有明显变化,试管①中b物质全部溶解,试管②中有c物质析出,写出a、b、c三种物质的化学式:abc(6)、20℃时,欲测定Ca(OH)2溶液的pH,若先将pH试纸用蒸馏水润湿,再进行测定,则所测溶液的pH(填“偏大”、“偏小”或“不受影响”)15. 构建模型和构建知识网络是化学学习中重要的学习方法,小光同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题: (1)、为了验证性质①,小光将紫色石蕊试液滴加到稀盐酸中,溶液变成色。(2)、小光将-枚生锈的铁钉放入足量的稀盐酸中,他首先观察到的现象是 , 过一会儿,他又观察到。发生以上反应现象的化学方程式分别为:、。
(1)、为了验证性质①,小光将紫色石蕊试液滴加到稀盐酸中,溶液变成色。(2)、小光将-枚生锈的铁钉放入足量的稀盐酸中,他首先观察到的现象是 , 过一会儿,他又观察到。发生以上反应现象的化学方程式分别为:、。小光的这个实验体现了性质(填序号,下同),其中性质在工业上可用于除铁锈。
(3)、假设编号③反应的盐是AgNO3 , 则编号③对应的化学方程式是。(4)、物质组成和结构决定其性质。从微观进入宏观,探索物质变化规律。例如:稀盐酸不能与氯化钡溶液反应,而稀硫酸则能与之反应生成白色沉淀,写出化学方程式: 。体现了不同的酸也具有各自的特性,原因是。
(5)、通过分析组成和结构,可以预测物质的某些性质。根据右图硫酸氢钠溶液的微观图示,分析推断NaHSO4的性质,其中正确的是。
A其水溶液能使紫色石蕊试液变蓝
B其水溶液能与金属镁粉反应
C其水溶液能与碳酸钠反应
D其水溶液能与硝酸钡溶液反应
16. 海水中有大量可以利用的化学资源, 例如氯化镁、氯化钠、溴化钾等。综合利用海水制备金属镁的流程如图所示: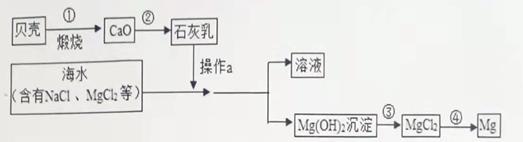 (1)、从海水中获得食盐用到的方法是 , 提取氯化镁不用该方法的原因是。(2)、请写出其中任意三个反应的化学方程式,要求所属反应基本类型不能有重复。;;。
(1)、从海水中获得食盐用到的方法是 , 提取氯化镁不用该方法的原因是。(2)、请写出其中任意三个反应的化学方程式,要求所属反应基本类型不能有重复。;;。三、实验与探究(本题包括1个小题,共12分)
-
17. 学习化学开启了我们认识物质之旅。某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。
 (1)、[探究一]溶解过程中的能量变化。如图所示,同学们设计了不同的实验方案进行探究:
(1)、[探究一]溶解过程中的能量变化。如图所示,同学们设计了不同的实验方案进行探究:实验一中的硝酸铵溶解后,溶液温度(填“升高”、“降低”或“不变”)。
(2)、实验二所加试剂及用量如图,将分液漏斗中的水全部加入试管后,立即关闭分液漏斗的活塞,此时观察到U形管的液面左低右高,由此得出“氢氧化钠溶于水时放出热量”的结论,你不同意此结论,写出你的理由 。(3)、[探究二]氢氧化钠的化学性质如图所示,同学们用氢氧化钠进行了下列实验,请分析并回答下列问题:

①中观察到的现象是 , ②试管中观察到的现象是。
(4)、③试管中发生反应的化学方程式。(5)、③④⑤试管中发生的反应属于复分解反应的是。(6)、实验⑤⑥为用软矿泉水瓶所做的对比实验,装的软矿泉水瓶变瘪更明显,原因是(用化学方程式表示)(7)、[探究三]氢氧化钠在实验室中的应用。①实验室中能用氢氧化钠溶液吸收的气体是(填字母序号)
a.二氧化碳
b.水蒸气
c.氯化氢
d.氧气
②吸收上述所选气体一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的不同。
四、计算题(本题包括1小题,共12分)
-
18. 黄铜(铜锌合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%~ 65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80g稀硫酸,分四次等质量加入,每次均充分反应,得到实验数据如下表所示:
实验次数
1
2
3
4
稀硫酸的用量/g
20
20
20
20
剩余固体的质量/g
20.0
17.4
m
13.5
(1)、m=。所取黄铜螺母中铜的质量为g。(2)、通过计算说明该黄铜螺母的材料性能 (填“优良”或“不优良”)。(3)、计算稀硫酸中溶质的质量分数(写出计算过程)。(4)、分析实验数据,在如图坐标中画出加入80g稀硫酸过程中相应的曲线图(纵坐标为自行设定物质的质量;并标出曲线中必要的数据)
-