安徽省合肥市六校联盟2020-2021学年高一上学期期末联考化学试题
试卷更新日期:2021-11-02 类型:期末考试
一、单选题
-
1. 化学与生产、生活密切相关。下列有关物质的性质与用途不具有对应关系的是( )A、BaCO3不溶于水,可用作医疗上检查肠胃的钡餐 B、氧化铝熔点高,可用作耐高温材料 C、氢氧化铁胶体具有吸附性,可用于净水 D、小苏打能与盐酸反应,可用于治疗胃酸过多2. 下列物质分类的正确组合是( )
分类
纯净物
盐
碱性氧化物
酸性氧化物
A
碱石灰
烧碱
氧化铝
二氧化碳
B
NH3·H2O
小苏打
氧化镁
一氧化碳
C
五水硫酸铜
纯碱
氧化钠
三氧化硫
D
H2O2
苏打
过氧化钠
二氧化硫
A、A B、B C、C D、D3. 下列关于电解质、非电解质的叙述错误的是( )A、在水溶液中和熔融状态下均不导电的化合物叫非电解质 B、电解质、非电解质都是针对化合物而言,单质既不属于电解质,也不属于非电解质 C、氧化钠是强电解质,硫酸钡是弱电解质 D、纯水的导电性很差,但水也是电解质4. 下列有关化学用语表示正确的是( )A、中子数为20的氯原子: B、MgCl2的电子式: C、F-的结构示意图:
C、F-的结构示意图:  D、硫酸氢钠在水中的电离方程式:NaHSO4=Na++
5. 设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )A、标准状况下,22.4 L Cl2与22.4 L H2O中所含的分子数均为NA B、由6.2 g Na2O与7.8 g Na2O2组成的混合物中阴离子总数为0.2 NA C、10 g 49%的硫酸与10 g 49%的H3PO4 , 溶液中所含的氧原子数均为0.2 NA D、0.2 mol/L的NaCl溶液中,Na+与Cl-的总数为0.4 NA6. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、无色透明溶液中的Fe3+、Mg2+、OH-、Cl- B、无色酸性的溶液中Na+、Al3+、 、Cl- C、0.1mol/LFeCl3溶液中可能大量共存:Fe2+、 、SCN-、 D、滴加石蕊显红色的溶液中K+、Na+、 、7. 下列表示溶液中所发生反应的离子方程式正确的是( )A、向Ba(OH)2溶液中加入稀H2SO4溶液:Ba2++OH-+H++ =BaSO4↓+H2O B、将铜丝插入硝酸银溶液中:Cu+Ag+=Cu2++Ag C、碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O D、钠与水反应:2Na + 2H2O=2Na+ + 2OH- + H2↑8. 下列变化可通过一步化学反应实现的是( )A、Na2O2→Na B、Al2O3→Al(OH)3 C、Fe2O3→Fe(OH)3 D、Na2CO3→NaOH9. 加碘盐中含有KIO3 , 其能发生反应KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,下列有关该反应的说法正确的是( )A、H2SO4是氧化剂 B、KIO3发生氧化反应 C、I2的还原性大于I- D、每生成0.6mol I2 , 反应转移电子数为NA10. 科学家最近合成了一种新型分子,它由4个氧原子构成。液化后能量、密度都比普通氧分子高得多,下列说法正确的是( )A、摩尔质量是64g B、它是一种新的化合物 C、它是由氧元素组成的一种单质 D、1 mol该分子中含有2NA个氧原子11. 同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是( )A、密度比为1∶1 B、密度比为11∶16 C、体积比为1∶1 D、体积比为11∶1612. 下列关于碳酸钠和碳酸氢钠的叙述正确的是( )A、相同条件下,在水中的溶解性:碳酸钠 碳酸氢钠 B、相同条件下,热稳定性:碳酸钠 碳酸氢钠 C、相同条件下,与酸反应产生二氧化碳气体的速率:碳酸钠 碳酸氢钠 D、一定条件下,碳酸钠不能转化为碳酸氢钠,而碳酸氢钠可以转化为碳酸钠13. 下列对新制氯水与久置氯水性质的叙述正确的是( )A、都为黄绿色 B、都具有漂白性 C、都能与硝酸银溶液产生白色沉淀 D、都能使紫色石蕊试液呈红色14. 下列实验现象描述正确的是( )
D、硫酸氢钠在水中的电离方程式:NaHSO4=Na++
5. 设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )A、标准状况下,22.4 L Cl2与22.4 L H2O中所含的分子数均为NA B、由6.2 g Na2O与7.8 g Na2O2组成的混合物中阴离子总数为0.2 NA C、10 g 49%的硫酸与10 g 49%的H3PO4 , 溶液中所含的氧原子数均为0.2 NA D、0.2 mol/L的NaCl溶液中,Na+与Cl-的总数为0.4 NA6. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、无色透明溶液中的Fe3+、Mg2+、OH-、Cl- B、无色酸性的溶液中Na+、Al3+、 、Cl- C、0.1mol/LFeCl3溶液中可能大量共存:Fe2+、 、SCN-、 D、滴加石蕊显红色的溶液中K+、Na+、 、7. 下列表示溶液中所发生反应的离子方程式正确的是( )A、向Ba(OH)2溶液中加入稀H2SO4溶液:Ba2++OH-+H++ =BaSO4↓+H2O B、将铜丝插入硝酸银溶液中:Cu+Ag+=Cu2++Ag C、碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O D、钠与水反应:2Na + 2H2O=2Na+ + 2OH- + H2↑8. 下列变化可通过一步化学反应实现的是( )A、Na2O2→Na B、Al2O3→Al(OH)3 C、Fe2O3→Fe(OH)3 D、Na2CO3→NaOH9. 加碘盐中含有KIO3 , 其能发生反应KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,下列有关该反应的说法正确的是( )A、H2SO4是氧化剂 B、KIO3发生氧化反应 C、I2的还原性大于I- D、每生成0.6mol I2 , 反应转移电子数为NA10. 科学家最近合成了一种新型分子,它由4个氧原子构成。液化后能量、密度都比普通氧分子高得多,下列说法正确的是( )A、摩尔质量是64g B、它是一种新的化合物 C、它是由氧元素组成的一种单质 D、1 mol该分子中含有2NA个氧原子11. 同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是( )A、密度比为1∶1 B、密度比为11∶16 C、体积比为1∶1 D、体积比为11∶1612. 下列关于碳酸钠和碳酸氢钠的叙述正确的是( )A、相同条件下,在水中的溶解性:碳酸钠 碳酸氢钠 B、相同条件下,热稳定性:碳酸钠 碳酸氢钠 C、相同条件下,与酸反应产生二氧化碳气体的速率:碳酸钠 碳酸氢钠 D、一定条件下,碳酸钠不能转化为碳酸氢钠,而碳酸氢钠可以转化为碳酸钠13. 下列对新制氯水与久置氯水性质的叙述正确的是( )A、都为黄绿色 B、都具有漂白性 C、都能与硝酸银溶液产生白色沉淀 D、都能使紫色石蕊试液呈红色14. 下列实验现象描述正确的是( )选项
实验
现象
A
向饱和Na2CO3溶液中通入足量的CO2气体
无明显现象
B
在酒精灯上加热铝箔
铝箔熔化,失去光泽,熔化的铝滴落下来
C
向久置于空气中的FeSO4溶液中滴加NaOH溶液
立刻产生大量白色沉淀
D
加热放在坩埚中的小块钠
钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体
A、A B、B C、C D、D15. 铁粉在高温下可与水蒸气反应。若反应后得到的干燥固体质量比反应前铁粉的质量增加了32g。则参加反应的铁粉的物质的量是( )A、0.5mol B、1mol C、1.5mol D、2mol16. 称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。若同温同压下放出相同体积的气体,则两份铝粉的质量比为( )A、1:1 B、1:3 C、2:3 D、1:617. X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )X
Y
Z
W
A、X的气态氢化物比Y的稳定 B、Z的最高价氧化物对应的水化物的酸性比W的强 C、Y的非金属性比Z的强 D、原子半径:X < Z < W18. 根据元素周期律,下列判断正确的是( )A、碱性:NaOH > KOH > RbOH B、离子半径:Na+ > O2- > F- C、热稳定性:HF>H2O>NH3 D、还原性:Na < Mg < Al二、计算题
-
19.(1)、在室温和101kPa的条件下,某容器共收集到1体积CO2、3体积H2 , 该容器中CO2、H2的物质的量之比是。(2)、若某容器收集到相等分子数的CO2、H2两种气体,则该容器中的CO2、H2质量之比是。(3)、44gM和49gN恰好完全反应生成76gB和一定量的气体Y,若Y的相对分子质量为34,则标准状况下Y的体积为。(4)、已知A是二价金属,82g该金属的硝酸盐中含有6.02×1023个NO ,则该硝酸盐的摩尔质量为。(5)、将5mol·L-1的Mg(NO3)2溶液以amL稀释至bmL,稀释后溶液中NO 的物质的量浓度是。
三、综合题
-
20. 如表是元素周期表的一部分,针对表中 种元素,填写下列空白:
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0族
2
3
4
(1)、同位素在生活生产和科学研究中有着重要的用途。例如,考古时利用(填核素符号)测定一些文物的年代。(2)、在最高价氧化物的水化物中,酸性最强的化合物的化学式是 , 碱性最强的化合物的化学式是。(3)、最高价氧化物是两性氧化物的元素在周期表中的位置;写出它的氧化物与氢氧化钠溶液反应的离子方程式。(4)、从 到 的元素中, 原子半径最大(填元素符号)。(5)、元素 与 形成的化合物属于(填“共价”或“离子”)化合物。(6)、若要比较 比 的金属性强弱,下列实验方法可行的是___________。A、将单质 置于 的盐溶液中,如果 不能置换出单质 ,说明 的金属性弱 B、比较 和 的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强 C、将 和 的单质分别投入到水中,观察到 与水反应更剧烈,说明 的金属性强 D、将 和 的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强21. 铝土矿的主要成分是Al2O3 , 含有杂SiO2 , Fe2O3 , MgO。工业上从铝土矿中提取铝可采用如下工艺流程(已知SiO2不与盐酸反应):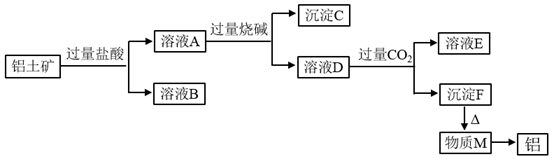
请回答下列问题:
(1)、图中涉及分离溶液与沉淀的实验方法是(填操作名称)。(2)、沉淀B的成分是(填化学式,下同),沉淀C的成分是;溶液D中所含的酸根离子是。(3)、沉淀F转化为物质M的化学方程式为;溶液D中通入过量CO2生成沉淀F的离子方程式为。(4)、能否将向溶液D中通入过量CO2换成加入过量盐酸?(填“能”或“不能”)其理由是。22. 某化学兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置略)。
请回答下列问题:
(1)、选择必要的仪器,按顺序连接好装置(填装置序号)。(2)、检验装置B气密性的方法为。(3)、实验时,在点燃酒精喷灯前必须进行的操作是 , 待装置E中出现现象时,再点燃酒精喷灯,以上操作的目的是。(4)、加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成。两种产物中有一种是盐,则钠与二氧化碳反应的化学方程式是。(5)、上述实验生成的黑色物质与浓硫酸在一定条件下反应会生成一种大气污染物SO2气体,可利用酸性KMnO4溶液来测定该气体在空气中的含量,反应的离子方程式。
-