安徽省宣城市2019-2020学年高二上学期期末考试化学试题
试卷更新日期:2021-11-02 类型:期末考试
一、单选题
-
1. 中华传统文化中蕴藏着很多化学原理。下列对古文或古诗词的说明正确的是( )
选项
古文或古诗词
说明
A
冰,水为之,而寒于水
冰变成水过程中放出能量
B
蜡烛成灰泪始干
蜡烛燃烧过程中化学能全部转化为光能
C
日照香炉生紫烟
紫烟指的是碘的升华
D
用浓酒和糟入甑,蒸令气上,用器承滴露
该过程中利用到蒸馏原理
A、A B、B C、C D、D2. 化学与生产生活、社会密切相关。下列有关说法错误的是( )A、明矾常用于水体的杀菌消毒 B、用热的纯碱溶液可洗涤厨房金属表面的油污 C、高纯度的二氧化硅广泛用于制作光导纤维 D、石墨烯弹性气凝胶制成的轻质“碳海绵”可用于吸附海上泄漏的原油3. 下列属于吸热的氧化还原反应的是( )A、可燃物的燃烧 B、铵盐和碱反应生成氨气 C、水煤气的生成 D、铝热反应4. 化学概念的理解需要从本质上进行分析,否则易产生不符合题意。下列有关“电”概念中,不需要通电即可进行的是( )A、电泳 B、电离 C、电镀 D、电解5. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、28g乙烯和氮气的混合气体中所含原子数为4NA B、标准状况下,11.2LSO3所含原子数为2NA C、100mL0.1mol/L的Na2S溶液中含有的S2-数为0.01NA D、常温常压下,1.7g-CHD2含中子数为0.8NA6. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、含大量Al3+的溶液中:K+、Mg2+、NO 、HCO B、 =10-12的溶液中:NH 、Na+、SO 、NO C、pH=7溶液中:Fe3+、SO 、Cl-、H2O2 D、无色透明溶液中:Na+、ClO-、Fe3+、SO7. 如图横坐标表示温度,纵坐标表示反应物转化率,下列反应中,符合该图变化规律的是( ) A、N2(g)+O2(g)⇌2NO(g) △H>0 B、2SO2(g)+O2(g)⇌2SO3(g) △H<0 C、H2(g)+I2(g)⇌2HI(g) △H<0 D、2H2O(g)⇌2H2(g)+O2(g) △H>08. 工业上,合成氨反应N2+3H2 2NH3的微观历程如图所示。下列说法正确的是( )
A、N2(g)+O2(g)⇌2NO(g) △H>0 B、2SO2(g)+O2(g)⇌2SO3(g) △H<0 C、H2(g)+I2(g)⇌2HI(g) △H<0 D、2H2O(g)⇌2H2(g)+O2(g) △H>08. 工业上,合成氨反应N2+3H2 2NH3的微观历程如图所示。下列说法正确的是( ) A、①→②过程中,催化剂在吸附反应物分子时,破坏了分子中的非极性键 B、②→③是形成N原子和H原子的过程,同时释放能量 C、③→④形成了新的化学键,且是一个放热过程 D、使用合适的催化剂,能提高反应物的转化率9. 现有物质的量浓度均为0.1 mol/L NaCl、MgCl2、FeCl3三种溶液,体积比为3:2:1,则三种溶液中c(Cl-)的物质的量浓度之比为( )A、1:2:3 B、3:4:3 C、3:2:1 D、1:1:110. 以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO ,其反应过程示意图如图所示,下列说法错误的是( )
A、①→②过程中,催化剂在吸附反应物分子时,破坏了分子中的非极性键 B、②→③是形成N原子和H原子的过程,同时释放能量 C、③→④形成了新的化学键,且是一个放热过程 D、使用合适的催化剂,能提高反应物的转化率9. 现有物质的量浓度均为0.1 mol/L NaCl、MgCl2、FeCl3三种溶液,体积比为3:2:1,则三种溶液中c(Cl-)的物质的量浓度之比为( )A、1:2:3 B、3:4:3 C、3:2:1 D、1:1:110. 以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO ,其反应过程示意图如图所示,下列说法错误的是( ) A、Pd上发生的电极反应为:H2-2e-=2H+ B、Fe(II)与Fe(III)的相互转化起到了传递电子的作用 C、反应过程中NO 被Fe(II)还原为N2 D、用该法处理后水体的pH降低11. 已知Cl2(g)+CO(g)⇌COCl2(g)的速率方程 [k为速率常数,只受温度影响],该反应可认为经过以下反应历程:
A、Pd上发生的电极反应为:H2-2e-=2H+ B、Fe(II)与Fe(III)的相互转化起到了传递电子的作用 C、反应过程中NO 被Fe(II)还原为N2 D、用该法处理后水体的pH降低11. 已知Cl2(g)+CO(g)⇌COCl2(g)的速率方程 [k为速率常数,只受温度影响],该反应可认为经过以下反应历程:第一步:Cl2⇌2Cl 快速平衡
第二步:Cl+CO⇌COCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
下列说法正确的是( )
A、第一步反应和第二步反应的活化能较高 B、c(CO)、c(Cl2)分别增大相同的倍数,对总反应速率的影响程度相同 C、该总反应的速率主要取决于第三步反应 D、第三步反应的有效碰撞频率较大12. 乙烯气相直接水合反应制备乙醇的反应:C2H4(g)+H2O(g)⇌C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如图所示[起始时,n(H2O)=n(C2H4)=1mol,容器体积为1L]。下列分析错误的是( ) A、乙烯气相直接水合反应的△H<0 B、压强的大小关系为:p1<p2<p3 C、a点对应的平衡常数K= D、达到平衡状态a、b所需要的时间:a>b13. 25℃时,向10mL 0.10mol/L的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10 mol/L NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
A、乙烯气相直接水合反应的△H<0 B、压强的大小关系为:p1<p2<p3 C、a点对应的平衡常数K= D、达到平衡状态a、b所需要的时间:a>b13. 25℃时,向10mL 0.10mol/L的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10 mol/L NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( ) A、溶液在a点和b点时水的电离程度相同 B、a点时,c(HA)+c(OH-)=c(Na+)+c(H+) C、V=10 mL时,c(Na+)>c(A-)>c(H+)>c(HA) D、b点时,c(Na+)=c(HA)+c(A-)+c(OH-)14. Li-SO2Cl2电池可用于心脏起搏器。该电池的电极材料分别为Li和C,申解液是LiAlCl4-SO2Cl2 , 总反应为:2Li+SO2Cl2=2LiCl+SO2↑,其工作示意图如图所示。下列叙述中正确的是( )
A、溶液在a点和b点时水的电离程度相同 B、a点时,c(HA)+c(OH-)=c(Na+)+c(H+) C、V=10 mL时,c(Na+)>c(A-)>c(H+)>c(HA) D、b点时,c(Na+)=c(HA)+c(A-)+c(OH-)14. Li-SO2Cl2电池可用于心脏起搏器。该电池的电极材料分别为Li和C,申解液是LiAlCl4-SO2Cl2 , 总反应为:2Li+SO2Cl2=2LiCl+SO2↑,其工作示意图如图所示。下列叙述中正确的是( ) A、电池工作时负极材料是Li,发生还原反应 B、电池工作肘,电子流向:锂电极→负载→碳棒→电解液→锂电极 C、外电路流过0.2mol电子,生成2.24L气体 D、电池必须在无水、无氧的条件下进行工作15. 某温度下,在恒容(2 L)密闭容器中发生反应:N2(g)+3H2(g)⇌2NH3(g)。甲、乙、丙三种情况下,起始充入N2和H2的物质的量如表所示,其中甲经2 min达平衡时,N2的转化率为50%。下列判断正确的是( )
A、电池工作时负极材料是Li,发生还原反应 B、电池工作肘,电子流向:锂电极→负载→碳棒→电解液→锂电极 C、外电路流过0.2mol电子,生成2.24L气体 D、电池必须在无水、无氧的条件下进行工作15. 某温度下,在恒容(2 L)密闭容器中发生反应:N2(g)+3H2(g)⇌2NH3(g)。甲、乙、丙三种情况下,起始充入N2和H2的物质的量如表所示,其中甲经2 min达平衡时,N2的转化率为50%。下列判断正确的是( )起始物质的量mol
甲
乙
丙
n(N2)
1
2
2
n(H2)
3
3
6
A、容器中气体的密度可作为判断反应是否达到平衡状态的标志 B、平衡时,乙中H2转化率大于50% C、反应达平衡时,丙中H2的物质的量浓度c(H2)等于甲中的2倍 D、甲、乙、丙三种条件下的化学平衡常数之间的关系为K甲<K乙<K丙二、填空题
-
16. 现有下列10种物质:①Na2CO3(aq) ②NaHCO3(s) ③液态氢化氢 ④Al(OH)3(s) ⑤NaOH(s) ⑥氯水 ⑦浓氨水 ⑧熔融的NaCl(1)、其中能导电且属于电解质的是(填序号),NaHCO3电离方程式为。(2)、Na2CO3溶液显碱性的原因(用离子方程式表示)。(3)、④加入⑤的水溶液中,反应的离子方程式为。(4)、实验室可在⑦中加入⑤快速制取氨气,请用化学平衡移动原理简述原因。(5)、分别采取下列措施后,氯水的漂白能力从强到弱的顺序为(用字母表示)。
A.加入少量Na2CO3固体 B.不加任何物质 C.加入少量Na2SO3固体
17. 2018年7月至9月,国家文物局在辽宁开展水下考古,搜寻、发现并确认了甲午海战北洋水师沉舰——经远舰。已知:正常海水呈弱碱性。(1)、经远舰在海底“沉睡”124年后,钢铁制成的舰体腐蚀严重。舰体发生电化学腐蚀时,负极的电极反应式为。(2)、为了保护文物,考古队员采用“牺牲阳极的阴极保护法”对舰船进行了处理。
①下列说法错误的是。
A.锌块发生氧化反应:Zn-2e-=Zn2+
B.舰体有电子流入,可以有效减缓腐蚀
C.若通过外加电源保护舰体,应将舰体与电源正极相连
D.地下钢铁管道用导线连接锌块与该种舰体保护法原理相同
②采用“牺牲阳极的阴极保护法”后,舰体上正极的电极反应式为。
(3)、船上有些器皿是铜制品,表面有铜锈。①据了解铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。
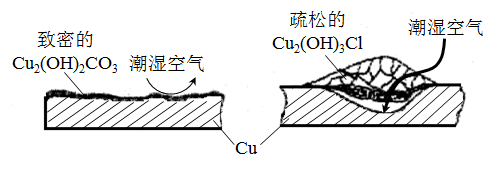
下列说法正确的是
A.疏松的Cu2(OH)3Cl属于有害锈
B.Cu2(OH)2CO3既能溶于盐酸也能溶于氢氧化钠溶液
C.青铜器表面涂一层食盐水可以做保护层
D.用HNO3溶液除锈可以保护青铜器的艺术价值,做到“修旧如旧”
②文献显示Cu2(OH)3Cl的形成过程中会产生CuCl(白色不溶于水的固体),将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,可以使CuCl转化为难溶的Cu2(OH)2CO3反应的离子方程式为。
(4)、考古队员将舰船上的部分文物打捞出水后,采取脱盐、干燥等措施保护文物。从电化学原理的角度分析“脱盐、干燥”的防腐原理:。18. 一种用草酸泥渣(含PbC2O4和PbSO4)制备PbCrO4的工艺流程如图:
已知:①PbC2O4完全分解的化学方程式为PbC2O4 PbO+CO↑+CO2↑。②PbCrO4难溶于水。回答下列问题:
(1)、泥渣“粉磨筛分”的目的是;实验室过滤操作需要的玻璃仪器有漏斗、烧杯和。(2)、用Na2CO3将难以热分解的硫酸铅转化为易分解的的碳酸铅。若在水溶液中进行,PbSO4(s)+ (aq)=PbCO3(s)+ (aq),该反应的平衡常数K。[已知Ksp(PbCO3) =6.4×10-4 , Ksp(PbSO4)=1.6×10-8]。(3)、铬酸钠在硫酸溶液中可转化为重铬酸钠,该反应的离子方程式为 , 步骤V“合成”时发生反应的化学方程式为。(4)、铬酸铅是一种用于水彩和油彩的黄色颜料,遇到空气中的硫化氢颜色会变黑,该过程的化学方程式为。三、综合题
-
19. 氮元素及其化合物在日常生活、工农业生产及军事领域应用广泛。(1)、肼(N2H4)是发射火箭的一种重要原料,电子式为。(2)、已知反应:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-1025kJ/mol,在2 L密闭容器中投入1mol NH3和1mol O2 , 2 min后测得反应放热102.5 kJ。用氧气表示0~2 min的反应速率v(O2)= , 此时,H2O(g)的体积分数为%(保留2位小数)。(3)、已知Ksp(AgCl)=1.8×10-10 , 向100mL 2×10-5mol/L AgNO3溶液中滴加100mL 1×10-5mol/LNH4Cl溶液,溶液中(填“有”或“没有”)白色AgCl沉淀生成。(4)、将6NO+4NH3=5N2+6H2O设计成原电池能有效降低含氮化合物的排放,减少环境污染,装置如图所示。

电极B为极,反应过程中每转移0.3mol电子,可消除有害气体的体积为L(标准状况下)。
20. 某研究小组为测定软锰矿中MnO2的质量分数,实验步骤如下:准确称取0.5000g软锰矿样品,加入1.34gNa2C2O4再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到250mL容量瓶中并定容。取出25.00mL待测液置于锥形瓶中,再用0.0100mol/L KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。(已知KMnO4、MnO2在酸性条件下均能将NaC2O4氧化,且还原产物均为Mn2+。)(1)、配制240mL 0.0100mol/L KMnO4标准溶液,若使用分析天平需要KMnO4固体质量为g(保留4位有效数字),需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为(填名称)。(2)、酸化KMnO4溶液可选用的酸是 , KMnO4标准溶液应置于(填 “酸式”或“碱式”)滴定管中,原因是。(3)、KMnO4和Na2C2O4在酸性条件下反应的离子方程式为。(4)、到达滴定终点的实验现象是。(5)、根据实验数据计算,软锰矿中MnO2的质量分数为%。