河南省新郑市2021-2022学年高一上学期化学第一次月考试卷
试卷更新日期:2021-11-02 类型:月考试卷
一、单选题
-
1. 化学与生活是紧密相联的,下列说法中错误的是( )A、用过氧化钠作潜水艇的供氧剂 B、将少量食醋加入“84”消毒液中,会增强其杀菌消毒效果 C、小苏打( )用于制作糕点 D、地震灾区和洪涝灾区都用漂白粉消毒,主要是利用漂白粉溶液的碱性2. 关于一些化学概念有下列说法,其中正确的是( )A、金刚石和 具有相同的性质 B、含0.1mol 的溶液完全反应,生成的胶体中 胶粒的数目小于 C、醋酸、纯碱、胆矾分别属于酸、碱、盐 D、能电离出氢离子的化合物均是酸3. 用NA表示阿伏加德罗常数,下列说法正确的是( )A、22.4L氢气中有2NA个氢原子 B、14g氮气中含有NA个氮原子 C、2L0.3mol·L-1Na2SO4溶液中含0.6NA个Na+ D、标准状况下,含有NA个O原子的臭氧(O3)体积约为11.2L4. 分类思想在很多学科与领域都广泛应用,下面是两种分类的图示

下列有关说法中错误的是( )
A、甲为树状分类法,乙图为交叉分类法 B、两种分类方法中,乙图分类法能为分析对象提供更多的信息 C、根据乙图可知,所有的盐都含有金属元素 D、甲图中酸碱盐的溶质均为电解质5. 下列实验操作或记录正确的是( )A、常温常压下测得1mol 的质量为32g B、用量筒量取盐酸的体积为12.28mL C、进行蒸发操作时,待混合物中的水分完全蒸干后,及时熄灭酒精灯 D、向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体,该溶液中一定含有6. 某同学要在奥运五环中填入物质,使相连物质间能发生反应不相连物质之间不能发生反应。你认为“五连环”中有空缺的一环应填入的物质是( ) A、O2 B、稀硫酸 C、CO2 D、CaO7. 运用所学知识,找出金属钠与金属铁的共同性质,下列说法正确的是( )A、都能从硫酸铜溶液中置换出铜 B、都是银白色的金属,质软 C、常温下,都能与水反应生成氢气 D、一定条件下,都能与氧气反应8. 除去括号内杂质所用试剂和方法错误的是( )A、 —灼热的 网 B、 —浓 ,洗气 C、 —加热 D、 —稀盐酸,过滤9. 下列溶液中 最大的是( )A、200mL0.2mol/L 溶液 B、500mL0.5mol/L 溶液 C、400mL0.3mol/L 溶液 D、1000mL0.4mol/L 溶液10. 下列选项所表示的物质间转化关系不能一步转化的是( )A、CaO→Ca(OH)2→CaCl2→CaCO3 B、Na→Na2O2→Na2CO3→NaOH C、CO2→NaHCO3→Na2CO3→NaCl D、Cu→CuO→Cu(OH)2→CuCl211. 青蒿素的化学式为C15H22O5 , 下列关于青蒿素的说法正确的是( )A、青蒿素属于氧化物 B、一个青蒿素分子中有11个氢分子 C、青蒿素由42种元素构成 D、青蒿素中碳元素的质量分数最大12. 下列实验操作能达到实验目的的是( )
A、O2 B、稀硫酸 C、CO2 D、CaO7. 运用所学知识,找出金属钠与金属铁的共同性质,下列说法正确的是( )A、都能从硫酸铜溶液中置换出铜 B、都是银白色的金属,质软 C、常温下,都能与水反应生成氢气 D、一定条件下,都能与氧气反应8. 除去括号内杂质所用试剂和方法错误的是( )A、 —灼热的 网 B、 —浓 ,洗气 C、 —加热 D、 —稀盐酸,过滤9. 下列溶液中 最大的是( )A、200mL0.2mol/L 溶液 B、500mL0.5mol/L 溶液 C、400mL0.3mol/L 溶液 D、1000mL0.4mol/L 溶液10. 下列选项所表示的物质间转化关系不能一步转化的是( )A、CaO→Ca(OH)2→CaCl2→CaCO3 B、Na→Na2O2→Na2CO3→NaOH C、CO2→NaHCO3→Na2CO3→NaCl D、Cu→CuO→Cu(OH)2→CuCl211. 青蒿素的化学式为C15H22O5 , 下列关于青蒿素的说法正确的是( )A、青蒿素属于氧化物 B、一个青蒿素分子中有11个氢分子 C、青蒿素由42种元素构成 D、青蒿素中碳元素的质量分数最大12. 下列实验操作能达到实验目的的是( )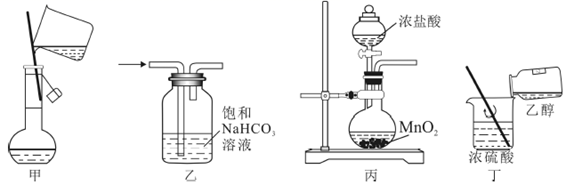 A、将4.0g 固体置于100mL甲容器中,加水至刻度,配制 溶液 B、用装置乙除去实验室所制 中的少量 C、实验室用丙装置制备氯气 D、丁装置用于混合浓硫酸和乙醇13. 金属钠分别投入下列溶液中,既有白色沉淀产生又有气体放出的是( )A、MgCl2溶液 B、K2SO4溶液 C、FeCl3溶液 D、CuSO4溶液14. 在自来水的生产中,常通入适量氯气进行杀菌消毒。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用以鉴别的一种试剂是( )A、氢氧化钠溶液 B、酚酞试液 C、硝酸银溶液 D、氯化钡溶液15. 如图所示是工业制纯碱的部分物质转化示意图,下列推测错误的是( )
A、将4.0g 固体置于100mL甲容器中,加水至刻度,配制 溶液 B、用装置乙除去实验室所制 中的少量 C、实验室用丙装置制备氯气 D、丁装置用于混合浓硫酸和乙醇13. 金属钠分别投入下列溶液中,既有白色沉淀产生又有气体放出的是( )A、MgCl2溶液 B、K2SO4溶液 C、FeCl3溶液 D、CuSO4溶液14. 在自来水的生产中,常通入适量氯气进行杀菌消毒。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用以鉴别的一种试剂是( )A、氢氧化钠溶液 B、酚酞试液 C、硝酸银溶液 D、氯化钡溶液15. 如图所示是工业制纯碱的部分物质转化示意图,下列推测错误的是( ) A、①~③涉及的操作方法中,包含过滤的是①③ B、溶液B不可循环使用 C、副产物NH4Cl可用作肥料 D、生产中应先通NH3 , 再通CO216. 同温同压下,等体积的甲乙两容器,甲容器中充满 ,乙容器中充满 ,下列说法错误的是( )A、甲乙两容器中气体分子数之比为1:1 B、甲乙两容器中气体质量之比为71:44 C、甲乙两容器中原子个数之比为2:3 D、甲乙两容器中气体所含质子数之比为17:22
A、①~③涉及的操作方法中,包含过滤的是①③ B、溶液B不可循环使用 C、副产物NH4Cl可用作肥料 D、生产中应先通NH3 , 再通CO216. 同温同压下,等体积的甲乙两容器,甲容器中充满 ,乙容器中充满 ,下列说法错误的是( )A、甲乙两容器中气体分子数之比为1:1 B、甲乙两容器中气体质量之比为71:44 C、甲乙两容器中原子个数之比为2:3 D、甲乙两容器中气体所含质子数之比为17:22二、填空题
-
17. 回答下列问题:(1)、现有下列物质:①小苏打② 晶体③ ④ 溶液⑤液态的 ⑥酒精( )⑦铜。上述物质中:能导电的是(填序号,下同);属于酸性氧化物的是。属于电解质的是。溶于水后形成的水溶液不能导电的是。(2)、同学们吃的食品包装袋中经常有一个小纸袋,上面写着“干燥剂”, 其主要成分是生石灰( )。
①生石灰属于哪类氧化物:。
②生石灰可作干燥剂的理由是(用化学方程式表示)。
(3)、某课外活动小组进行氢氧化铁胶体的制备实验并检验其性质。①现有甲、乙、丙三名同学进行氢氧化铁胶体的制备实验,其中正确的是(填序号)。a.甲同学的操作:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至混合液呈红褐色,停止加热;
b.乙直接加热饱和氯化铁溶液;
c.丙向沸水中滴加饱和氯化铁溶液,为了使反应进行充分,煮沸10分钟;
②制备氢氧化铁胶体的化学方程式是。
③证明有氢氧化铁胶体生成的实验操作是。
三、综合题
-
18. 氯气及其化合物有重要作用,请根据下列实验回答问题:(1)、工业利用氯气和石灰乳反应可制得漂白粉, 其化学方程式为 , 漂白粉的有效成分是。(2)、下列收集 的正确装置是_______。A、
 B、
B、 C、
C、 D、
D、 (3)、某同学设计了如图实验装置进一步研究氯气的漂白性并确定真实起漂白作用的物质,已知通入的氯气中还含有空气和水蒸气。回答下列问题:
(3)、某同学设计了如图实验装置进一步研究氯气的漂白性并确定真实起漂白作用的物质,已知通入的氯气中还含有空气和水蒸气。回答下列问题:
①浓 的作用是。
②与研究目的直接相关的实验现象是。
③将 在盛有氯气的集气瓶中燃烧,其反应的化学方程式是。
④该实验设计存在事故隐患,应在D处增加一装置,该装置中应加入 溶液以除去多余的氯气,请用化学方程式表示反应原理。
19. 回答下列问题:(1)、Ⅰ.将11.7g 溶于水配制成100mL溶液。(计算均忽略混合后的体积变化)该溶液与100mL 1mol/L的 溶液混合后,氯离子的物质的量浓度为mol/L;
(2)、向(1)中反应后的溶液中再通入一定量的 气体后,溶液中 的物质的量浓度为3mol/L,则溶液中 的物质的量浓度为mol/L。(3)、Ⅱ.实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如图:硫酸 化学纯
(CP)
(500mL)
品名:硫酸
化学式:
相对分子质量:98
密度:
质量分数:98%
配制溶液时,一般可以分为以下几个主要步骤:①量取②计算③稀释④定容⑤转移⑥洗涤并转移⑦装瓶⑧冷却⑨上下颠倒摇匀。其正确的操作顺序为。(填序号)
(4)、配制480mL 0.50mol/L的稀硫酸,需取该浓硫酸mL。(5)、完成此实验需用到的仪器有量筒、烧杯、玻璃棒、、。(6)、①量取浓H2SO4时仰视读数将使最终所配浓度。(“偏高”、“偏低”、“无影响”)②将溶液转移到容量瓶后,要洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度。(“偏高”、“偏低”、“无影响”)③定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度。(“偏高”、“偏低”、“无影响”)
20. 回答下列问题:(1)、在紫外线作用下,氧气可转化为臭氧: ,低空臭氧的浓度过高时对人体有害,因此要尽量避免在阳光强烈照射的中午前后进行户外活动。① 转化为 属于(填“化学”或“物理”)变化;
②同温同压下,等质量的 和 的分子数之比为 , 密度之比为;
③1.6g 和 的混合气体中含有氧原子的数目为(用 表示阿伏加德罗常数的值)。
(2)、某工厂排放的无色废水中可能含有 、 、 、 、 中的两种或多种。取少量废水,向其中滴加稀盐酸有气体产生。回答下列问题:①废水中一定没有的离子是(填离子符号)。
②向废水中加过量浓氢氧化钠溶液,可能出现的现象是。
③为确定废水中还可能存在的以上离子,具体的实验方法是将少量废水放入试管中,向其中加入稀硝酸至不再产生气体,然后再。
-