江西智学联盟2021-2022学年高三上学期化学第一次月考试卷
试卷更新日期:2021-11-02 类型:月考试卷
一、单选题
-
1. 2020年11月24日,我国长征五号运载火箭成功发射升空,12月17日“嫦娥五号”探测器完成探月任务后顺利返回。下列有关说法错误的是( )A、运载火箭通常采用联氨(N2H4)、煤油、液氢等新能源作为燃料 B、探测器采用的太阳能电池帆板主要成分为晶体硅 C、探测器表面的耐高温隔热陶瓷瓦为新型无机非金属材料 D、运载火箭采用铝合金材料作框架结构,主要利用其质量轻、强度高等优点2. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、14g环丁烷和2-丁烯的混合物中含极性键数目为2NA B、电解硫酸铜溶液,当电路中通过的电子数目为4NA时,阳极产生的气体体积为22.4L C、106gNa2CO3溶于足量的水中,溶液中含有的CO 的数目为NA D、常温下,56gFe与足量的浓硝酸反应产生NO2 , 分子数目为3NA3. 下列关于有机物的说法正确的是( )A、蔗糖和葡萄糖不是同分异构体,但属于同系物 B、C3H6和CH2=CH2都能使酸性KMnO4溶液褪色 C、乙酸乙酯在碱性条件下的水解反应称为皂化反应 D、异丁烷的系统命名为2—甲基丙烷4. 在实验室中用如图装置制备某种气体,对于反应物质和除杂试剂选择合理的是( )

选项
甲中溶液
乙中药品
丙中物质
A
稀盐酸
二氧化锰
饱和食盐水
B
浓硝酸
亚硫酸钠
饱和亚硫酸氢钠溶液
C
双氧水
二氧化锰
浓硫酸
D
浓氨水
碱石灰
浓硫酸
A、A B、B C、C D、D5. 下列解释实验事实的离子方程式正确的是( )A、工业上制漂白粉: B、大理石与食醋的反应: C、向 溶液中滴加少量的 : D、向 中加入过量的HI溶液:6. 中国科学技术大学黄伟新教授和美国橡树岭国家实验室的吴自力研究团队合作,研究在硼基催化剂上丙烷氧化脱氢制丙烯的反应机理,部分反应历程如图。
下列说法错误的是( )
A、丙烷氧化脱氢制丙烯的反应为放热反应 B、该反应历程中决速步骤为C3H8*=C3H7*+H* C、图中的过渡态1不如过渡态2稳定 D、催化剂在反应中参与化学反应,改变反应的活化能7. 下列实验操作能达到相应实验目的的是( )选项
实验操作
实验目的
A
淀粉溶液加稀硫酸共热后,加入新制氢氧化铜悬浊液,加热
检验淀粉是否水解
B
往2支试管中分别加入同体积、等浓度的草酸溶液,再分别加入同体积、不同浓度的KMnO4溶液
依据褪色时间来研究浓度对反应速率的影响
C
H2(g)+I2(g) 2HI(g),压缩反应容器体积
通过颜色深浅变化研究压强对平衡移动的影响
D
向某溶液中加入氢氧化钠固体,加热,将湿润的红色石蕊试纸置于试管口
检验溶液中是否含有铵根离子
A、A B、B C、C D、D8. 有机物F( )是合成某种手性药物的中间体。有关该化合物,下列叙述错误的是( ) A、分子式为C11H16O4 B、能使酸性重铬酸钾溶液变色 C、在酸性条件下,1mol该物质水解生成2molCH3OH D、不存在属于芳香酸的同分异构体9. 市场上出售的“褪字灵”,其本质是利用氧化还原反应,先利用酸性高锰酸钾溶液褪去字迹,再用草酸(H2C2O4)消除高锰酸钾溶液的颜色,下列有关叙述正确的是( )A、草酸在反应中做氧化剂 B、这种“褪字灵”褪字原理和二氧化硫的漂白原理相同 C、除色的离子方程式为2MnO +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O D、每生成1molCO2 , 电子转移数为2NA10. 二氧化氯(ClO2)是自来水常用的消毒剂。某实验小组设计以乙醇为溶剂,利用NaClO3 , 和HCl为原料制备ClO2 , 反应原理为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。反应的装置如图所示(部分夹持装置已略去):
)是合成某种手性药物的中间体。有关该化合物,下列叙述错误的是( ) A、分子式为C11H16O4 B、能使酸性重铬酸钾溶液变色 C、在酸性条件下,1mol该物质水解生成2molCH3OH D、不存在属于芳香酸的同分异构体9. 市场上出售的“褪字灵”,其本质是利用氧化还原反应,先利用酸性高锰酸钾溶液褪去字迹,再用草酸(H2C2O4)消除高锰酸钾溶液的颜色,下列有关叙述正确的是( )A、草酸在反应中做氧化剂 B、这种“褪字灵”褪字原理和二氧化硫的漂白原理相同 C、除色的离子方程式为2MnO +5H2C2O4+6H+=10CO2↑+2Mn2++8H2O D、每生成1molCO2 , 电子转移数为2NA10. 二氧化氯(ClO2)是自来水常用的消毒剂。某实验小组设计以乙醇为溶剂,利用NaClO3 , 和HCl为原料制备ClO2 , 反应原理为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。反应的装置如图所示(部分夹持装置已略去):
已知:ClO2常温下为黄绿色气体,11℃时液化成红棕色液体,易溶于水,ClO2溶于碱溶液生成亚氯酸盐和氯酸盐。
下列说法错误的是( )
A、A装置中仪器甲的名称为三颈烧瓶 B、冰水浴的作用是收集ClO2 , 同时分离出Cl2 C、装置C可以吸收ClO2和Cl2 , 同时防倒吸 D、可以用湿润的淀粉一碘化钾试纸检验ClO2中是否存在Cl211. 科学家根据地康法制氯气原理,设计出一种利用电解原理的新型工业废气氯化氢的利用方案(装置如下图所示,电极为惰性材料)。下列说法正确的是( ) A、A电极接电源负极,电极电势:A<B B、每生成22.4L(标准状况)氯气:溶液中有2mol 移向B电极 C、B电极的电极反应式为 D、该装置中的稀硫酸可用碳酸钠溶液代替12. 金属锂化学性质活泼,广泛应用于冶金工业上制备各种合金。如图是一种制备金属锂的装置。下列说法错误的是( )
A、A电极接电源负极,电极电势:A<B B、每生成22.4L(标准状况)氯气:溶液中有2mol 移向B电极 C、B电极的电极反应式为 D、该装置中的稀硫酸可用碳酸钠溶液代替12. 金属锂化学性质活泼,广泛应用于冶金工业上制备各种合金。如图是一种制备金属锂的装置。下列说法错误的是( ) A、与电极B相连的是电源的正极 B、电极C上的电极反应式为Li++e-=Li C、设计A区的主要原因是碳酸锂导电能力差 D、A区反应的方程式为2Cl2+2Li2CO3=4LiCl+2CO2+O213. 原子序数依次增大的四种短周期主族元素W、X、Y、Z,只有Y、Z位于同周期,X、Y、Z组成的一种化合物M(如图所示)具有强氧化性和漂白性。下列有关叙述正确的是( )
A、与电极B相连的是电源的正极 B、电极C上的电极反应式为Li++e-=Li C、设计A区的主要原因是碳酸锂导电能力差 D、A区反应的方程式为2Cl2+2Li2CO3=4LiCl+2CO2+O213. 原子序数依次增大的四种短周期主族元素W、X、Y、Z,只有Y、Z位于同周期,X、Y、Z组成的一种化合物M(如图所示)具有强氧化性和漂白性。下列有关叙述正确的是( ) A、原子半径的大小顺序为Z>Y>X>W B、将M加入到Z的氢化物水溶液中,有沉淀产生 C、Y与X、Z分别形成的二元化合物中不可能存在共价键 D、Z的氧化物对应的水化物是一种强酸14. 氢氧化锌的性质和氢氧化铝相似,25℃时,测得溶液中Zn2+、[Zn(OH)4]2-物质的量浓度的对数与溶液pH关系如图所示(已知Ksp[Mg(OH)2]=1.1×10-11 , Ksp[Cu(OH)2]=2.2×10-20)。下列说法正确的是( )
A、原子半径的大小顺序为Z>Y>X>W B、将M加入到Z的氢化物水溶液中,有沉淀产生 C、Y与X、Z分别形成的二元化合物中不可能存在共价键 D、Z的氧化物对应的水化物是一种强酸14. 氢氧化锌的性质和氢氧化铝相似,25℃时,测得溶液中Zn2+、[Zn(OH)4]2-物质的量浓度的对数与溶液pH关系如图所示(已知Ksp[Mg(OH)2]=1.1×10-11 , Ksp[Cu(OH)2]=2.2×10-20)。下列说法正确的是( ) A、25℃时,Ksp[Zn(OH)2]的数量级为10-17 B、分离Mg2+和Zn2+ , 要控制pH在8~11之间 C、可以用硫酸锌和氢氧化钠溶液反应制备氢氧化锌 D、加入CuO可以除去硫酸铜溶液中的Zn2+
A、25℃时,Ksp[Zn(OH)2]的数量级为10-17 B、分离Mg2+和Zn2+ , 要控制pH在8~11之间 C、可以用硫酸锌和氢氧化钠溶液反应制备氢氧化锌 D、加入CuO可以除去硫酸铜溶液中的Zn2+二、综合题
-
15. 最近世界各国都在研究“1C化学”,它是以一个碳原子的物质为研究对象,在环境治理和新能源开发等方面有突出贡献。请回答下列问题:(1)、Ⅰ.最近几年,我国北方不少城市居民“谈霾色变”,汽车尾气是雾霾的罪魁之一。汽车尾气净化的原理为:2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-746.5kJ•mol-1。
已知N2(g)+O2(g) 2NO(g) △H=+180.5kJ•mol-1 , 则表示CO燃烧热的热化学方程式为。
(2)、某温度下,在恒容的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如表:时间/s
0
1
2
3
4
5
c(NO)/×10-3mol•L-1
1.00
0.45
0.25
0.15
0.10
0.10
c(CO)/×10-3mol•L-1
3.60
3.05
2.85
2.75
2.70
2.70
①0~2s内用N2表示的化学反应速率为。该温度下,CO的平衡转化率为。
②实验测得,该反应的反应历程如图,其中活化能相对较大的是第步(填“一”或“二”)。
第一步:
 +C—O→
+C—O→  (慢反应)
(慢反应)第二步:
 →N—O+C—O—C(快反应)(3)、某研究小组在实验室以耐高温试剂Ag—ZSW—5催化,测得NO在有无CO的条件下转化为N2的转化率随温度变化情况如图所示:
→N—O+C—O—C(快反应)(3)、某研究小组在实验室以耐高温试剂Ag—ZSW—5催化,测得NO在有无CO的条件下转化为N2的转化率随温度变化情况如图所示:
在 =1条件下,选择温度控制在870K的理由是。
(4)、一定温度下,在恒容反应器中发生如下反应:CO(g)+NO2(g)=CO2(g)+NO(g),化学反应速率v=kpm(CO)pn(NO2)(k为化学反应速率常数,只与温度有关)。实验测得该温度下反应物的分压与化学反应速率的关系如表所示:P(CO)/kPa
v/kPa•s-1
P(NO2)/kPa
10
20
30
10
0.009
0.018
0.027
20
0.018
0.036
0.054
30
0.027
0.054
0.081
若反应初始时p(CO)=p(NO2)akPa,达到平衡,测得体系中p(NO)=bkPa,则此时v=kPa•s-1(用含有a和b的代数式表示)。
(5)、Ⅱ.CO、CO2在现代工业上作用越来越明显。一定温度下,向一固定体积的密闭容器中充入CO、CO2和H2来制备甲醇。测得在不同温度下的化学反应平衡常数如表所示:
化学反应
平衡常数
温度/℃
500
700
800
①2H2(g)+CO(g) CH3OH(g)
K1
2.5
0.34
0.15
②H2(g)+CO2(g) H2O(g)+CO(g)
K2
1.0
1.70
2.52
③3H2(g)+CO2(g) CH3OH(g)+H2O(g)
K3
反应②中的△H=0(填“大于”或“小于”),K3=(用K1、K2表示)
(6)、研究反应①在不同温度、压强下按照相同的物质的量投料反应,测得CO平衡转化率变化如图所示。下列说法正确的是___(填标号)。 A、温度:T1>T2>T3 B、正反应速率:v(a)>v(c),v(b)>v(d) C、平衡常数:K(a)>K(c),K(b)=K(d)16. 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水的处理剂,制备流程如图所示:
A、温度:T1>T2>T3 B、正反应速率:v(a)>v(c),v(b)>v(d) C、平衡常数:K(a)>K(c),K(b)=K(d)16. 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水的处理剂,制备流程如图所示: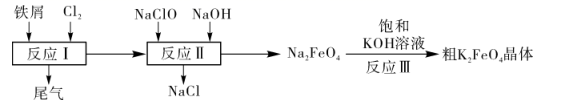
某化学兴趣小组模拟上述流程,在实验室中探究制备K2FeO4的方法,回答下列问题:
查阅资料:K2FeO4具有强氧化性,在酸性或中性溶液中易快速产生O2 , 在碱性溶液中较稳定。
(1)、反应Ⅲ中能够得到高铁酸钾的原因是。(2)、若实验室用高锰酸钾与浓盐酸制取少量氯气,则反应的最佳装置应选用图中的(填标号),反应的离子方程式为。a.
 b.
b. 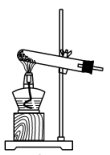
c.
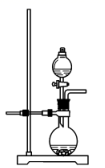 d.
d. 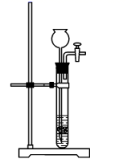 (3)、制备K2FeO4的实验装置如图。装置中仪器乙的名称为 , 实验时应先打开活塞K2的原因是 , 为了提高氯气的利用率,可采取的措施是。
(3)、制备K2FeO4的实验装置如图。装置中仪器乙的名称为 , 实验时应先打开活塞K2的原因是 , 为了提高氯气的利用率,可采取的措施是。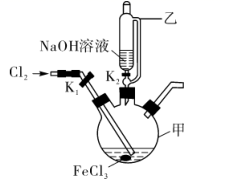 (4)、验证酸性条件下氧化性 >Cl2的实验方案为:取少量K2FeO4固体于试管中,(实验中须使用的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)。(5)、根据K2FeO4的制备实验得出:氧化性Cl2> ,和第(4)小题实验表明的Cl2和 的氧化性强弱关系相反,原因是。17. 工业上利用铝土矿(主要成分Al2O3 , 含少量Fe2O3、SiO2等杂质)与磷肥厂的含氟废气(主要成分SiF4、HF)生产冰晶石(Na3AlF6)的工艺流程如图:
(4)、验证酸性条件下氧化性 >Cl2的实验方案为:取少量K2FeO4固体于试管中,(实验中须使用的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)。(5)、根据K2FeO4的制备实验得出:氧化性Cl2> ,和第(4)小题实验表明的Cl2和 的氧化性强弱关系相反,原因是。17. 工业上利用铝土矿(主要成分Al2O3 , 含少量Fe2O3、SiO2等杂质)与磷肥厂的含氟废气(主要成分SiF4、HF)生产冰晶石(Na3AlF6)的工艺流程如图:
已知:①反应2的化学方程式为Na2SiF6+4NH3·H2O=2NaF+4NH4F+SiO2↓+2H2O。
②冰晶石(Na3AlF6)微溶于水。
回答下列问题:
(1)、操作1的名称是 , 反应3中得到的滤渣的主要成分是(填化学式)。(2)、从滤液中得到绿矾的操作为、、过滤、洗涤、干燥,检验绿矾是否被氧化的试剂是。(3)、加入BaS除杂,得到的滤渣中含有S,写出产生S的离子方程式:。(4)、反应2中二氧化硅的产率和冰晶石纯度与pH的关系如图,反应2最好控制在pH=条件下进行,该反应不能在较高温度下进行,原因是。 (5)、上述流程中可循环使用的物质名称为。18. 铁与镁组成的合金是目前已发现的储氢密度最高的储氢材料之一,回答下列问题:(1)、下列铁的外围电子排布图中,再失去一个电子需要能量最大的是(填标号)。
(5)、上述流程中可循环使用的物质名称为。18. 铁与镁组成的合金是目前已发现的储氢密度最高的储氢材料之一,回答下列问题:(1)、下列铁的外围电子排布图中,再失去一个电子需要能量最大的是(填标号)。A.
 B.
B. 
C.
 D.
D. 
在第四周期过渡元素中,基态原子未成对电子数比铁多的元素为(填元素符号)。
(2)、甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。①(H2NCH2COO)2Fe中含有第二周期元素的第一电离能由大到小的顺序为(用元素符号表示),碳原子的杂化类型为。
②甘氨酸H2NCH2COOH的沸点比相同相对分子质量的烷烃大很多,原因是。
(3)、硫酸亚铁(FeSO4)可用于制造甘氨酸亚铁,SO 的空间构型为 , 二聚体氯化铁分子结构对称,试写出二聚体氯化铁分子的结构。(4)、铁与镁组成的其中一种储氢合金的晶胞结构如图所示(晶胞的边长为dnm)。①晶胞中铁原子的配位数为。
②图中a处原子的坐标参数为 , 合金的密度为g•cm-3。
 19. 如图是一种合成治疗具有手性的心脑血管药物F(一种环内酯)的路线图:
19. 如图是一种合成治疗具有手性的心脑血管药物F(一种环内酯)的路线图:
已知:①RX+Mg RMgX(X=Cl、Br、I)
②RMgBr+CO2→RCOOH
③RMgBr+R'CHO

回答下列问题:
(1)、B的化学名称为(用系统命名法表示),E中官能团的名称为。(2)、用*标出E中的手性碳原子 , G的结构简式为。(3)、步骤②反应的化学方程式为 , E→F的反应类型为。(4)、F有多种同分异构体,写出一种满足下列条件的同分异构体的结构简式:。①除苯环外无其他环
②能发生银镜反应
③核磁共振氢谱为4组峰,峰面积比为9∶2∶2∶1
(5)、参照上述合成路线,以乙烯和甲苯为原料,设计制备 的合成路线: (其他试剂任选)。
的合成路线: (其他试剂任选)。