河北省邢台市2021-2022学年高二上学期化学第一次联考试卷
试卷更新日期:2021-11-01 类型:月考试卷
一、单选题
-
1. 化学与生产、生活密切相关,下列说法正确的是( )A、氢气燃烧过程中热能转化为化学能 B、使用硅制太阳能电池可以减少对煤、石油等化石燃料的依赖 C、在食品袋中放入装有硅胶、生石灰的透气小袋,可防止食物因氧化而变质 D、臭氧—生物活性炭用于自来水深度处理,是利用了活性炭的还原性2. 下列反应的焓变与如图所示图像相符的是( )
 A、盐酸与碳酸氢钠反应 B、灼热的炭与二氧化碳反应 C、过氧化氢的分解 D、氢氧化钡晶体与氯化铵反应3. 已知: 。若反应速率分别用 、 、 、 表示,则下列关系正确的是( )A、 B、 C、 D、4. 下列说法正确的是( )A、活化分子之间的碰撞一定是有效碰撞 B、一定条件下,发生反应 ,则石墨比金刚石稳定 C、在一恒容密闭容器中发生反应 ,仅增加 的质量,反应速率加快 D、对于反应 ,反应达到平衡后,保持其他条件不变,增大压强,化学平衡常数增大5. 在一密闭容器中,对于可逆反应 ,下列能正确表示该反应的平衡常数表达式的是( )A、 B、 C、 D、6. 在 、 下,下列热化学方程式中 能表示有关物质燃烧热的是( )A、 B、 C、 D、7. 下列事实不能用勒夏特列原理解释的是( )A、合成氨时增大压强,有利于提高氨气的产率 B、实验室常用排饱和食盐水的方法收集氯气 C、向新制氯水中滴入几滴NaHCO3溶液,可增强溶液的漂白能力 D、在反应 的平衡体系中,增大压强,体系颜色加深8. 在一密闭容器内充入一定量的CO和 ,在一定条件下发生反应: 。该反应的逆反应速率与时间的关系如图所示(反应达到平衡后,只发生某一条件改变),下列说法正确的是( )
A、盐酸与碳酸氢钠反应 B、灼热的炭与二氧化碳反应 C、过氧化氢的分解 D、氢氧化钡晶体与氯化铵反应3. 已知: 。若反应速率分别用 、 、 、 表示,则下列关系正确的是( )A、 B、 C、 D、4. 下列说法正确的是( )A、活化分子之间的碰撞一定是有效碰撞 B、一定条件下,发生反应 ,则石墨比金刚石稳定 C、在一恒容密闭容器中发生反应 ,仅增加 的质量,反应速率加快 D、对于反应 ,反应达到平衡后,保持其他条件不变,增大压强,化学平衡常数增大5. 在一密闭容器中,对于可逆反应 ,下列能正确表示该反应的平衡常数表达式的是( )A、 B、 C、 D、6. 在 、 下,下列热化学方程式中 能表示有关物质燃烧热的是( )A、 B、 C、 D、7. 下列事实不能用勒夏特列原理解释的是( )A、合成氨时增大压强,有利于提高氨气的产率 B、实验室常用排饱和食盐水的方法收集氯气 C、向新制氯水中滴入几滴NaHCO3溶液,可增强溶液的漂白能力 D、在反应 的平衡体系中,增大压强,体系颜色加深8. 在一密闭容器内充入一定量的CO和 ,在一定条件下发生反应: 。该反应的逆反应速率与时间的关系如图所示(反应达到平衡后,只发生某一条件改变),下列说法正确的是( ) A、 时,某一条件改变可能是移除部分 B、 时,某一条件改变可能是降低温度 C、 时,某一条件改变可能是增大 和 的浓度 D、 时,某一条件改变可能是充入少量稀有气体9. 用如图所示的装置测定不同浓度的稀硫酸与纯铝反应制取 的反应速率,按照装置图组装3套完全相同的装置(气密性良好)。首先将注射器推至最底端,然后在三个锥形瓶中分别放入相同形状的块状纯铝 ,最后通过分液漏斗向三个锥形瓶中分别加入 、 和 的稀硫酸各 (忽略溶液体积的变化及反应温度的影响)。
A、 时,某一条件改变可能是移除部分 B、 时,某一条件改变可能是降低温度 C、 时,某一条件改变可能是增大 和 的浓度 D、 时,某一条件改变可能是充入少量稀有气体9. 用如图所示的装置测定不同浓度的稀硫酸与纯铝反应制取 的反应速率,按照装置图组装3套完全相同的装置(气密性良好)。首先将注射器推至最底端,然后在三个锥形瓶中分别放入相同形状的块状纯铝 ,最后通过分液漏斗向三个锥形瓶中分别加入 、 和 的稀硫酸各 (忽略溶液体积的变化及反应温度的影响)。
实验
加入的稀硫酸的浓度
反应时间
收集到的气体/mL
反应速率
①
15
18
②
18
③
18
12
下列说法错误的是( )
A、实验①测得 的反应速率为 B、实验②中反应结束后,生成 的体积为 C、实验②中 的取值范围为 D、实验③中,若将块状纯铝碾碎成粉末,反应开始至收集到相同体积的气体时,反应速率一定大于10. 已知下列3个热化学方程式(K为平衡常数):①
②
③
则 和 的表达式分别为( )
A、 B、 C、 D、11. 所给图示与对应的叙述不相符的是( ) A、图1:某吸热反应分别在有、无催化剂的情况下反应的能量变化 B、图2:探究温度对化学平衡的影响 C、图3:探究不同催化剂对同一反应的反应速率的影响 D、图4:探究温度对氢氧化钙溶解度的影响
A、图1:某吸热反应分别在有、无催化剂的情况下反应的能量变化 B、图2:探究温度对化学平衡的影响 C、图3:探究不同催化剂对同一反应的反应速率的影响 D、图4:探究温度对氢氧化钙溶解度的影响二、多选题
-
12. 在一恒容密闭容器中发生反应: 。起始时, , , 。在一定条件下,当反应达到平衡时,下列各物质的浓度关系可能正确的是( )A、 B、 C、 D、13. 一定条件下,等物质的量的 和 在一恒容密闭容器中发生反应: 。如图所示,曲线a表示该反应在 时X的物质的量浓度随时间的变化,曲线b表示该反应在某一反应条件改变时X的物质的量浓度随时间的变化。下列说法错误的是( )
 A、 时,x的平衡转化率为 B、 时,随着反应的进行,混合气体的平均相对分子质量逐渐增大 C、若曲线a和b发生反应时除温度外,其他条件均相同,则反应达到平衡后,该反应的平衡常数 D、若曲线b对应的是改变反应温度,则可判断该反应中反应物的键能总和小于生成物的键能总和
A、 时,x的平衡转化率为 B、 时,随着反应的进行,混合气体的平均相对分子质量逐渐增大 C、若曲线a和b发生反应时除温度外,其他条件均相同,则反应达到平衡后,该反应的平衡常数 D、若曲线b对应的是改变反应温度,则可判断该反应中反应物的键能总和小于生成物的键能总和三、综合题
-
14. 硫及其化合物的转化是资源利用和环境保护的重要研究课题之一、回答下列问题:(1)、已知: 。
①当参加反应的硫粉的质量为g时,发生上述反应放出的热量为 。
②此时生成的气体体积为L(气体已换算成标准状况)。
(2)、接触法制硫酸生产中的关键工序是 的催化氧化。①已知反应: 。每断裂 键时,该反应放出 的热量,则该反应中的 。在(填“低温”或“高温”)条件下有利于该反应自发进行,判断的依据是。
②在 下,黄铁矿(主要成分为 )的燃烧是工业上制硫酸时得到 的途径之一, 完全燃烧生成 和 时,放出的热量为 ,写出 燃烧的热化学方程式:理论上 黄铁矿( 的含量为 ,杂质不参与反应)完全燃烧生成 的物质的量为 ,转移的电子数为 。
(3)、将某工业废气中的 排放至大气前先用碱液吸收,可适当降低酸雨的浓度。将 通入 溶液中充分反应(不考虑气体逸出),测得反应放出 的热量。已知该条件下, 通入 溶液中充分反应放出 的热量。则下列热化学方程式可正确表示 与 溶液反应生成 的是_______(填标号)。A、 B、 C、 D、15. 一定温度下,向5L某恒容密闭容器中充入一定量的气体M和N,发生反应: 。容器中M、N、R的物质的量随时间的变化如图所示。回答下列问题:(1)、上述可逆反应中的化学计量数 ;反应第一次达到平衡时,R的物质的量分数为。 (2)、在 内,下列关于上述可逆反应的说法正确的是_______(填标号)。A、M的正反应速率: B、b点时, ,则该反应达到平衡 C、升高温度,正、逆反应速率均增大, 也增大 D、加入适宜的催化剂,N的平衡转化率保持不变(3)、若 末,仅改变温度:
(2)、在 内,下列关于上述可逆反应的说法正确的是_______(填标号)。A、M的正反应速率: B、b点时, ,则该反应达到平衡 C、升高温度,正、逆反应速率均增大, 也增大 D、加入适宜的催化剂,N的平衡转化率保持不变(3)、若 末,仅改变温度:①则上述可逆反应在 内, 。
② 时反应达到平衡,保持温度不变,再往该恒容密闭容器中充入 和 ,对于反应 ,此时 (填“>”、“<”或“=”) ,判断的依据是。
(4)、若将 与 的混合气体充入该容器中,发生上述反应,反应至某时刻时各物质的量恰好满足: 。则原混合气体中 。(5)、若某温度下,在4个容积相同的恒容密闭容器中,以不同的投料方式进行上述反应。根据在相同时间内测定的结果,判断进行该反应由快到慢的顺序为(填标号)。①
②
③
④
16. 当今,世界各国相继规划了碳达峰、碳中和的时间节点。因此,研发 利用技术、降低空气中 含量成为了研究热点。为减少 对环境造成的影响,可采用以下方法将其资源化利用。(1)、 催化加氢制甲醇一定温度下,在某恒容密闭容器中充入一定量的 和 ,发生反应: 。下列叙述能说明该反应已达到平衡状态的是_______(填标号)。
A、混合气体的密度不再随时间变化而改变 B、气体的压强不再随时间变化而改变 C、 的物质的量分数不再随时间变化而改变 D、单位时间内每形成 键,同时断裂 键(2)、 催化加氢合成乙烯在 某恒容密闭容器中,充入 和 ,发生反应: 。反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
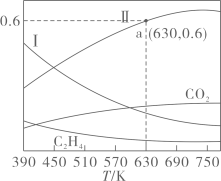
①该反应的 (填“>”或“<”)0,曲线Ⅰ和曲线Ⅱ分别表示(填化学式,下同)和的变化曲线。
②根据图中a点,计算该温度下平衡时的 , , 的平衡转化率为 (保留三位有效数字)。
③若平衡时a点容器内气体的总压强为 ,则该反应的平衡常数 (列出计算式,用分压表示,分压 总压 物质的量分数)。
(3)、 用途广泛,写出其基于物理性质的一种用途:。17. 某学校实验小组用0.55 mol/L的NaOH溶液和0.50 mol/L的稀盐酸进行中和反应的反应热测定(在稀溶液中,酸和碱的密度与水的密度近似)。(1)、Ⅰ.配制0.55 mol/L的NaOH溶液若实验中大约要使用80 mLNaOH溶液需要用托盘天平称量NaOH固体g,溶液配制过程中所需用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和。
(2)、Ⅱ.测定稀盐酸和氢氧化钠稀溶液发生中和反应的反应热的实验装置如图所示:
①仪器a的名称为。
②(填“能”或“不能”)用相同形状的细铁丝代替仪器a进行实验,理由是。
③反应后生成的溶液的比热容 ,则 溶液和 。稀盐酸发生中和反应的反应热 (已知起始时平均温度为 ,反应后最高温度为 ,忽略量热计的比热容)。
(3)、若将 稀硫酸和 未知浓度的 溶液均匀混合后测量并记录溶液温度,实验结果如图所示(实验中始终保持 )。
①做该实验时的环境温度(填“低于”、“高于”或“等于”)22℃。
②该NaOH溶液的物质的量浓度为mol/L。